不同新型冠状病毒核酸检测试剂性能比较分析
张伟宏,马 雯,李富荣,葸 静,金哲宇,4,崔学强,何瑞芬,张俊华,朴文花
由新型冠状病毒(SARS-CoV-2)感染引起的新型冠状病毒肺炎(COVID-19)在世界范围内迅速蔓延,RT-qPCR 检测新冠病毒核酸阳性作为诊断疾病的标准,在疾病的防控中发挥了重要的作用[1]。目前经批准上市的新冠病毒核酸检测试剂主要针对病毒基因组中3 段保守基因序列,即以开放读码框1ab(ORF1ab)、核壳蛋白(N)基因以及包膜蛋白(E)基因作为检测靶标[2]。然而,在临床实际工作中发现,新冠病毒核酸检测对于阳性患者的阳性率仅为30%~50%,临床较多的疑似病例需要多次核酸检测之后才得到阳性结果,使新冠病毒核酸检测作为确诊标准备受质疑[3]。核酸检测试剂在检测体系中具有极其重要的作用,基于目前新冠病毒核酸检测中所出现的问题,本文采用6 种国内已注册的新型冠状病毒核酸检测试剂盒,通过比较其基本情况及实时荧光定量PCR 扩增结果等参数,为使用者合理选择试剂提供参考依据。
1 材料与方法
1.1 标本来源:收集5 例新型冠状病毒确诊患者的咽部拭子作为标本,按照规定采样后立即送往实验室检测,标本检测前置于65 ℃水浴20 min 进行灭活。
1.2 检测试剂:核酸提取选用罗氏MagNA Pure LC total Nucleic Acid Isolation(批号:44502300),扩增选取6 个不同企业生产的新型冠状病毒核酸检测试剂盒,随机编号为A~F 号。A 号试剂批号为20200810,B 号试剂批号为2020003,C 号试剂批号为2020008,D 号试剂批号为20200202,E 号试剂批号为20200309,F 号试剂批号为20200224A。所有试剂盒均批检合格并在有效期内使用。
1.3 检测仪器:①安徽嘉文JW-2018H 高速冷冻离心机;②Thermo Fisher NanoDrop One 紫外/可见分光光度计;③罗氏MP24 全自动核酸提取仪;④ABI 7500 实时荧光定量PCR 仪。
1.4 实验室检测
1.4.1 RNA 提取:总RNA 的提取使用罗氏MP24 全自动核酸提取仪及其配套核酸提取试剂MagNA Pure LC total Nucleic Acid Isolation (批 号:44502300),严格按照操作流程操作。提取的核酸使用NanoDrop One 紫外/可见分光光度计测量核酸浓度及A260/A280 比值。
1.4.2 核酸扩增:使用ABI 7500 PCR 仪根据不同厂家提供的新型冠状病毒SARS-CoV-2 核酸检测试剂盒说明书设置荧光检测通道及反应程序,并对检测结果进行阴性、阳性判定。采用1∶4,1∶16,1∶64,1∶256 倍比稀释核酸,使用6 种不同核酸检测试剂进行核酸检测。6 种试剂核酸上样量、荧光检测和扩增循环数及结果判断不同,参照各自试剂盒说明书进行检测。
1.4.3 质量控制:每批试验均带阴性和阳性对照,阴性和阳性对照检测结果在控,则该批次试验有效,反之无效。
1.5 安全与防护:实验人员严格按照《医疗机构临床基因扩增检验实验室管理办法》[4]《国家卫生健康委办公厅关于印发新型冠状病毒实验室生物安全指南(第二版)的通知》[5]及《新型冠状病毒感染的肺炎实验室检测技术指南(第四版)》[6]相关文件进行实验操作和生物安全防护。
1.6 统计学方法:数据分析使用SPSS22.0 软件,核酸经稀释后的扩增数据使用重复测量的多元方差分析,以P<0.05 为差异具有统计学意义。图表使用GraphPad Prism 8.0.2 软件进行绘制。
2 结果
2.1 核酸检测试剂盒基本情况的比较:6 种新冠病毒核酸检测试剂盒的基本情况见表1。各试剂均使用IC 基因作为内部检测对照,其中D 试剂仅检测1个ORF1ab 靶基因,E 试剂检测ORF1ab、N、E 3 个靶基因,其余4 个试剂检测ORF1ab、N 2 个靶基因。核酸起始加入量最少是C 试剂仅为2 μl,最大量B试剂为20 μl,D 试剂为10 μl,其他3 个为5 μl。扩增循环数C、D、F 试剂为40 个,而A、B、E 试剂为45个。扩增总用时A 试剂最长为115 min,其次为B 试剂105 min,C 为98 min,其他3 个试剂在80 min 左右。结果判断A 和B 试剂Ct 值≤40,D 和F 试剂≤38,C 试剂≤37,而E 试剂≤43。试剂的灵敏度最小为D 试剂仅为100 Copies/mL,B 试剂为200 Copies/mL,A、C 试剂为500 Copies/mL,E、F 试剂为1 000 Copies/mL。RT-PCR 具体条件也各自不相同,见表1。
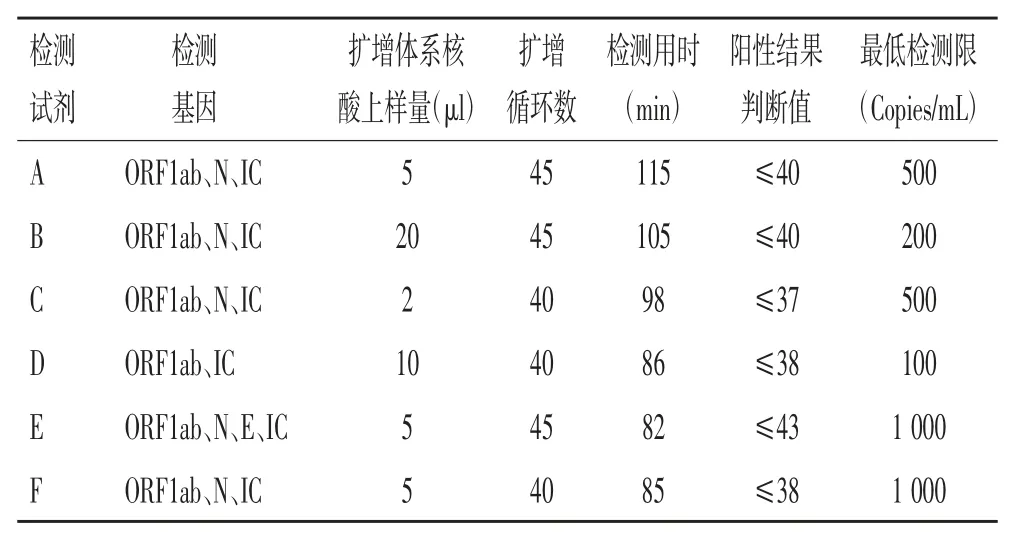
表1 6 种不同新冠病毒核酸检测试剂盒基本情况比较
2.2 扩增结果的比较:对5 例确诊患者的咽拭子标本进行核酸提取,其总RNA 经检测核酸浓度为(47.480±9.890)ng/μl,A260/A280 为(1.924±0.305)ng/μl,核酸质量及纯度符合实验要求。使用洗脱液按照1∶4、1∶16、1∶64、1∶256 稀释提取出的5 份样本的总RNA,6 种试剂盒平行操作,RT-qPCR 扩增新型冠状病毒的相关基因。各基因检测结果的Ct 值见表2。E 试剂在各个稀释度均可检出ORF1ab、N、E、IC基因。A、B 试剂不检测E 基因,在1∶256 稀释时无法检出ORF1ab、N 基因;D 试剂不检测E 基因和N 基因,在1∶256 稀释时无法检测出ORF1ab 基因。C 试剂在1∶64 时无法检测ORF1ab、N 基因;F 试剂不检测N 基因,自1∶16 之后即无法检出ORF1ab 基因,1∶256 时无法检出N 基因。各试剂盒相比较差异无统计学意义(P>0.05)。
表2 不同稀释度时各试剂检测结果的Ct 值(±s)

表2 不同稀释度时各试剂检测结果的Ct 值(±s)
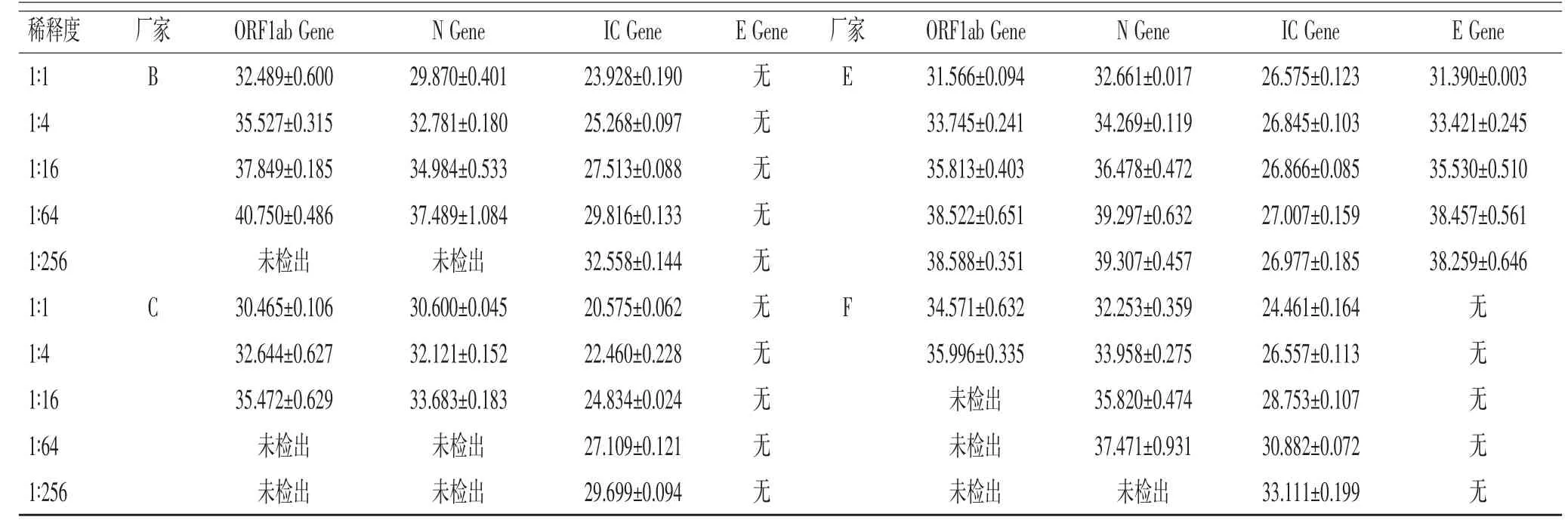
不同试剂检测时IC 基因、N 基因、ORF1ab 基因的Ct 值及△Rn 值变化,可见随着稀释倍数的增加,各基因的Ct 值随之增加,其中E 试剂使用外标形式检测IC 基因,所以IC 基因的Ct 值未出现增加的趋势。稀释倍数增加后总RNA 浓度下降,扩增后ORF1ab和N 基因的△Rn 值显著降低,在1∶256 稀释时明显降低。
3 讨论
核酸检测具有早期、敏感、特异性高、易操作等优势,但对于核酸检测结果的准确性,需要从样本类型、质量、实验因素、试剂盒性能及患者感染周期等影响因素来综合分析[7-8],尤其针对疑难病例应当更加严格地控制检测的准确性。本研究分析比较了6种国产新型冠状病毒核酸检测试剂对阳性新冠肺炎患者标本检测的结果,发现6 种试剂盒的检测能力差异明显。其中E 试剂检测能力较好,在各稀释度对SARS-CoV-2(ORF1ab 基因、N 基因)均能检出,并且可检测其他试剂不检测的E 基因,较为理想。其他几种试剂在对ORF1ab 基因和N 基因检测时均出现了未检出的情况,表明使用该试剂对病毒载量低的样本检测时存在假阴性的可能。分析原因可能由于疫情突发,各厂家在试剂的设计方面技术还有待完善,扩增时引物无法与靶位点特异性的结合,导致假阴性出现[9]。另一方面或许与试剂对不同位点的检测灵敏度相关,试剂对不同位点的敏感性存在差异,进而导致某些位点的漏检[10-11]。低浓度的样品往往对试剂盒的灵敏度有较高要求,如果试剂盒检测下限较高,则会导致假阴性结果,因此,在使用新的试剂盒或更换批号时,需要进行全面的性能验证,以满足实验室的检测要求[12-13]。本实验中,由于阳性样本数量有限,无法进一步对试剂盒的特异性、检测下限及抗干扰能力等特性进行检测分析,后续需要进一步完善。
根据郭元元、沈利华等对国产SARS-CoV-2 核酸检测试剂的研究发现,不同厂家的试剂盒检测能力差异较大[14-15]。现有试剂盒主要包括ORF1ab 单靶标检测试剂盒,ORF1ab、N 基因的双靶标检测试剂盒,同时包含ORF1ab、N 基因与E 基因的三靶标检测试剂盒,在使用RT-qPCR 检测新型冠状病毒时,检测试剂应选择至少含2 个位点的产品。在实验室确认阳性病例时,须满足以下条件:同一份标本中的2 个靶标(ORF1ab、N 基因)特异性RT-qPCR 检测结果均为阳性。如果出现单个靶标阳性的检测结果,则需要重新采样,重新检测。
在研究过程中,本实验室仅使用各厂家某一批号的试剂盒进行检测,检测前按照规定对试剂盒进行了验证,以保证结果的准确性。但由于阳性标本仅有5 例,可能难以代表该试剂盒的整体检测性能。下一步我们将扩大标本量,从多个角度,多个方面综合分析影响新型冠状病毒核酸检测结果的因素,为实验室检测提供更为真实、准确、可靠的参考依据。
综上所述,在突发的公共卫生事件下,很多试剂盒设计欠佳,后续还需要优化。无论是为了病毒核酸检测的准确性,用于病原学诊断需求,还是对复工复产复学人群的核酸筛检的疫情精准防控,各检测实验室在有条件的前提下,建议同时使用两种厂家试剂进行检测。

