猕猴桃溃疡病防治药剂拮抗性的室内试验①
闫书贵 刘 原
(1四川省苍溪县职业高级中学 四川苍溪 628400;2四川苍溪猕猴桃研究所 四川苍溪 628400)
猕猴桃溃疡病是一种传播速度快,危害非常严重的毁灭性细菌性病害。由于劳动力成本高,果农为了省钱,经常将各种防治溃疡病的药剂与其他防治病虫害的药剂进行混合施用,由于药剂之间的拮抗作用,大大降低了溃疡病防治药剂的有效性。为了摸清溃疡病防治药剂与其他病虫害防治药剂的拮抗性,从而筛选出更加科学的猕猴桃病虫害防治药剂配伍,针对性开展试验。
1 供试猕猴桃溃疡病菌的分离与鉴定
1.1 供试病样采集
病枝、病叶是在四川省苍溪县中土镇“红阳”猕猴桃园采取,枝条上病斑占枝条周长1/2~2/3,叶片病斑总面积占叶面积1/2以上。
1.2 供试培养基
LB固体培养基:胰蛋白胨10 g,琼脂粉10~15 g,氯化钠10 g,酵母粉5 g,蒸馏水1 L。
LB液体培养基:胰蛋白胨10 g,氯化钠10 g,酵母粉5 g,蒸馏水1 L。
1.3 病原菌的分离与纯化
病原菌样品的分离:从采集的枝或叶上选择发病典型的病斑,用剪刀在病健结合部剪取边长3~4 mm的方形小块病组织,依次放入75%酒精中浸泡15 s和0.1%升汞液中浸泡40 s进行消毒,无菌水连续漂洗3~5次,用无菌滤纸去除病组织上残留水分,放入无菌离心管中用镊子捣烂,加入无菌水浸泡15 min待用。用接种环蘸取浸泡液在培养基上进行划线培养(25℃人工智能气候箱),待菌落长出后,取疑似单菌落进行PCR鉴定,鉴定为猕猴桃溃疡病菌的单菌落。
病原菌的纯化:经3次划线法纯化后作为试验菌种保存备用。将纯化菌种用液体培养基从平板上用三角涂布棒清洗下来,再将40%的甘油与带菌的液体培养基按1∶1混合,然后分装于冻存管内,移至-80℃冰箱保存。
1.4 病原菌的分子鉴定
(1)引物:根据Rees-George等[1]利用细菌16S-23S rDNA ITS内转录间隔区序列设计筛选的猕猴桃溃疡病菌(Pseudomonas syringae pv.actinidiae)特异性引物对PsaF1/PsaR2:
PsaF1: 5'-TTTTGCTTTGCACACCCGATTTT-3'
PsaR2: 5'-CACGCACCCTTCAATCAGGATG-3'
由上海生工生物工程有限公司合成。
(2)PCR扩增反应体系:取少量菌作为模板,2×Taq mastermix 12.5μL,上下引物(10μmol/L)各1μL,用无菌超纯水补足体积到25μL,混匀后进行PCR反应,无菌超纯水做对照。
(3)PCR扩增条件:94℃弱变性4 min,94℃变性30 s,55℃退火30s,72℃延伸1 min,34个循环,72℃总延伸10 min,12℃保存。
PCR反应产物用1%琼脂糖凝胶电泳进行电泳分离,1×TAE作为电泳缓冲液,电泳结束后在凝胶成像系统下成像并分析,预期产物为280 bp。
1.5 结果与分析
采集、分离的病原菌,通过引物PsaF1/ PsaR2对分离菌种进行PCR扩增,产物经1%的琼脂糖凝胶电泳分离,得到大小约280 bp的特异性片段,片段大小与引物设计大小相符合,其属于猕猴桃溃疡病菌(Pseudomonas syringae pv.actinidiae)。
1.6 试验结论
本试验利用Rees-George等筛选的猕猴桃溃疡病菌特异性引物,对分离得到的病原菌进行PCR扩增、琼脂糖电泳检测,确定分离的病原菌为猕猴桃溃疡病菌-丁香假单胞杆菌猕猴桃致病变种(Pseudomonas syringae pv.actinidiae),这与刘瑶等[2]对四川省猕猴桃溃疡病菌分离鉴定的结果一致。
2 药剂拮抗性的室内试验
2.1 供试药剂
课题组从苍溪县猕猴桃溃疡病防治常用药剂中筛选出8种常用药剂,筛选常用杀真菌剂1种和杀虫剂1种,共10种。

表1 供试的10种药剂
2.2 供试病菌
猕猴桃溃疡病菌(Pseudomonas syringae pv.actinidiae),上述分离纯化保存的菌种。
2.3 培养基
LB固体培养基:10 g氯化钠,10 g胰蛋白胨,5 g酵母粉,10~15 g琼脂粉,1 L蒸馏水。
2.4 试验方法
2.4.1 菌悬液的配制
将上述保存菌株转到培养基上活化培养48 h后,用无菌水冲洗稀释,根据文献OD600=0.3~0.4,细菌的浓度约为2×108CFU/ mL[3],用紫外分光光度计在波长600 nm处测菌悬液的吸光值范围在0.3~0.4即可,无菌水调零。
2.4.2 药剂对猕猴桃溃疡病菌的室内抑菌测定
参照焦红红[4]滤纸片抑菌圈法改进进行试验。
(1)在超净工作台上,将融化后冷却至60℃左右的LB培养基倒入直径9 cm的培养皿内约25 mL备用。用移液枪取上述配制好的菌悬液200 µL加入培养基中,在培养基凝固之前迅速将二者充分混匀制成带菌平板,每个平板放置直径6 mm的灭菌滤纸片1-3个。
(2)将10种药剂按用药指导说明配成比生产使用浓度大10倍的溶液(表2),用移液枪取药液200 µL依次加入到滤纸片上,以无菌水浸泡的滤纸片为对照。试验重复3次,25℃恒温培养中培养48 h后,观察滤纸片周围有无明显的抑菌现象。
(3)用直尺测量抑菌圈直径,记录数据,计算抑制率。
抑制率/%=(处理菌落直径-对照菌落直径)/处理菌落直径×100%
2.4.3 药剂配伍对猕猴桃溃疡病菌的室内抑菌测定
将上述配制的8种溃疡病防治药剂分别与药剂A嘧霉胺按1∶1配伍,与药剂B螺虫乙酯按1∶1配伍,以及与药剂A和B按1∶1∶1配伍,按上述2.4.2方法进行抑菌试验。
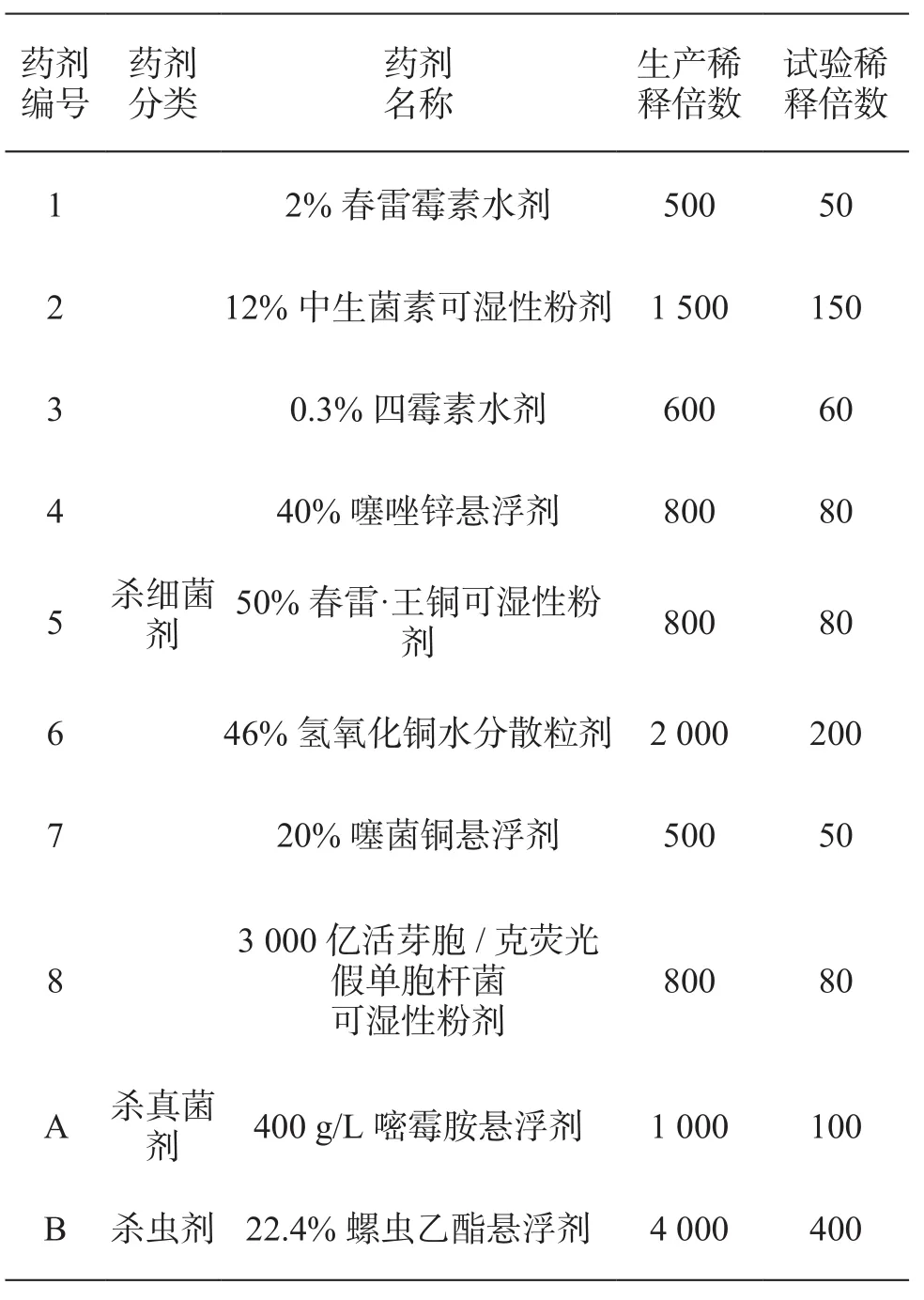
表2 供试10种药剂产品的稀释浓度
2.5 拮抗性试验结果与分析
8种防治猕猴桃溃疡病的药剂分别与杀真菌剂嘧霉胺和杀虫剂螺虫乙酯进行两两配伍,以及三大类药剂配伍时,除了四霉素和螺虫乙酯配伍抑菌效果略有增强,其余药剂配伍抑菌效果均不如单剂的抑菌效果,抑制率均有下降。其中,荧光假单胞杆菌单剂与不同类药剂配伍抑菌效果下降不显著,抑制率下降比例不超过6.7%;其次四霉素与嘧霉胺配伍抑制率下降8.16%,与螺虫乙酯配伍抑菌效果略微增强1.02%,但三大类药剂配伍抑制率下降16.8%;铜制剂春雷·王铜与不同类药剂配伍抑菌效果下降最显著;溃疡病防治药剂单剂配伍后抑制率下降幅度依次是:荧光假单胞杆菌<四霉素<中生菌素<春雷·王铜;总体下降幅度呈现与螺虫乙酯配伍<与杀真菌剂嘧霉胺配伍<三大类药剂配伍;中生菌素、春雷·王铜与嘧霉胺、螺虫乙酯三大类药剂配伍后完全无抑菌作用(如表3)。

表3 8种药剂产品对猕猴桃溃疡病菌的抑制作用
2.6 拮抗性试验结论与讨论
2.6.1 生产上个别常用猕猴桃溃疡病防治药剂室内抑菌效果差
通过本次室内抑菌试验发现,春雷霉素、噻唑锌、氢氧化铜、噻菌铜等生产上常用溃疡病防治药剂的室内抑菌作用不明显,分析可能是由于连年使用些药剂,造成猕猴桃溃疡病菌发生变异,或产生抗药性。
2.6.2 不同类型的药剂配伍会增加拮抗性
通过该试验发现,猕猴桃溃疡病防治单剂与其他防治病虫害药剂配伍后,会显著增加药剂间的拮抗性,从而影响其对溃疡病菌的抑制作用。建议果农在防治溃疡病时将杀细菌剂单独施用,尽量避免混合后降低药效,尤其是铜制剂作为碱性药剂更不能与其它药剂混用。

