不同酿酒酵母共发酵对干红葡萄酒理化特性和香气组分的影响
朱娟娟,马海军*,李敏,刘雅琴,倪志婧,王薇,陈凤英,李亚罡
1(北方民族大学 生物科学与工程学院,宁夏 银川,750021)2(宁夏葡萄与葡萄酒技术创新中心,宁夏 银川,750021)
酿酒酵母(Saccharomycescerevisiae)是酿造葡萄酒的主体菌种,除将原料中糖转化为酒精外,还能将原料中的氨基酸等前提物质转换为酯、酸、高级醇等风味物质,并合成多种酶,且花青素与酵母细胞和酵母代谢物的相互作用可以直接影响花青素的含量和组成以及葡萄酒颜色,从而对葡萄酒色泽、风味复杂性和口感有重要影响[1-2]。
随着我国葡萄酒产业的迅速发展,单一菌种的普遍应用引起葡萄酒风味特征同质化,降低商业竞争力,但考虑到不同菌株的次级代谢产物存在差异,混菌发酵逐渐受到酿酒师们的关注。目前,混菌发酵有两种类型,一种是酿酒酵母与非酿酒酵母(non-Saccharomyces)混合发酵;另一种是不同酿酒酵母混合发酵。虽然非酿酒酵母与酿酒酵母混合发酵能够改善葡萄酒的组成和香气,但也存在一些食品安全等隐患[3],故利用不同酿酒酵母混合发酵改善葡萄酒品质也成为当前研究的热点。混菌发酵能够降低乙酸的产量,改变发酵产物的风味特征,增加酒体的复杂度,使葡萄酒风味更佳丰富、浓郁[4-6]。HOWELL等[7]发现EC1118和F15混合发酵的葡萄酒香气成分中的酯类、醇类和酸类等物质的含量均有所增加,从而增强酒体的果香和花香。SABERI等[8]表明酿酒酵母混合发酵的霞多丽葡萄酒具有浓郁的甜果、草莓、青苹果、梨和香蕉香气,比其单独发酵的品酒香气更为独特和复杂。于亚敏等[9]发现酿酒酵母混合发酵的成品酒香气轮廓与其单独发酵后混合调配的葡萄酒香气轮廓有所不同。然而,前人对酿酒酵母混合发酵的研究主要集中于对酒体香气物质的影响,但对其发酵特性、酒体颜色、抗氧化特性等方面报道甚少。
F33和F9是目前市场上常用的两款商用酿酒酵母,具有各自的生长代谢特征,且其香气特征也有所不同,本研究以酿酒酵母F33和F9单独发酵为对照,通过添加不同比例的F33和F9混合发酵酿制赤霞珠干红葡萄酒,揭示酿酒酵母F33与F9共发酵对干红葡萄酒发酵特性、理化指标、颜色、抗氧化特性和香气组分的影响,旨在为酿酒酵母混合发酵的研发和利用提供理论基础。
1 材料与方法
1.1 材料与试剂
葡萄原料:宁夏优良红色酿酒葡萄品种赤霞珠,2017年10月采自宁夏银川青铜峡产区,原料糖度为225 g/kg(以葡萄糖计),酸度为4.69 g/kg(以酒石酸计)。
商业酿酒酵母F33,法国LAFFORT公司;FC9,上海杰兔工贸有限公司。
无水葡萄糖、CuSO4·5 H2O、酒石酸钾钠、NaOH、次甲基兰、酚酞指示剂、浓HaOH、福林-酚、没食子酸、Na2CO3、无水乙醇、DPPH、ABTS、过硫酸钾、Trolox和白砂糖为分析纯,亚硫酸溶液(含6%SO2)为食品级,天津市大茂化学试剂厂;果胶酶(酶活4 400 U/g),法国LAFFORT公司;NaCl、乙醛、乙醇(色谱纯),国药集团化学试剂有限公司。
1.2 仪器与设备
UV-2600紫外可见分光光度计,日本岛津公司;CSS810分光测色计,上海精密仪器仪表有限公司;Agilent GC-6890-5975气相色谱仪,美国Agilent公司产品;Agilent 5975质谱仪,美国Agilent公司产品;自动顶空固相微萃取装置,德国 Gerstel 公司;50/30 μm DVB/CAR/PDMS萃取头,美国Supelco公司产品;DF-Ⅱ集热式恒温磁力搅拌器,金坛市恒丰仪器制造有限公司。
1.3 试验设计
本试验共设计5个处理,分别为F33单一发酵 (T1)、F9单一发酵(T2)、F33∶F9=1∶1(T3)混合发酵、F33∶F9=1∶2(T4)混合发酵、F33∶F9=2∶1(T5)混合发酵,每处理重复3次。
干红葡萄酒酿造:酿酒葡萄原料经除梗破碎后加入50 mg/L SO2和20 mg/L 果胶酶,室温浸渍24 h,随后根据试验设计分别接入相对应活化后的酿酒酵母200 mg/L进行酒精发酵,发酵控温20~25℃,发酵13~14 d,酒精发酵结束后皮渣浸渍 12 h,随后分离得到发酵原酒,苹果酸-乳酸发酵采用控温启动自然发酵的方式;苹果酸-乳酸发酵结束后调 SO2含量50 mg/L,满罐贮存。发酵设备为实验室20 L不锈钢发酵罐,每个处理发酵3罐。
取样时间:葡萄浆接入酵母菌后,每天取适量的发酵液用于测定酒醪总糖、可滴定酸和pH值,直至酒精发酵结束;随后取适量的原酒测定酒体可滴定酸、pH值、还原糖、酒精度、挥发酸、总酚、DPPH自由基清除能力和ABTS自由基清除能力及其香气物质。2018年9月进行葡萄酒CIELAB参数、色度、色调和花色苷测定。
1.4 测定指标与方法
1.4.1 葡萄酒基本理化指标
总糖和还原糖(以葡萄糖计)采用直接滴定法;可滴定酸(以酒石酸计)和挥发酸(以醋酸计)采用指示剂法;pH值采用酸度计法测定;酒精度采用密度瓶法。以上检测方法均参照国标GB/T 1503—2006《葡萄酒、果酒通用分析方法》[10]中的方法进行。
1.4.2 葡萄酒抗氧化特性
总酚(以没食子酸计)采用福林-肖卡法,参考ARNOUS[11]方法,其回归方程为y=0.001 1x+0.005 9,R2=0.999 7);DPPH自由基清除能力(以Trolox当量抗氧化能力表示)采用DPPH(1,1-二苯基-2-三硝基苯)法,参照BRAND-WILLIAMS等[12]方法;ABTS自由基清除能力(以Trolox当量抗氧化能力表示)采用ABTS(2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐)方法,参照李勇方法,其回归方程为y=-0.000 6x+0.638 2,R2=0.998 4)。
1.4.3 葡萄酒酒体颜色的测定
参照张方方等[13]方法,取不同处理中酒样各50 mL,在温度4 ℃,转速80 000 r/min下离心15 min,离心结束后取酒样上清液5 mL,采用CR-400色差计(D65,观测角度10°)直接测定葡萄酒样品溶液的L*、a*、b*、C*以及H*值;同时,选1 cm的比色皿,用蒸馏水作为空白对照,分别测定葡萄酒在波长为420、520和620 nm下的吸光度A420、A520和A620,色度=5×(A420+A520+A620),色调=A420/A520。
取离心后不同处理酒样上清液各2 mL,添加20 μL 20%乙醛水溶液,混匀静置45 min,在波长520 nm下测得的吸光值为总花色苷(Aace);取2 mL酒样,添加160 μL 50 g/L SO2,在波长520 nm下测得吸光值为聚合花色苷(ASO2);酒样在波长为520 nm条件下的吸光值为Awine。单体花色苷=Awine-ASO2。
1.4.4 葡萄酒香气成分
香气成分的萃取:取8 mL待测酒样置于 20 mL 顶空瓶中,加入 2.4 g NaCl,经振荡使NaCl充分溶解。将固相萃取头插入样品瓶顶空部分,于45 ℃下萃取30 min。吸附饱和后的萃取头取出,随后插入气相色谱进样口,于250 ℃ 解析3 min,进行GC/MS检测分析。
气相色谱条件:色谱柱为CP-Wax(60 m×0.25 mm×0.25 μm,Agilent),载气为高纯度氦气(He),流速1.0 mL/min,不分流进样。采用程序升温:初始温度40 ℃保持2 min,以3 ℃/min升至85 ℃,保持2 min,以3 ℃/min升至120 ℃,保持3 min,以3 ℃/min升至200 ℃,最后以5 ℃/min升至230 ℃,保持10 min。
质谱条件:采用电子电离(electron ionization,EI)源,电子能量为70 eV,检测器温度250 ℃,离子源温度为230 ℃,扫描范围为30~400m/z。
定性分析:根据GC-MS质谱结果,与标准的质谱库NIST14进行检索分析,同时结合保留指数及气相色谱峰面积,对香气成分进行定性分析,利用面积归一化法计算各物质组分相对百分含量。
1.5 统计分析
运用SPSS 13.0对数据进行方差分析(analysis of variance,ANOVA),采用LSD法进行多重比较,并利用Excel 2013作图。采用灰色系统关联度理论,选取不同处理间具有差异显著性的理化指标进行灰色关联度分析,综合评价酿酒酵母混合发酵对赤霞珠干红葡萄酒理化特性的影响。
2 结果与分析
2.1 酿酒酵母混合发酵对葡萄酒发酵特性的影响
2.1.1 酿酒酵母混合发酵对发酵过程中葡萄酒总糖的影响
葡萄酒酿造过程中,糖为酿酒酵母生长提供其所需的能量及发酵生成酒精,则酒醪中总糖的变化趋势反映酿酒酵母发酵能力的强弱[14]。由图1可知,随着发酵时间的推进,不同处理发酵液总糖含量呈下降趋势,但前7 d下降速率较快,而随后下降速度缓慢并趋于平稳。发酵第1天,T4和T5处理总糖含量显著低于TI、T2和T3处理,则表明T4和T5处理中酒精发酵启动速度较快;但发酵第2天,T1和T2处理总糖含量明显低于其他处理,则表明单一发酵虽然启动酒精发酵的速度较慢,但其酒精发酵速率明显高于混合发酵。发酵结束后,混合发酵处理中总糖含量均低于单一发酵处理,则表明F33和F9混合发酵糖类物质较单一发酵更彻底。

图1 酿酒酵母混合发酵对发酵过程中葡萄酒总糖的影响
2.1.2 酿酒酵母混合发酵对发酵过程中葡萄酒可滴定酸的影响
葡萄酒中有机酸可以形成稳定的芳香物质,是衡量葡萄酒品质的一个重要指标[15]。由图2可知,随着发酵时间的推进,不同处理中酒醪可滴定酸含量呈先增后降趋势,其中第10天达到最高值11.53 g/L,随后逐渐下降至6.10~7.08 g/L。不同处理可滴定酸在整个发酵过程中均呈上下浮动趋势,无明显规律。发酵结束后,混合发酵处理可滴定酸含量均高于单一发酵处理,则表明F33和F9混合发酵较单一发酵有利于有机酸的形成。
2.1.3 酿酒酵母混合发酵对发酵过程中葡萄酒pH值的影响
pH是影响酶活性的一个重要因素,当外环境pH改变与胞内不一致时,被分泌到细胞外的胞外酶活性就会受到影响[16],从而影响酵母的新陈代谢;同时,合适的pH值对葡萄酒的稳定性和感官质量都起着非常重要的作用,是葡萄酒生产过程中生化反应的主体,且pH越低,越有利于一些氨基酸的吸收[19]。由图3可知,随着发酵时间的推进,不同处理中pH值呈先降后增趋势。T5处理的pH值在整个发酵过程中明显高于其他处理。整个发酵过程中,T1和T2处理中pH值在发酵前和发酵后分别降低2.09%和1.34%;T3、T4和T5处理中pH值在发酵前和发酵后分别降低0.53%、-0.81%和0.52%,则表明混合发酵过程中酒醪pH值变化较单一发酵过程中pH值变化幅度小。
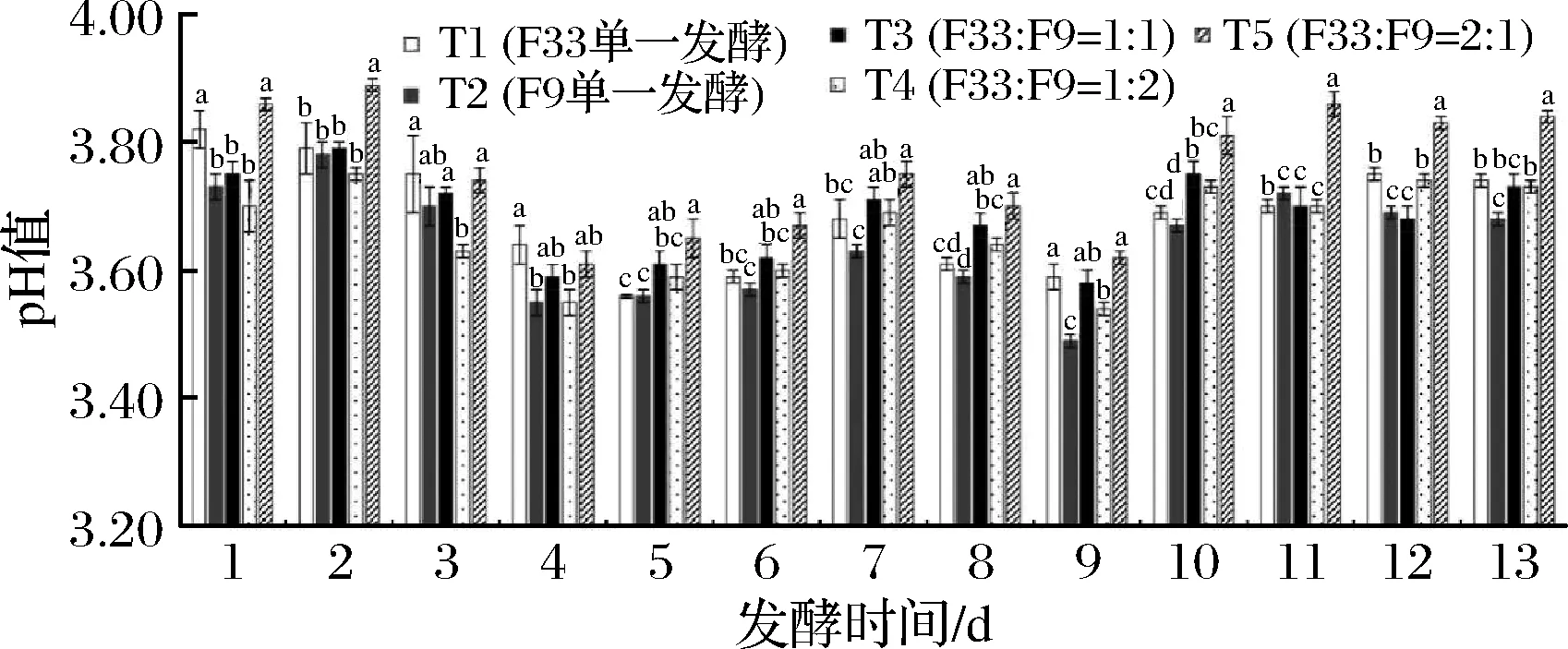
图3 酿酒酵母混合发酵对葡萄酒发酵过程中pH值的影响
2.2 酿酒酵母混合发酵对干红葡萄酒理化特性的影响
2.2.1 酿酒酵母混合发酵对酒体常规理化指标的影响
葡萄酒可滴定酸、pH值、还原糖、酒精度和挥发酸含量的高低是判断其质量是否达到标的基础指标。由表1可知,酿酒酵母混合发酵对干红葡萄酒可滴定酸、pH值、还原糖和酒精度含量有显著性影响,而对挥发酸含量无显著性影响。混合发酵处理中可滴定酸含量显著高于单一发酵,最高的为T3处理;pH值最低为T2处理,最高为T5处理,T1、T3和T4间无显著性差异,均在3.70左右。不同处理中还原糖含量均符合我国最新的葡萄酒标准GB/T 15037—2006[10]规定,并且混合发酵处理中还原糖含量均低于单一发酵,且T4处理中还原糖含量显著低于T1处理。5个处理中酒精度从高到低依次为:T3>T4>T1>T2>T5,其中T3处理的酒精度含量最高,表明F33和F9酵母按照1∶1的混合发酵对葡萄中糖的利用率最高;而T5处理的酒精度含量显著低于其他处理。

表1 酿酒酵母混合发酵对干红葡萄酒理化性质的影响
注:不同的小写字母表示显著差异(P<0.05)。下同。
2.2.2 酿酒酵母混合发酵对酒体颜色的影响
采用CIELAB 色空间能够描述葡萄酒颜色[17-19],其中a*值与红绿相关;b*值与黄蓝相关;L*值表示明暗程度,与葡萄酒的颜色深浅呈反比;C*值表示葡萄酒的饱和度,与葡萄酒颜色纯正呈正比;H*值表示葡萄酒的色调角[19],在红葡萄酒中的取值为0°~90°,其值越小代表酒体越倾向于新红葡萄酒的颜色特征,其值越大代表酒体越倾向于陈酿红葡萄酒的颜色特征[17]。
由表2可知,酿酒酵母混合发酵对葡萄酒a*值、C*值、色度和色调无显著性影响,但对b*、L*和H*有显著性影响。混合发酵处理中葡萄酒b*值和H*值均高于单一发酵处理,则表明酿酒酵母混合发酵的葡萄酒更易成熟。T5处理中b*和H*值显著高于其他处理;T1处理中b*值和H*值显著低于T2、T3和T4处理,其中b*值分别低35.6%、53.9%和64.7%,H*值分别低24.5%、54.4%、55.4%和120.1%;T2和T3 处理中b*值和H*值均无显著差异性,但T4与T2和T3处理中H*值存在显著性差异,其值从大到小依次为T2>T3> T4,而b*值无显著性差异。同时,葡萄酒CIELAB参数L*值均在30左右,其值从高到低依次为T4>T3>T2=T1>T5,但T1、T2和T3间无显著性差异性。此外,酿酒酵母混合发酵对葡萄酒总花色苷和单体花色苷无显著性影响,但对聚合花色苷有显著性影响(表2)。不同处理间相比较,T1处理的聚合花色苷含量显著低于其他处理,分别比T2、T3、T4和T5低12.31%、16.15%、8.46%和9.23%;T2、T3、T4和T5处理间聚合花色苷含量均无显著性差异。
2.2.3 酿酒酵母混合发酵对葡萄酒抗氧化特性的影响
葡萄酒中酚类物质具有抗氧化活性,可以清除自由基[20],但其抗氧化性受诸多因素影响,其中酵母菌在酒精发酵过程中对果实中酚类物质的浸提有一定的影响,且其能够促进花色苷的降解并参与某些与颜色损失相关的反应[21],从而影响葡萄酒总酚含量及其抗氧化特性。由图4可知,葡萄酒总酚含量、DPPH和ABTS自由基清除能力分别为2.10~2.40 g/L、72%~77 %和140~200 μmol/L。不同处理间相比较,T1处理中葡萄酒总酚含量显著高于T2、T3和T5处理,而略高于T4处理,分别比T2、T3、T4和T5处理高9.13%、9.13%、6.56%和10.40%。同时,T1处理中葡萄酒DPPH和ABTS自由基清除能力均显著高于其它处理,分别比T2处理高6.15%和47.21%;比T3处理高6.15%和15.73%;比T4处理高5.32%和14.88%;比T5处理高6.01%和23.63%。T2处理中葡萄酒ABTS自由基清除能力显著低于其他处理。
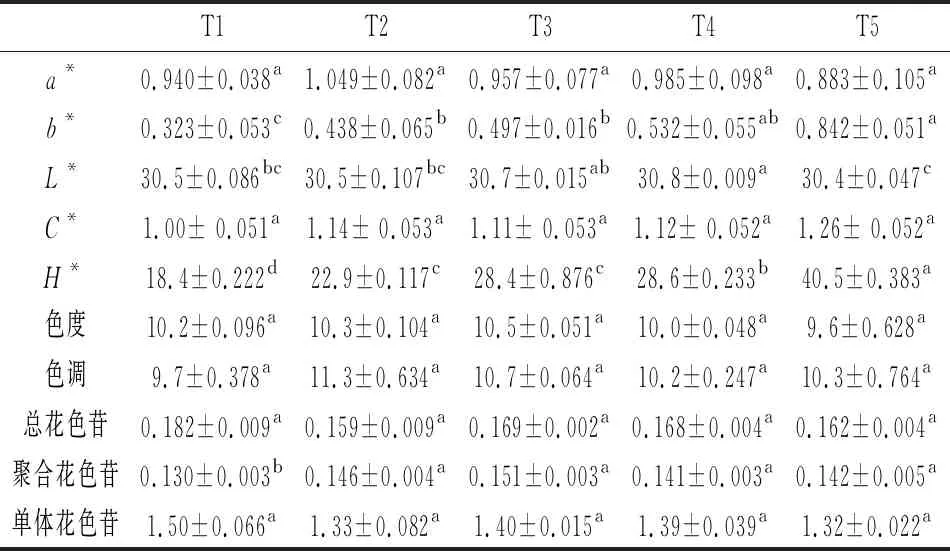
表2 酿酒酵母混合发酵对葡萄酒CIELAB参数、色度色调和花色苷的影响
注:L*,亮度值;a*,红绿色度值;b*,黄蓝色度值:C*,色译饱和度;H*,色调角。图中不同小写字母代表差异显著(P<0.05),下同。

A-总酚;B-DPPH自由基清除能力;C-ABTS自由基清除能力
2.2.4 葡萄酒酒体理化特性指标间相关性分析
表3反映不同处理干红葡萄酒理化特性指标间的相关性,结果显示干红葡萄酒理化特性指标间具有显著的相关性,其中总花色苷与单体花色苷和DPPH呈显著正相关,与色调和C*呈显著负相关;单体花色苷与DPPH呈显著正相关,与色调、b*和C*呈显著负相关;色度与pH值、b*和H*呈显著正相关;色调与a*和C*呈显著正相关,与DPPH呈显著负相关;还原糖与总酚和DPPH呈显著正相关,与可滴定酸、a*、b*、C*呈显著负相关;酒精度仅与b*呈显著负相关;可滴定酸与总酚和DPPH呈显著负相关;pH值与b*和H*呈显著正相关;总酚与DPPH呈显著正相关,与b*和H*呈显著负相关;DPPH与b*和C*呈显著负相关;a*与C*呈显著正相关;b*与C*和H*呈显著正相关。

表3 葡萄酒酒体理化特性指标间皮尔逊相关性分析
注:L*,亮度值;a*,红绿色度值;h*,黄绿色度值:C*,色译饱和度;H*,色调角;“*”和 “**”分别代表在0.05水平和0.01水平上显著。
2.2.5 酿酒酵母混合发酵对干红葡萄酒理化特性影响的综合评价
采用灰色系统关联度理论,选取不同处理间具有显著差异的理化指标进行灰色关联度分析,其包括聚合花色苷、还原糖、总糖、可滴定酸、pH值、总酚、ABTS、DPPH、L*、b*、H*11项指标。由表4可知,F33单一发酵(T1)的干红葡萄酒酒体理化特性的加权关联度高于其混合发酵的干红葡萄酒酒体理化特性的加权关联度,但F9单一发酵(T2)的干红葡萄酒酒体理化特性的加权关联度低于F33∶F9=1∶1(T3)和 F33∶F9=1∶2(T4)混合发酵。不同处理间酒体理化指标加权关联度排名依次为F33单一发酵(T1)>F33∶F9=1∶2混合发酵(T4)> F33∶F9=1∶1混合发酵(T3)>F9单一发酵(T2)> F33∶F9=2∶1混合发酵(T5)。
2.3 酿酒酵母混合发酵对葡萄酒香气组分的影响
葡萄酒香气是产品感官质量的重要方面,能够体现葡萄酒产品质量和风格特色,酿酒酵母可以代谢产生多种香气活性物质,并且细胞壁的甘露糖蛋白也可以修饰葡萄酒香气[22]。因此分析葡萄酒中的香气成分对于葡萄酒产品的质量评价和真伪鉴别意义重大[23]。通过气相色谱-质谱联用分析可知(表5), T1、T2、T3、T4和T5处理中分别检测出37、30、30、40和27种香气物质,其中酯类物质分别有17、14、13、17和12种;醇类物质分别有7、5、6、9和6种;酸类物质分别有7、6、4、7和5种;酮醛类物质分别有1、0、2、1和1种;烷烃类物质分别有3、3、3、4和2种;苯酚类物质分别有2、2、2、2和1种。
不同处理的酯类物质中,丁二酸二乙酯的相对含量最高,达到14.8%~19.0%,但均无显著性差异;而4种物质相对含量存在差异显著性,分别是乙酸乙酯、己酸乙酯、2,2,4-三甲基-1,3-戊二醇二异丁酸酯和丁二酸单乙酯,其中T2处理中乙酸乙酯相对含量最高;T5处理中己酸乙酯相对含量最高;T1处理中2,2,4-三甲基-1,3-戊二醇二异丁酸酯和丁二酸单乙酯相对含量均最高;T3混合发酵处理中乙酸乙酯、己酸乙酯和丁二酸单乙酯相对含量均最低;T5混合发酵处理中2,2,4-三甲基-1,3-戊二醇二异丁酸酯相对含量均最低。醇类物质中,正戊醇和苯乙醇的相对含量最高,分别达到19.5%~25.0%和17.8%~25.6%,但处理间无显著性差异;而不同处理间正己醇相对含量存在差异显著性,T1、T2和T5处理显著高于T3和T4处理。酸类物质中,辛酸相对含量最高,达到3.82%~7.30%,且不同处理间存在显著性差异,T5处理显著高于T3处理;同时,2,4-二羟基苯甲酸相对含量也存在显著性差异,T1处理显著高于T2和T4处理。烷烃类物质中,六甲基环三硅氧烷相对含量最高,但处理间均无显著性差异,而十四甲基环七硅氧烷相对含量存在显著性差异,其中T1处理显著高于T4处理。然而,不同处理间干红葡萄酒中酮醛类和苯酚类物质均无显著性差异。同时,不同酿酒酵母发酵所酿的干红葡萄酒均有其独特的香气物质(表5),其中F33单一发酵 (T1) 所酿的干红葡萄酒中独有的香气物质为丁酸丁酯、十五酸乙酯、γ-丁内酯和2,4-二甲基戊三酯琥珀酸;F9单一发酵(T2)所酿的干红葡萄酒中独有的香气物质为环十四烷;F33∶F9=1∶1(T3)混合发酵所酿的干红葡萄酒中独有的香气物质为十二醛二甲缩醛;F33∶F9=1∶2(T4)混合发酵所酿的干红葡萄酒中独有的香气物质为二甲氧基乙酸甲酯、丁二酸环丁基3乙酯、乙基异戊基琥珀酸酯、松油醇、3-甲硫基丙醇和戊基环丙烷;F33∶F9=2∶1(T5)混合发酵所酿的干红葡萄酒中独有的香气物质为3-羟基-十三烷酸甲酯。
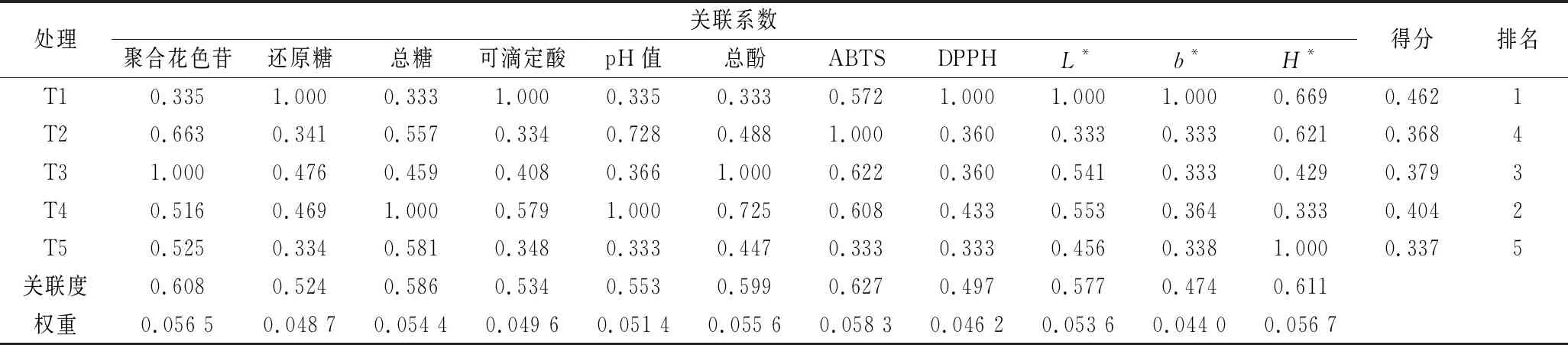
表4 不同酿酒酵母发酵下干红葡萄酒酒体理化特性的关联度及排名
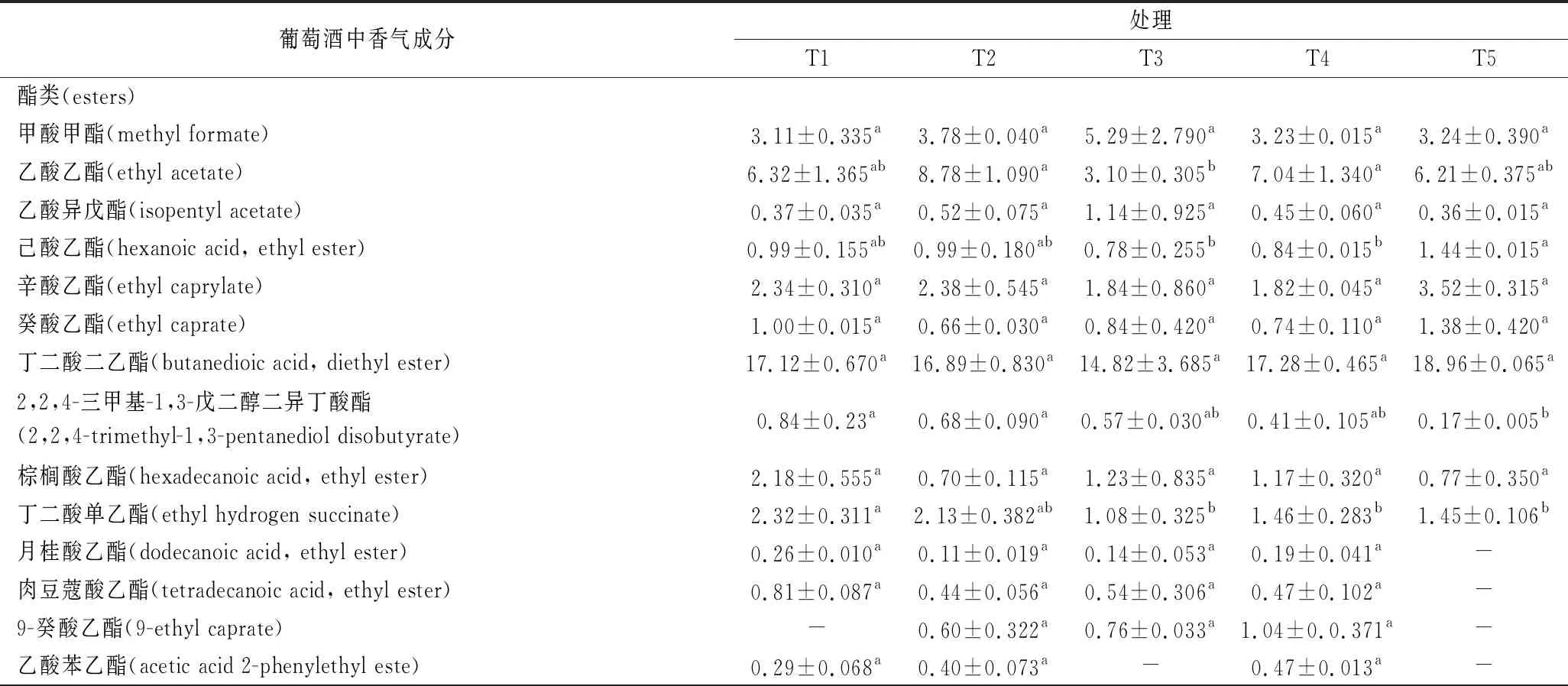
表5 酿酒酵母混合发酵对赤霞珠干红葡萄酒香气组分的影响 单位:%
续表5

葡萄酒中香气成分处理T1T2T3T4T52-丁基琥珀酸二乙酯(2-butyryl-succinic acid diethyl ester)0.24±0.015a---0.24±0.001a二甲氧基乙酸甲酯(methyl 2,2-dimethoxyacetate)---0.21±0.007-丁二酸环丁基3乙酯(cyclobutyl butyrate)---0.11±0.002-乙基异戊基琥珀酸酯(ethyl isopentyl succinate)---0.20±0.004-丁酸丁酯(butyl butyrate)0.16±0.010----十五酸乙酯(1-pentadecanol acetate)0.18±0.005----3-羟基-十三烷酸甲酯(ethyl 3-hydroxyhexadecanoate)----010±0.005γ-丁内酯(gamma-Butyrolactone)0.18±0.005----醇类Alcohols正戊醇(1-pentanol)22.51±1.685a23.09±0.720a19.51±3.860a22.5±0.320a24.96±1.480a正己醇(1-hexanol)1.36±0.230a1.30±0.235a0.09±0.020b0.13±0.005b1.72±0.090a苄醇(benzyl alcohol)0.24±0.025a0.23±0.010a0.16±0.005a0.18±0.030a0.22±0.030a苯乙醇(phenylethyl alcohol)20.12±1.280a21.58±4.195a21.77±4.145a25.62±1.510a17.77±0.405a橙花叔醇(1,6,10-dodecatrien-3-ol, 3,7,11-trimethyl-)0.17±0.005a0.13±0.003a0.11±0.015a0.13±0.030a0.15±0.060a月桂醛缩二甲醇(lauraldehyde dimethyl alcohol)0.29±0.030a---0.31±0.005a3-甲基-1-戊醇(3-methyl-1-Pentanol)--1.13±0.265a1.29±0.035a-1-癸醇(1-decanol)0.14±0.015a--0.11±0.010a-松油醇(terpineol)---0.10±0.010-3-甲硫基丙醇(3-(methylthio)-1-propanol)---0.18±0.015-酸类(acids)己酸(hexanoic acid)0.90±0.140a0.76±0.110a0.85±0.145a1.03±0.003a1.26±0.245a乙基3-甲基丁基酯丁二酸(ethyl 3-methylbutyl ester-butanedioic acid)2.28±0.015a2.33±0.130a1.92±0.450a2.19±0.005a2.04±0.621a辛酸(octanoic acid)5.02±0.025ab5.34±0.930ab3.82±0.770b4.89±0.255ab7.30±0.32a2-甲基丁酸(2-methyl butyric acid)-0.47±0.062a0.38±0.047a0.79±0.439a0.51±0.056a癸酸(n-decanoic acid)1.43±0.091a1.14±0.266a-0.97±0.162a1.30±0.190a2,4-二羟基苯甲酸(2,4-dihydroxybenzoic acid)0.71±0.438a0.19±0.006b-0.19±0.127b-9-癸烯酸(9-decenoic acid)0.18±0.007a--0.19±0.021a-2,4-二甲基戊三酯琥珀酸0.14±0.005----酮醛类(carbonyls)十二醛二甲缩醛(1,1-dimethoxydodecane)--0.145±0.045--大马酮(2-buten-1-one, 1-(2,6,6-trimethyl-1,3-cyclohexadien-1-yl)-, (E)-)0.15±0.030a---0.150±0.036a1-苯基-3-己酮(1-phenyl-3-Hexanone)--0.120±0.033a0.145±0.035a-烷烃类(alkane)六甲基环三硅氧烷(cyclotrisiloxane, hexamethyl-)0.69±0.0652a0.67±0.143a0.54±0.047a0.59±0.024a0.72±0.014a十四甲基环七硅氧烷(cycloheptasiloxane, tetradecamethyl-)0.31±0.129a0.15±0.035ab0.09±0.008ab0.04±0.004b0.11±0.012ab戊基环丙烷(pentylcyclopropane)---0.10±0.005-环癸烷(cyc3lodecane)0.27±0.025a-0.17±0.013a0.17±0.022a-环十四烷(cyclotetradecane)-0.15±0.028---苯酚类(phenols)2,6-二叔丁基-4-甲基苯酚(butylated hydroxytoluene)0.19±0.015a0.18±0.025a0.12±0.002a0.12±0.010a-2,4-二叔丁基苯酚(2,4-di-tert-butylphenol)0.85±0.120a0.50±0.085a0.63±0.007a0.48±0.226a0.47±0.148a
3 结论
本研究以酿酒酵母F33和F9单独发酵为对照,添加不同比例的酿酒酵母F33和F9混合发酵得到赤霞珠干红葡萄酒的还原糖、可滴定酸、挥发酸以及酒精度含量均符合国家标准GB/T 15037—2006。酒精发酵过程中,混菌启动发酵的速率比单一菌种快,且还原糖含量低,可滴定酸含量高,发酵更彻底。综合考虑葡萄酒理化指标和香气组分,当菌株F33与F9的混合比例为1∶2时,葡萄酒中还原糖和挥发酸均有所降低,酒精度有所提高,且葡萄酒抗氧化特性较F9单独发酵显著提高,更为重要的是其酒体中酯类、醇类和酸类等香气物质的相对含量均有所增加,且独有的香气物质达到6种;然而,经过一段时间陈酿后,酿酒酵母混合发酵的葡萄酒CLELAB参数H*均高于单独发酵的葡萄酒,表明酿酒酵母混合发酵的葡萄酒更易成熟。

