新疆喀什地区传统酸奶中乳酸菌的分离鉴定及产酸能力评价
杨行,王莉,郭丽君,张明,周玉贵,王玉涛*
1(喀什大学 生命与地理科学学院,新疆帕米尔高原生物资源与生态重点实验室,新疆 喀什, 844000)2(新疆玉昆仑天然食品工程有限公司,新疆 喀什, 844000)
乳酸菌(Lactic acid bacteria,LAB)是一类可将碳水化合物发酵成乳酸、革兰氏阳性、原核生物、兼性厌氧型或厌氧型的细菌。常见的乳酸菌分属为乳杆菌属、链球菌属、双歧杆菌属和片球菌属等,其中乳杆菌属和双歧杆菌属与人类健康关系密切[1-3],在人体内可以发挥多种生理生化功能,如调控胃肠道中正常菌群的数量,维持肠道中的微生态平衡,抑制肠道中有害菌的生长,达到改善胃肠道功能的目的,提高人体对营养物质的吸收利用率以及机体免疫力等[4-6]。乳酸菌在乳制品发酵过程中的主要作用是产酸(乳酸、乙酸、丙酸、柠檬酸和琥珀酸等)和产香(丁二酮、乙醛等),而产酸能力是乳酸菌的一个重要特性,用于生产发酵乳制品的发酵剂要求产酸能力强,可以缩短发酵时间,节约成本,提高生产效率[7-8]。因此筛选和保存高产酸能力的乳酸菌,将其利用于生产发酵,实现其更高的利用价值[9-10]。
喀什地区生态环境独特,既有荒漠戈壁、绿洲湿地,又有干旱山地、高原冰川,这些独特的生态环境孕育了丰富多样性的微生物资源;各民族聚居生活,传统的饮食习惯使得当地居民对酸奶制品情有独钟,常见有黄牛酸奶、牦牛酸奶、马奶酒、奶疙瘩、干酪等乳制品[11-12],其中保留了丰富的土著菌,因此挖掘该地区传统发酵乳制品中的菌落结构具有重要的意义。关于该地区乳酸菌的研究,仅杨洁等[13]从采集的22份酸奶样品,利用传统鉴定方法并结合16S rDNA 序列分析鉴定出56株乳酸菌,其中德氏乳杆菌46株、发酵乳杆菌2株、瑞士乳杆菌2株、嗜酸乳杆菌1株、鸡乳杆菌2株、屎肠球菌1株、耐久肠球菌2株,对喀什地区传统酸奶中乳酸菌的菌相结构进行了初步分析,但对这些乳酸菌的产酸能力未见报道。本研究从喀什地区10个县市采集了29份农牧民自制的传统发酵酸奶,利用平板划线分离法筛选出单一菌株,进而用16S rDNA进行菌种的分子鉴定,通过测定pH值和总酸度对菌株的产酸能力进行综合评价,筛选出产酸能力强的优良菌株,为开发和制作优质酸奶制品提供优良菌株,对丰富和挖掘传统菌剂具有重要的现实意义。
1 材料与方法
1.1 材料与试剂
样品采自喀什地区10个县市农牧民自制的传统发酵酸奶,奶源均为黄牛奶。其中喀什市样品5份、疏附县2份、疏勒县2份、英吉沙县2份、岳普湖县2份、阿克陶县2份、莎车县4份、麦盖提县3份、泽普县3份、叶城县4份,共计29份样品(乳酸菌编号以地区首字母+样品份数+菌落数记)。
细菌基因组DNA提取试剂盒,中科瑞泰(北京)生物科技有限公司;引物,购自苏州金唯智生物科技有限公司;MRS琼脂培养基、MRS肉汤培养基、MC琼脂培养基,购自奥博星生物技术有限责任公司;5%过氧化氢、卢戈氏碘液、结晶紫、番红、95%乙醇、酚酞、0.1mol/L NaOH等,均购自天津致远化学试剂有限公司。
1.2 仪器与设备
YP6002 金诺电子天平;立式压力蒸汽灭菌锅,LD2X-50KBSS 上海申安医疗器械厂;DHP-500型电热恒温培养箱,永光明;BCD-205HK电冰箱,容声;PHS-3C pH计,雷磁;SHA-C水浴恒温振荡箱,金怡;H-2050R高速冷冻离心机,德国sigma实验室离心机;Bio-Rad型琼脂糖凝胶电泳仪,北京市六一仪器厂。
1.3 试验方法
1.3.1 乳酸菌的分离纯化[14]
取3 mL酸奶样品接种于30 mL MRS肉汤培养基,37℃恒温培养24 h,重复此步骤,使其恢复活性。采用平板法,将充分活化后的样品进行稀释涂布于含有CaCO3的MRS琼脂培养基、MC琼脂培养基上,37 ℃厌氧条件下培养48~72 h。挑取有透明环的大小、形状、颜色不同的单个菌落,划线于平板培养基上,37 ℃厌氧条件下培养48 h,进一步纯化菌株。仔细观察培养基上的菌落是否为单一、相同的菌落,如有不同菌落,则继续划线纯化。待平板上生长的全部为单一菌落时,记录菌落大小、形态、颜色、分散情况等。
1.3.2 乳酸菌的初步鉴定及保存
按照《伯杰细菌鉴定手册》[15]《常见细菌系统鉴定手册》[16]中的乳酸菌的生化鉴定试验方法,将过氧化氢酶阴性和革兰氏染色阳性,经过镜检呈杆状的菌株暂定为乳杆菌,镜检呈球状、单个、成对或链状的暂定为乳球菌。将分离纯化后的,革兰氏染色阳性和过氧化氢酶阴性的菌株确定为疑似乳酸菌,并转接到MRS固体斜面试管中标号后,在4℃下保藏备用。
1.3.3 单菌株产酸能力的评价[14]
钾是农作物三大营养元素肥料之一,对保障农业生产、粮食安全具有举足轻重的作用。我国是一个缺钾国家,资源储量仅占世界约2%。我国探明的资源储量以盐湖钾矿为主,分布在青海柴达木盆地和新疆罗布泊地区。随着两大钾肥基地建成,特别近十年来,我国先后突破了低品位固体钾盐、尾矿利用、深部卤水开采等技术,使得钾盐可采量成倍增加。
将充分活化的菌液,按3%的接种量接入MRS液体培养基中,39 ℃恒温振荡培养24 h后检测酸度和pH值,每株菌做3组检测,结果取平均值。
pH值的检测:采用pH计直接测定读数。开启酸度计预热30 min后,用pH 6.86和pH 4.00的标准缓冲液进行校准。
酸度的检测:按照GB 5413.34—2010中的方法测定[17]。
1.3.4 乳酸菌DNA提取
乳酸菌DNA的提取按照试剂盒说明书的要求操作,试剂盒中已有溶菌酶,用于乳酸菌破壁,并延长孵育时间。
1.3.5 16S rDNA PCR扩增及电泳检测[18]
乳酸菌16S rDNA的PCR扩增引物选用细菌通用扩增引物:正向:27f(5′-AGAGTTTGATCCTGGCTCAG-3′),反向:1492r(5′-GGTTACCTTGTTACGACTT-3′)。PCR扩增体系见表1,扩增程序为:94 ℃预变性5 min;94 ℃变性1 min;58 ℃退火1 min;72 ℃延伸2 min;30个循环,在4 ℃下保存。

表1 16S rDNA PCR扩增反应体系(25μL)
PCR扩增结束后吸取3 μL的PCR扩增产物与2μL的10×DNA loading buffer充分混合,点样于1.0%的琼脂糖凝胶孔中进行电泳检测。电泳结束后,经凝胶成像系统观察其扩增产物情况,若菌株PCR扩增成功,则约在1 500 bp附近可以见清晰单一条带。扩增产物送苏州金唯智生物科技有限公司测序。
1.3.6 16S rDNA 序列系统发育分析
将测序结果采用DNAMAN软件双向拼接后,登陆NCBI网站(http://www.ncbi.nlm.nih.gov)DNA数据库,将拼接结果采用BLAST软件与已知序列进行相似性分析[19],利用Mega7软件采用邻接法(Neighbor-Joining) 构建系统发育树。
2 结果与分析
2.1 乳酸菌的分离及菌落特征
本实验共分离到59株乳酸菌,所有菌株经过氧化氢酶实验呈现阴性,经革兰氏染色后,油镜下镜检观察呈现紫色/蓝紫色,菌落多为球状、粗杆状、短杆状。从菌落形态观察结果(图1)来看,杆状菌菌落生长密集、多为圆形乳白色、边缘略透明、表面凸起,生长较为分散、少数有成片出现;球状菌菌落生长密集、多为白色、浅灰色,成片或链状生长。

a-MRS培养基乳酸菌涂布分离;b-MC培养基乳酸菌涂布分离;c-乳酸菌油镜镜检
2.2 单菌株产酸能力结果
2.2.1 pH值测定结果
MRS液体培养基的pH值为5.98,单菌株在MRS液体培养基中经过24h的培养,结果显示(表2),pH值最大为5.79, pH值最小为3.85;pH≤5.05的菌株有40株,约占总菌株数的67.8%,其中pH在4.26~4.45的菌株较多,有18株;其次是在4.46~4.65和5.46~5.65,各有10株。

表2 菌株pH值数量统计
2.2.2 总酸度测定结果
MRS液体培养基的总酸度值为50°T,单菌株在MRS液体培养基中经过24 h的培养,结果显示(表3),酸度值最大为183°T,酸度值最小为41°T,酸度值≥100°T的菌株有36株,约占总菌株数的61.02%,其中酸度在121~130°T之间的较多,有14株;其次是51~60°T之间,有10株。

表3 菌株总酸度值数量统计
2.2.3 不同地区乳酸菌pH值和总酸度结果分析
从11个县市中分离到得到的59株菌,pH≤5.05的数量为40株。其中阿克陶县样品最多,有7株,约占17.5%;其次是莎车县样品中有6株,约占15%;SL·1-1、SL·2-2-1两株菌pH值最低,为3.85,其次是SL·1-2和SC·3-1两株菌,pH值为3.88。总酸度≥100°T的数量为36株,阿克陶县样品中的最多,有6株,约占16.67%;其次是叶城县和莎车县,有5株,约占13.89%;SL·1-1的酸度最高,达到183°T,其次是SC·3-1和SC·2-3-4两株菌,酸度值163°T。不同地区乳酸菌pH值和总酸度结果分析如表4所示。
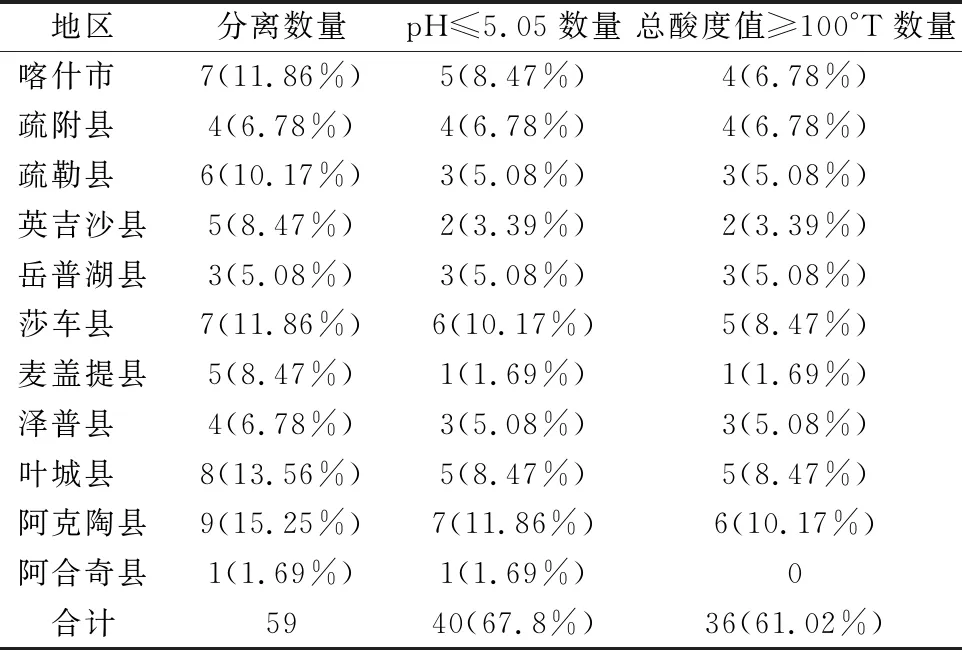
表4 不同地区乳酸菌pH值和总酸度结果
注:表中括号内为占总数的百分比。
2.3 16S rDNA PCR扩增及电泳检测结果
59株菌的16S rDNA扩增产物进行电泳检测,通过凝胶成像系统照相并观察,图2为其中13株菌的16S rDNA PCR扩增电泳检测结果。从图中可以看出所有菌株均有扩增产物,在1 500 bp附近均有清晰且单一的目的条带。

M-DL2000 markers;1-YC·3-1;2-SC·3-1;3-KS·3-1;4-SC·2-2;5-SF·1-2;6-YJS·1-3-1;7-MGT·3-1;8-YJS·1-1;9-MGT·3-5;10-YC·4-2;11-KS·1-2;12-MGT·1-3;13-YJS·1-11
2.4 16S rDNA 序列分析结果
59株样品送样测序,将测序结果进行编辑、比对分析,获得52条有效序列。将52株样品的测序结果在GeneBank中进行BLAST同源序列搜索,得出KS·3-1等10株菌为德氏乳杆菌(Lactobacillusdelbrueckii),占测序总数的19.23%;AKT·3-4等8株菌为发酵乳杆菌(Lactobacillusfermentum),占测序总数的15.38%;YC·1-5-2等4株菌为乳酸片球菌(Pediococcusacidilactici),占测序总数的7.69%;MGT·3-1等23株菌为屎肠球菌(Enterococcusfaecium),占测序总数的44.23%;ZP·3-2等7株菌为耐久肠球菌(Enterococcusdurans),占测序总数的13.46%。部分菌株构建系统发育树见图3。

图3 部分乳酸菌16S rDNA序列的系统发育树
2.5 菌种种类与产酸能力分析
pH值和总酸度值是乳酸菌产酸能力的重要衡量指标,pH值和总酸度指标经Origin分析,分析结果显示(图4,图5),大部分菌株的pH值主要集中在4.0~5.0,部分的屎肠球菌、耐久肠球菌的pH值较高;总酸度值大于130°T的主要德氏乳杆菌、乳酸片球菌,发酵乳杆菌主要集中在130~110°T,屎肠球菌主要集中在140~90°T,也有部分菌株总酸度较低。可以得出喀什地区传统发酵酸奶中产酸能力较强的主要是德氏乳杆菌、乳酸片球菌和发酵乳杆菌。

1-德氏乳杆菌;2-发酵乳杆菌;3-耐久肠球菌;4-屎肠球菌;5-乳酸片球菌(图5同)

图5 乳酸菌菌种种类与总酸度值关系图
3 讨论
WANG等认为菌株间的16S rDNA相似度大于97%,可能属于同一个种;相似度在99%以上,可能属于同一亚种[20]。但是建立在形态学、生理生化学基础上的传统细菌鉴定方法,对样品中乳酸菌的鉴定也较为重要,所以将生理生化实验和分子生物学方法结合起来,可以更快速、准确地实现微生物鉴定。
本研究通过传统分离方法对喀什地区农牧民自制的传统发酵酸奶乳酸菌进行分离筛选,对单株进行pH值和总酸度值的测定,菌株SL·1-1(Lactobacillusfermentum)在培养24 h后pH值最低为3.85,总酸度值最高为183°T,这与刘振民等[21]研究的乳酸菌产酸特性基本一致。林龙镇等[9]研究中发酵乳杆菌菌液的最终pH值在4.3左右,本实验中的发酵乳杆菌YPH·1-3-3最终pH值为4.1。蒋艾廷等[22]从塔城的传统酸奶中分离了30株产酸快的乳酸菌,经鉴定主要为乳杆菌属、肠球菌属和片球菌属,在本研究中都有分离得到,但其产酸能力最强的为植物乳杆菌。总体来看pH值在4.26~4.45的菌株较多,总酸度值在121~130°T的菌株较多,保加利亚乳杆菌、嗜热链球菌、植物乳杆菌及乳酸片球菌等不同乳酸菌的产酸能力也存在较大差异。
通过16S rDNA扩增序列比对鉴定,得到德氏乳杆菌(Lactobacillusdelbrueckii)10株、发酵乳杆菌(Lactobacillusfermentum)8株、乳酸片球菌(Pediococcusacidilactici)4株、屎肠球菌(Enterococcusfaecium)23株、耐久肠球菌(Enterococcusdurans)7株。与袁雪林等[23]、杨洁等[13]研究的喀什地区传统发酵酸奶中的乳酸菌多样性基本一致,但他们都得出德氏乳杆菌为优势菌群,本实验发现屎肠球菌为优势菌群,并且没有分离出瑞士乳杆菌、嗜酸乳杆菌、鸡乳杆菌。屎肠球菌属肠球菌属,是人和动物肠道内正常菌群的一部分,尚天翠等[24]从新疆伊犁的传统乳制品中也分离出了屎肠球菌。AZAT等[25]从新疆传统发酵干酪中分离得到6株乳酸菌,其中鼠李糖乳杆菌R4有较高的实用潜力,本实验中未有分离得到。可见,不同地区、不同时间、不同采样地点的传统发酵酸奶中乳酸菌的种类存在较大差异,这可能与当地的环境、气候、奶源、制作方法、发酵剂、发酵温度和发酵时间等因素有关。
4 结论
从喀什地区农牧民自制的传统发酵酸奶中分离筛选的乳酸菌,通过分子鉴定出屎肠球菌23株,发酵乳杆菌8株,耐久肠球菌7株,德氏乳杆菌10株,乳酸片球菌4株,其中屎肠球菌为优势菌群。
通过pH值及总酸度值的检测,pH≤5.05的菌株有40株,约占分离数的67.8%,主要集中在4.26~4.45;总酸度值≥100°T的菌株有36株,约占分离数的61.02%,主要集中在110~130°T;产酸能力较强的主要是德氏乳杆菌、乳酸片球菌和发酵乳杆菌,其中菌株SL·1-1在培养24 h后pH值最低为3.85,总酸度值最高为183° T,可以作为优良菌株保存使用。
——酸度

