超巴氏杀菌对牛乳酪蛋白微观结构及凝聚性质的影响
张安琪,王玉莹,李 瑞,周国卫,王 琳,王喜波*
(东北农业大学食品学院,黑龙江 哈尔滨 150030)
牛乳因含有许多人体生命活动所必需的营养成分而被广泛应用于食品加工领域中[1-2]。热处理虽然使乳中蛋白结构发生变化,但能抑制乳中微生物的生长。其中酪蛋白为全价蛋白质,约占牛乳总蛋白的80%[3],所以热处理后酪蛋白结构的变化对牛乳的热稳定性极为重要。目前常用的巴氏杀菌方法有两种:低温长时巴氏杀菌(如65 ℃、30 min)和高温短时巴氏杀菌(如72 ℃、15 s)[4]。国内外对经巴氏杀菌处理的牛乳的结构及性质研究较多,如孙佳悦等[5]曾用红外光谱法探究巴氏杀菌处理对乳蛋白二级结构的影响;王喜波等[6]研究了巴氏杀菌处理对牛乳中乳清蛋白的影响;Donato等[7]研究了热处理后牛乳中乳清蛋白与酪蛋白结合物的性质;Considine等[8]研究了热处理后乳蛋白结构的变化。
超巴氏杀菌(120~125 ℃处理数秒)是近年来出现的一种热处理方法[9]。国内外学者对超巴氏杀菌处理牛乳的风味和感官评价进行了研究[10-11],而对超巴氏杀菌处理后酪蛋白的结构变化鲜有研究。所以,本实验以牛乳为原料,通过纳米粒度分析仪、扫描电子显微镜及透射电子显微镜分别对3 种巴氏杀菌处理酪蛋白的微观结构和凝聚性质进行研究,探究超巴氏杀菌对酪蛋白结构的影响,为生产营养价值高并且保质期长的乳制品提供理论参考。
1 材料与方法
1.1 材料与试剂
牛乳 哈尔滨本地奶站;IPG缓冲液pH3-10美国通用公司;乙醇 天津市博迪化工有限公司;其他化学试剂均为分析纯。
1.2 仪器与设备
Mastersizer 2000激光粒度仪 英国马尔文仪器公司;S-3400扫描电子显微镜、JEM-1200EX透射电子显微镜日本日立公司;PE Pyris 6差示扫描量热(differential scanning calorimetry,DSC)仪 美国PerkinElmer公司;ALPHA-1-4-LSC冷冻干燥机 德国Christ公司。
1.3 方法
1.3.1 脱脂乳的制备及热处理
将新鲜牛乳在4 ℃条件下4 000 r/min离心30 min,取出后弃去上层脂肪即得到脱脂乳。对照组为未经过热处理的脱脂乳,将脱脂乳进行3 种巴氏杀菌处理,即65 ℃ 30 min、72 ℃ 15 s、121 ℃ 5 s(超巴氏杀菌),前两种热处理方法使用水浴锅处理,当牛乳的中心温度达到实验所需温度后开始计时,超巴氏杀菌方法使用高压锅加热,加热结束后将脱脂乳迅速于冷水中冷却至室温。将杀菌结束后的脱脂乳于4 ℃避光保存。
1.3.2 酪蛋白的提取
采用等电点沉淀法[12]提取酪蛋白,用1 mol/L HCl溶液将脱脂乳的pH值调至4.6,然后在4 ℃、12 000 r/min离心15 min,下层沉淀即为酪蛋白,取7 g酪蛋白于烧杯中,加入去离子水搅拌至完全溶解,将pH值调至8.0后定容到200 mL,于-20 ℃保存。
1.3.3 粒径的测定
粒径采用Mastersizer 2000型激光粒度仪进行测定[13]。取40 mL酪蛋白溶液,加入到500 mL去离子水中,待搅拌装置搅拌均匀后开始测定。泵的速率为1 800 r/min,颗粒折射率为1.460,分散剂折射率为1.330,颗粒吸收率为0.1。
1.3.4 透射电子显微镜测定酪蛋白内部结构
采用JEM-1200EX型透射电子显微镜测定热处理后酪蛋白溶液的内部微观结构。用去离子水将酪蛋白样品稀释10 倍,剧烈振荡15 min,取200 µL稀释后的酪蛋白溶液于透射电子显微镜专用铜网上,保持15 min,然后采用体积分数3%的铀染液漂浮负染色90 s,最后在无菌恒温条件下干燥20 min,然后在80 kV电压下进行观察[14]。
1.3.5 扫描电子显微镜观察酪蛋白表面结构
参照Phadungath[15]和Dalgleish[16]等的方法,采用扫描电子显微镜测定酪蛋白表面结构,并依据样品处理的需要进行调整,将不同热处理的酪蛋白溶液用冻干机冻成粉末,在扫描之前必须经过固定、脱水、导电3 个过程的前处理。固定液通常为含有戊二醛的磷酸盐缓冲液,选用乙醇梯度脱水法进行脱水处理,用离子喷射器在酪蛋白粉表面喷厚度15 nm的金箔,加速电压为5 kV。
1.3.6 DSC曲线的测定
将酪蛋白溶液置于铝盒中,密封后在样品箱中存放,于室温下平衡8 h,空铝盒为空白对照,从20 ℃加热到110 ℃,升温速率为10 ℃/min,得到DSC曲线[17]。
1.4 数据处理与分析
2 结果与分析
2.1 热处理对酪蛋白粒径分布的影响
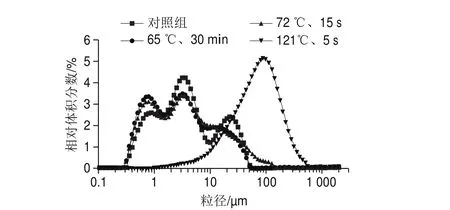
图 1 不同热处理条件下酪蛋白粒径分布Fig. 1 Particle size distribution of casein under different heat treatment conditions
如图1所示,对照组、65 ℃ 30 min和72 ℃ 15 s处理后酪蛋白胶束的粒径分布区间主要为1~100 μm,两种常用巴氏杀菌处理后,其粒径无明显变化,因为酪蛋白在70 ℃以下较稳定。121 ℃ 5 s处理后酪蛋白胶束的粒径区间向右移动,粒径明显增加,可能是因为自身发生离解和凝聚,使得粒径增大[18],也可能是在超巴氏杀菌处理时乳清蛋白变性黏附在酪蛋白表面使粒径增加[19]。
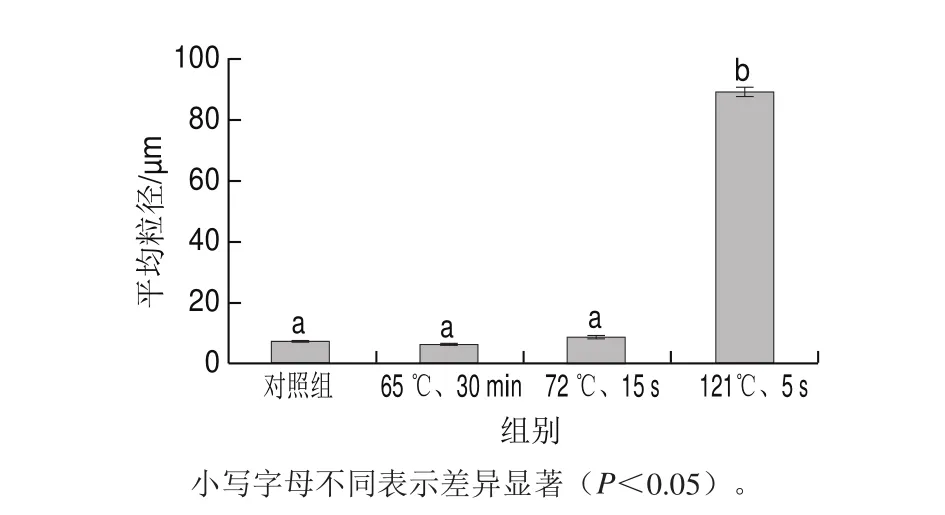
图 2 不同热处理条件下酪蛋白平均粒径Fig. 2 Average particle sizes of casein under different heat treatment conditions
由于酪蛋白胶束的粒径分布区间广泛,而热处理后变化区间范围也较大,所以借助平均粒径来说明不同热处理方式对酪蛋白胶束粒子大小变化的影响。不同热处理条件下酪蛋白的平均粒径如图2所示,对照组酪蛋白平均粒径为7.27 μm,与对照组相比,65 ℃ 30 min处理的样品平均粒径(6.19 μm)略有减小,但差异不显著(P>0.05),这是因为酪蛋白胶束表面的κ-酪蛋白单体发生解离[20];72 ℃ 15 s处理的样品平均粒径(8.91 μm)略有增加(P>0.05),是因为随着温度的升高,酪蛋白自身凝聚程度大于解离程度,所以粒径逐渐增加[20];而121 ℃ 5 s处理的样品平均粒径(88.98 μm)显著增加(P<0.05),是由于温度过高时,除了酪蛋白的自身凝聚,其疏水相互作用也会增强,酪蛋白由胶束态转变为聚集态[20]。Anema等[21]研究也表明,当热处理温度不大于70 ℃时,酪蛋白胶束的平均粒径小于未经过热处理的样品;当热处理温度大于70 ℃时,酪蛋白胶束的粒径随着热处理温度的提高而缓慢增加,但是增加得并不明显;只有热处理温度大于90 ℃时,酪蛋白胶束的粒径才会显著提高。由图2可看出,实验中未经过热处理的酪蛋白平均粒径为7.27 μm,比文献[22-23]中粒径(50~350 nm)小,可能是因为使用的粒度仪的型号不同,还可能是酪蛋白胶束的粒径与pH值有密切关系[24],提取酪蛋白时选用的pH值条件不同,所以粒径不同。
2.2 热处理对酪蛋白凝聚性质的影响


图 3 不同热处理条件下酪蛋白的透射电子显微镜图Fig. 3 Transmission electron microscopic images of casein under different heat treatment conditions
本实验中,酪蛋白溶液的pH值为8.0,常温透射电子显微镜放大10 000 倍,可以观察到纳米级的结构。未经过热处理的酪蛋白胶束的体积较小(图3A),是因为未经过热处理的牛乳提取酪蛋白后几乎不含乳清蛋白[25]。65 ℃ 30 min处理的样品结构更为松散(图3B),可能是酪蛋白表面的单体还在离解。72 ℃15 s处理后的样品,溶液中的酪蛋白相互缔结、叠加在一起,凝聚成圆形或椭圆形的胶束,形成一个巨大的网络(图3C)。121 ℃ 5 s处理的样品,圆形微粒展开,与其他展开的胶束融合、叠加在一起,形成更巨大的聚合物,并且内部结构更加紧密厚实(图3D),可能是酪蛋白胶束结构被破坏,也可能是因为加热温度的升高,促进乳清蛋白与酪蛋白的络合,从而引起粒子体积的增大[26],导致牛乳在贮藏过程中容易形成沉淀,降低其稳定性降低,缩短保质期。
2.3 热处理对酪蛋白微观结构的影响

图 4 不同热处理条件下酪蛋白的扫描电子显微镜图Fig. 4 Scanning electron microscopic images of casein under different heat treatment conditions
如图4所示,与对照组相比,65 ℃ 30 min处理的样品表现出更不规则、更无序的碎片结构,这可能是因为低温长时间的热处理会使酪蛋白胶束发生解离,并且随着加热时间的延长,解离程度会越来越大,部分酪蛋白的解离会使蛋白变得更加细碎,大小不一[27]。而72 ℃ 15 s处理的样品则更加均匀规则,这说明随着温度的升高,维持酪蛋白胶束的次级键受到破坏,使酪蛋白表面的结构发生变化,同时,酪蛋白胶束与胶束之间也进一步黏附,形成更大更均一的状态[28]。121 ℃ 5 s处理的样品,酪蛋白胶束的结构被破坏,形成较多小颗粒的酪蛋白,并出现更大程度的凝聚状态,这是因为随着加热温度的升高,乳蛋白与κ-酪蛋白之间的结合增强,从而形成更巨大的蛋白分子[29]。根据酪蛋白扫描电子显微镜图可知,所有组别中,65 ℃ 30 min处理的酪蛋白平均直径最小,而121 ℃ 5 s处理的酪蛋白平均直径最大,结果与粒径实验结果相一致。热处理后酪蛋白微观结构的改变意味着牛乳的理化性质发生改变,即会对牛乳的营养价值、风味及贮藏稳定性等产生一系列的影响。
2.4 热处理对酪蛋白热力学性质的影响
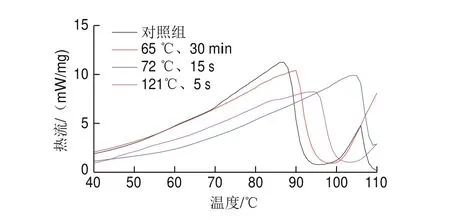
图 5 不同热处理条件下酪蛋白DSC图Fig. 5 DSC analysis of casein under different heat treatment conditions
由图5可知,被测蛋白质的变性温度越高,说明其蛋白结构越稳定;热焓(吸热峰面积)越大,说明样品蛋白质的变性程度越低[30]。4 个样品均表现为不同的变性温度和变性焓,可能是因为热处理对酪蛋白各个单体及酪蛋白与乳清蛋白结合物的影响不同,从而导致整个酪蛋白体系的热稳定性不同。
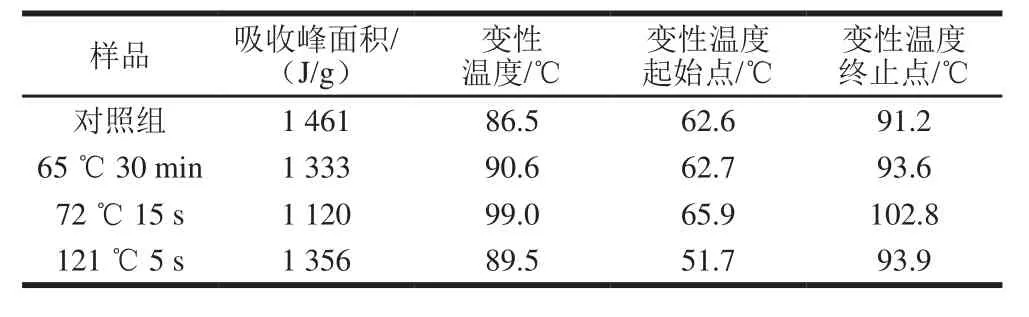
表 1 DSC图谱峰的综合分析Table 1 Comprehensive analysis of peaks in DSC spectra
由表1可以看出,与对照组相比,3 组巴氏杀菌处理的热变性温度均升高。其中,72 ℃ 15 s处理的酪蛋白变性温度最高,这可能是因为热处理使蛋白质不断解离,转变为更无序的状态,该状态对热较为稳定,当超巴氏杀菌处理时,由于加热温度的升高,酪蛋白胶束与解离的酪蛋白单体之间又凝聚在了一起[31]。热焓(ΔH)表示蛋白质的变性程度,65 ℃ 30 min处理的样品吸收峰面积比对照组小,说明热变性程度更高;该组变性温度(90.6 ℃)高于对照组和超巴氏杀菌组,说明稳定性更高。72 ℃ 15 s处理的样品与其他3 组相比热焓最低,表明72 ℃ 15 s处理的酪蛋白变性程度最大,变性温度(99 ℃)最高,说明稳定性最高,是因为70 ℃以上热处理时乳清蛋白会变性,从而与κ-酪蛋白形成复杂的配合物[32]。以上说明,巴氏杀菌(65 ℃ 30 min、72 ℃ 15 s)处理会提高酪蛋白的稳定性;而121 ℃ 5 s处理的酪蛋白变性程度比巴氏杀菌处理的低,可能是因为之前离解的酪蛋白胶束又凝聚交联在一起[33]。
3 结 论
本实验以新鲜牛乳为原料,探究超巴氏杀菌处理后酪蛋白微观结构及凝聚性质的变化,同时以未经过热处理及常用的两种巴氏杀菌处理后的酪蛋白样品进行比较,采用电子显微镜和热力学等方法对3 种巴氏杀菌法处理酪蛋白进行分析。结果表明,超巴氏杀菌方法处理的酪蛋白,其胶束结构发生变化,使其发生大面积的凝聚、交联,粒径明显增加。巴氏杀菌处理会增加牛乳酪蛋白的稳定性,但超巴氏杀菌处理牛乳会破坏部分酪蛋白胶束原有的形态,使其发生凝聚交联。超巴氏杀菌方法处理后的酪蛋白热稳定性高于对照组,酪蛋白变性程度低于两种常用的巴氏杀菌方法,且其热处理时间短,可以提高生产效率。同时,热处理后酪蛋白结构更为无序,其稳定性会提高,从而延长保质期。

