基于先进材料的适配体传感器在真菌毒素快速检测中的研究进展
王嫦嫦,马 良*,刘 微,郭 婷,谭红霞,张宇昊,3,周鸿媛,陈 露,李道亮
(1.西南大学食品科学学院,重庆 400715;2.武汉市农业科学院环境与安全研究所,湖北 武汉 430207;3.西南大学前沿交叉学科研究院生物学研究中心,重庆 400715)
真菌毒素是由产毒真菌在特定条件下产生的一类具有生物活性的次生代谢产物。按其产毒菌种可分为曲霉菌毒素、青霉菌毒素和镰刀菌毒素等几大类[1-3]。联合国粮食及农业组织2014年—2016年从近150 个国家收集的数据表明,全球有超过27.4%的农产品被真菌毒素污染[4]。目前,已知真菌毒素有400多种,对人畜危害较大的有曲霉菌属产生的黄曲霉毒素(aflatoxins,AF)和赭曲霉毒素A(ochratoxin,OTA),镰刀菌属产生的玉米赤霉烯酮(zearalenone,ZEN)、脱氧雪腐镰刀菌烯醇(deoxynivalenol,DON)、伏马毒素B1(fumonisin B1,FB1)和T-2毒素,青霉菌属产生的展青霉素(patulin,PAT)以及麦角碱等。
现阶段,真菌毒素定量检测技术主要采用色谱法[5-6]和免疫测定法[7-8]。色谱法可对真菌毒素进行精准定量,但要求专业人员操作,操作步骤繁琐且经济成本相对较高。免疫测定法检测灵敏度高,已广泛用于真菌毒素检测中,但特异性抗体的质量和较为苛刻的储存条件等一直是制约其应用的关键问题。近年来,新兴的化学抗体-适配体作为抗体识别的替代物,逐渐成为真菌毒素检测领域的研究热点。
适配体也叫核酸适配体、适体,是通过指数富集配体系统进化(systematic evolution of ligands by exponential enrichment,SELEX)技术体外人工筛选得到的单链寡核苷酸或肽(通常是DNA或RNA),长度一般为25~60 个碱基[9-11]。适配体具有高亲和力与特异性,更易化学合成、改造与标记等优点,目前常被用作分子识别元件。当配体物质存在时,其可以在芳香环堆叠、静电、范德华力和氢键等的作用下,自身折叠形成如假结、发卡、G-四分体、凸环等三维空间结构来识别和结合靶分子[12-14]。近年来,适配体技术在临床[15-16]、医疗[17]以及食品检测[18-20]等领域发展迅速。本文概括了近10 年来文献报道的主要真菌毒素适配体,并对基于先进材料的适配体传感器在真菌毒素快速检测中的应用进展以及现阶段存在的主要问题进行了综述。
1 常见真菌毒素的适配体
筛选具有高亲和力和高特异性的适配体是构建基于适配体的真菌毒素生物传感平台的关键。近年来,研究者们利用SELEX程序已经筛选到了许多真菌毒素的适配体。表1列举了近10 年来文献报道的AF、OTA、ZEN、DON、FB1、PAT、T-2毒素等真菌毒素的适配体序列。

表 1 真菌毒素的适配体Table 1 List of mycotoxin aptamers
1.1 AF的适配体
Pociecha等[38]于2011年筛选得到了AFB1的适配体(表1中AFB1的第一条适配体)。在随后几年,Ma Xiaoyuan等[22-23]将磁性纳米粒子分别作为AFB1和AFB2的载体,利用SELEX技术先后筛选了AFB1和AFB2的适配体(表1);其中,AFB1的适配体与AFB2、AFG1、AFG2、OTA和FB1之间的结合不超过15%,AFB2的适配体与AFB1、AFG1、AFG2、OTA和FB1之间的结合不超过18%,均表现出良好的特异性。Malhotra等[24]使用层压磁(magnetic beads,MBs)作为AFM1的载体,筛选得到包含两个重叠茎环这种独特结构的AFM1适配体AFAS3(表1),但其特异性测试结果表明适配体AFAS3与AFB1具有约25%交叉反应率。到目前为止,筛选到的AF适配体主要集中在AFB1、AFB2和AFM1上,其他类型的AF(G1、G2和M2)适配体鲜见报道,仍需开发新的筛选制备技术,提高AF适配体的筛选效率,同时对现有适配体研究进一步提高其特异性。
1.2 OTA的适配体
2008年Cruz-Aguado等[39]基于亲和柱的SELEX技术筛选到了OTA的适配体1.12,该序列中鸟嘌呤的含量高达47%,表明其很有可能折叠为G-四分体。随后,Barthelmebs等[27]筛选了OTA的适配体H12(表1),并证实了虽然H12与1.12具有两个共同的序列(GGGTGTGGG和AGGGAGT),存在典型的结构相似性,但筛选条件完全不同,适配体H12具有最高的灵敏度和特异性。近年来,McKeague等[29]筛选到了OTA的适配体A08和包括排除引物区的A08截短部分(A08min)(表1),并基于该适配体构建了荧光测定法,以快速、高灵敏地检测OTA(检出限为9 nmol/L)。对这些文献进行分析,现阶段已筛选出的OTA适配体序列均富含G且应用相对较成熟,这与靶标物OTA与富含G的序列结合会促进G-四分体的形成有关。
1.3 其他真菌毒素的适配体
Chen Xiujuan等[40]基于MBs的SELEX技术筛选出ZEN的适配体8Z31(表1中ZEN的第一条适配体)。Wang Yuankai等[31]将纯化的ZEN单克隆抗体包被在微量板上作为被单链DNA(single-stranded DNA,ssDNA)文库识别的靶标物,通过生物素-链霉亲和素间相互作用筛选出对ZEN具有高亲和力和特异性的适配体(表1),对AFB1、FB1和DON的交叉反应率均低于0.01%。此外,Eifler等[32]通过亲和柱的SELEX技术筛选到了DON的适配体C8(表1),但其并未将该适配体C8用于实际样品中DON的定量测定,仅仅只是利用电子鼻技术对DON污染的谷物进行区分(精度约为80%),故未来仍需进一步开发新的检测方法来提高适配体C8的利用率。
FB1适配体(FB139)是由McKeague等[41]利用MBs-SELEX技术筛选到的(表1中FB1的第一条适配体),该适配体FB139含有96 个碱基,序列较长。随后,Frost等[42]在McKeague等[41]的研究基础上,将适配体FB139截短,得到了相似亲和力的FB139的最小值序列(FB1_39t3和FB1_39t3-5)(表1)。Chen Xiujuan等[33]使用改进的SELEX技术筛选了FB1适配体F10,与FB139(Kd=(100f30)nmol/L)相比,适配体F10(Kd=(62f5)nmol/L)对目标物FB1具有更高的亲和力。目前除了FB1,其他FB的适配体还鲜见报道。因此,未来仍需进一步扩大其选择范围,并对已经筛选到的FB1适配体进行改造来提高其亲和力。
Wu Shijia等[34]使用氧化石墨烯-SELEX(graphene oxide-SELEX,GO-SELEX)法筛选到PAT的高亲和力适配体PAT-11(解离常数低至(21.83f5.02)nmol/L),这是利用以GO可通过π-π共轭吸附游离的ssDNA而不吸附与靶标物结合的DNA的特性为基础进行的筛选。Tomita等[35]建立DNA模块平台结合计算机中的二级结构预测,成功筛选了一种PAT的新型适配体(表1),并开发出相应微阵列-适配体传感器测定PAT。
Chen Xiujuan等[36]利用GO-SELEX法制备出特异性结合T-2毒素的高亲和力适配体Seq.16(表1),研究T-2毒素结合Seq.16形成的发夹结构的A型双链体,开发了相应的啤酒中T-2毒素的荧光定量检测技术。
Rouah-Martin等[37]将两种麦角碱(麦角胺和甲麦角林)固定在MBs上,从ssDNA文库中分离出与麦角碱结合的DNA,并用猝灭的MBs进行逆选择消除非特异性结合的适配体,最终筛选出具有两个共同C碱基序列的麦角碱适配体M3.2(表1),并证实该适配体M3.2存在两个结合位点,能够区分测试不同的麦角碱,但其特异识别作用局限于具有麦角灵环并且尺寸小于甲麦角林的分子。
目前OTA、AF适配体的筛选相对较成熟,基于已筛选的适配体已经构建了包括荧光测定法、比色法和电化学法在内的多种分析检测方法,以实现OTA、AF的高灵敏、高选择性测定。其他真菌毒素的适配体在应用范围、稳定性与亲和力等方面仍需加强研究。此外,用于不同种类、不同形态(结合态、衍生物等)真菌毒素共同检测的适配体序列研究较为欠缺。
2 基于先进材料的适配体传感器在真菌毒素快速检测中的应用
适配体传感器是以适配体作为分子识别元件,通过与靶标物的特异性作用,从而引起直接或间接的信号变化,最终实现对靶标物检测的一类传感器[43-44]。根据信号转换方式的不同,可将其分为:荧光适配体传感器、比色适配体传感器、表面等离子共振(surface plasmon resonance,SPR)适配体传感器、电化学适配体传感器和电化学发光(electrochemiluminescence,ECL)适配体传感器。金纳米粒子(Au nanoparticles,AuNPs)、石墨烯和石墨烯纳米复合物、量子点(quantum dots,QDs)以及磁性纳米粒子等先进材料具有优异的生物相容性、光学性能、机械性能和导电性能,应用于适配体传感器中可缩短样品准备和实验检测时间,极大地提高检测灵敏度,因此,被深入研究并广泛应用于真菌毒素的定量检测。
2.1 基于先进材料的荧光适配体传感器
荧光适配体传感器主要是测量适配体与靶标物作用所引起的荧光信号变化[45]。作为识别元件的适配体很容易被先进材料吸附,在真菌毒素检测领域研究和应用得越来越广泛。
Ma Liang等[46]报道了基于DNA酶I辅助目标循环信号放大策略的磁性还原氧化石墨烯(rGO-Fe3O4)的PAT荧光测定法。利用rGO-Fe3O4纳米材料对PAT适配体的吸附和保护作用,使DNA酶I只作用(切割)游离的适配体-PAT复合物,不断释放到体系中的PAT可以开始下一个靶标物循环过程,从而触发更多的适配体切割,这种DNA酶I辅助靶标物的再循环可显著提高PAT的荧光强度和检测灵敏度,其检测限可低至0.28 µg/L,比未使用该策略时的灵敏度提高约13 倍。且该传感器已成功用于苹果汁(加标回收率:77.34%~96.65%)和葡萄汁(加标回收率:97.14%~103.89%)中PAT的检测。
Sabet等[47]开发了用于AFB1检测的荧光适配体传感器。在该体系中,QDs和AuNPs分别作为供体和受体,通过适配体与AuNPs的静电作用,QDs-适配体被吸附在AuNPs的表面,导致荧光猝灭;引入AFB1后,QDs-适配体与AFB1结合并形成QDs-适配体-靶标复合物,从而远离AuNPs表面,QDs的荧光得以恢复。在最优条件下,该传感器的检出限为3.4 nmol/L,线性范围为10~400 nmol/L,对常见的干扰物AF(B2、G1、G2和M1)显示出良好的特异性,并已成功地应用于大米(加标回收率:103%~108%)和花生(加标回收率:104.5%~108.0%)样品中AFB1的分析。
Hu Shuisheng等[48]基于制备的新型纳米复合材料(Fe3O4/g-C3N4/HKUST-1)的荧光猝灭能力,开发了用于玉米中OTA测定的荧光适配体传感器。复合材料Fe3O4/g-C3N4/HKUST-1能够通过光电子传递机制猝灭染料的荧光,在加入靶OTA后,其可以高特异性地结合染料标记的适配体,导致适配体远离Fe3O4/g-C3N4/HKUST-1,体系的荧光恢复。该传感器的检出限为2.57 ng/mL(RSN为3),线性范围为5.0~160.0 ng/mL,且在玉米样品中OTA的加标回收率为96.5%~101.4%,相对标准偏差为4.5%~5.6%。
Zhang Jing等[49]报道了一种可同时检测OTA和AFB1的荧光适配体传感器(图1)。固定在MBs表面的OTA适配体(Ap1)和AFB1适配体(Ap2)分别与信号探针1(Sp1)和信号探针2(Sp2)杂交以形成Aps-Sps双链体结构。由于毒素靶标物-Aps的稳定性要高于Aps-Sps双链体结构,OTA和AFB1存在时,分别与相应的Aps结合形成G-四分体和AFB1-Aps复合物,并释放Sp1和Sp2,磁分离后,释放的Sps合成具有不同光致发光带的DNA支架-银纳米颗粒,利用Zn(II)使荧光强度显著增强。该传感器的荧光强度与OTA和AFB1的质量浓度(0.001~0.050 ng/mL)呈良好的线性关系,且OTA的检出限为0.2 pg/mL,AFB1的检出限为0.3 pg/mL,在小麦、大米和玉米样品中,OTA的加标回收率为(88.50f6.90)%~(113.50f5.30)%,AFB1的加标回收率为(88.10f5.70)%~(116.80f4.90)%。该方法的开发为同时检测更多类型的真菌毒素开辟了一条新途径。总地来说,基于先进材料的荧光适配体传感器作为一种新型的检测方法具有灵敏度高、耗时短等特点。
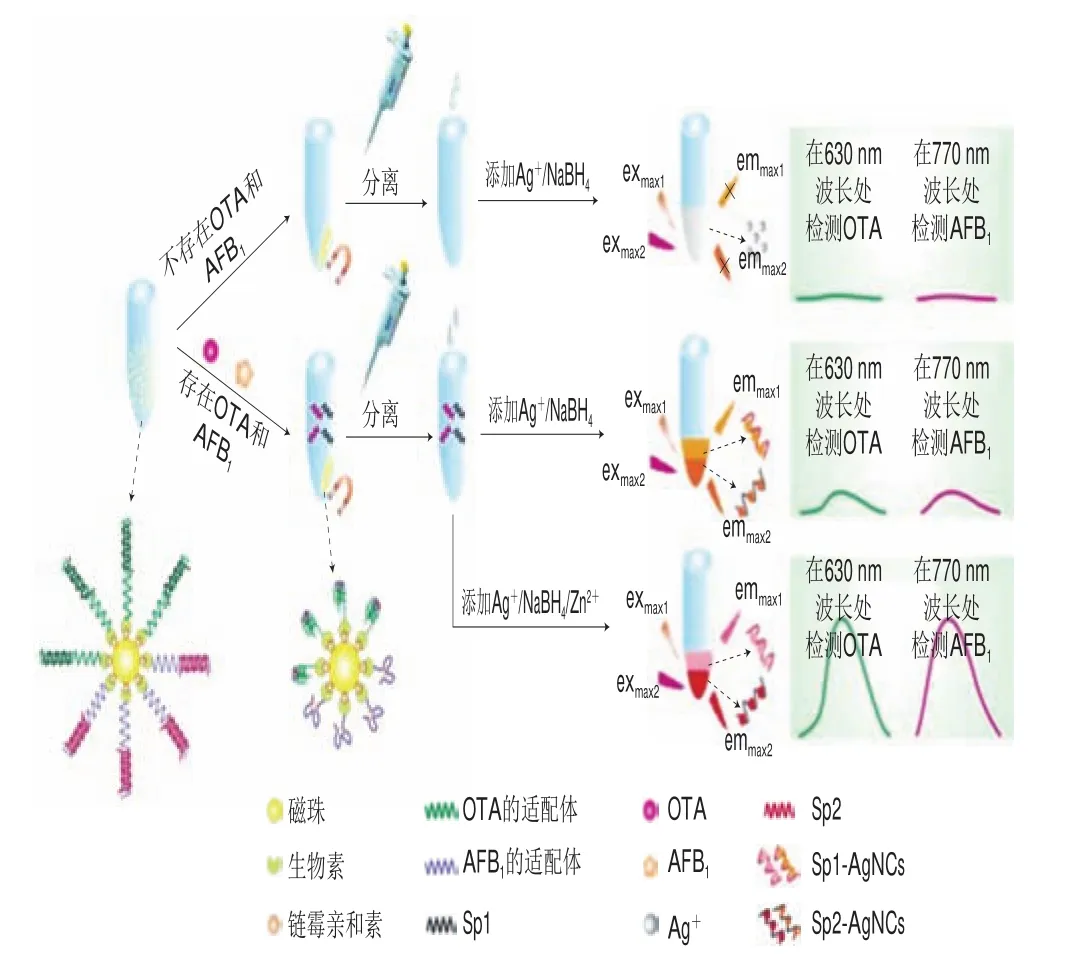
图 1 用于OTA和AFB1测定的荧光适配体传感器[49]Fig. 1 Fluorescence aptasensor for the determination of ochratoxin (OTA)and fumonisin B1 (AFB1)[49]
2.2 基于先进材料的比色适配体传感器
比色适配体传感器构建通常涉及纳米材料和用于信号放大的DNA酶[50]。Seok等[51]基于DNA酶-血红素/适配体复合物开发了AFB1诱导DNA酶结构变化的比色传感器。在该体系中(图2),两个裂解的DNA酶(α和β)与AFB1适配体的互补区域杂交形成G-四分体,并在血红素存在时,在H2O2的催化作用下氧化2,2’-联氮-双-3-乙基苯并噻唑啉-6-磺酸(2,2’-azino-bis(3-ethylbenzothiazoline-6-sulfonic acid),ABTS)产生有色阴离子自由基。当AFB1存在时,适配体特异性识别AFB1导致DNA酶-血红素/适配体复合物的解离,产生肉眼可见的颜色变化。该传感器的线性范围为0.1~1.0h104ng/mL,检测限为0.1 ng/mL,在玉米样品中AFB1的加标回收率为93.96%~104.95%且稳定性良好(相对标准偏差小于6%)。
Yang Cheng等[52]开发了以AuNPs为指示剂的OTA比色适配体传感器(图3)。不存在OTA时适配体被吸附到AuNPs的表面,可提高AuNPs对盐诱导聚集的稳定性。当体系中存在靶标物OTA时,OTA结合适配体,使适配体的构象从无规卷曲结构变为反平行G-四分体结构,并从AuNPs表面解离,失去对AuNPs的保护作用。而在体系中加入盐后,会导致AuNPs的聚集,故可通过肉眼监测溶液从红色到蓝色的颜色变化来实现OTA的定量检测。该比色适配体传感器的线性范围为20~625 nmol/L,检出限为20 nmol/L,且操作方便、快捷,整个操作过程只需5 min。比色适配体传感器可通过肉眼观测到的颜色变化来实现真菌毒素测定,尤其适合现场快速筛查,但灵敏度仍有待进一步提高。
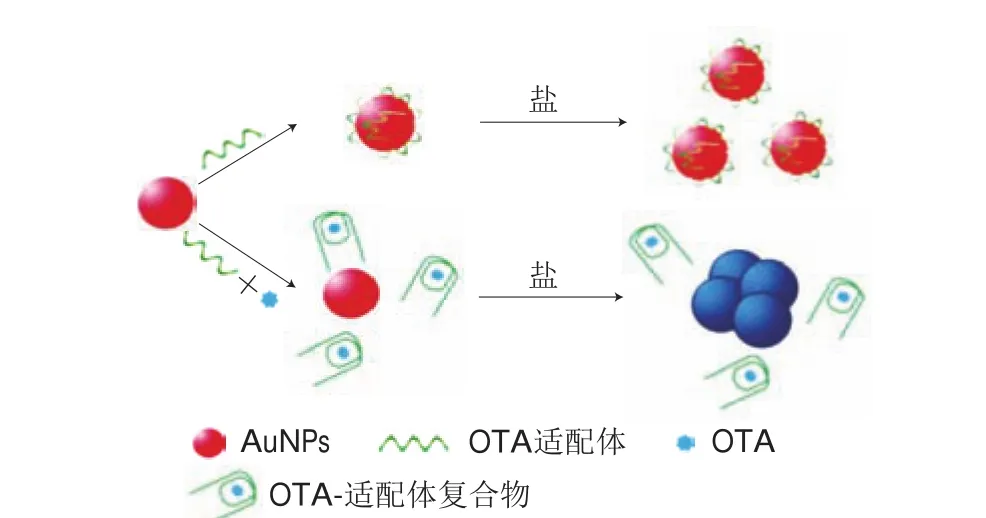
图 3 基于OTA适配体和未修饰的AuNPs的比色适配体传感器[52]Fig. 3 Schematic illustration of colorimetric aptasensor utilizing OTA aptamer and unmodified AuNPs[52]
2.3 基于先进材料的SPR适配体传感器
SPR适配体传感器通常是将具有特异性识别能力的分子即适配体固定于传感片表面,通过监测靶标物与传感片表面的适配体结合导致的折射率变化,来实现靶标物的快速和实时定量分析[53-54]。
Sun Linlin等[55]开发了一种新型的SPR适配体传感器定量分析AFB1。该体系中(图4),适配体作为亲和配体固定在SPR传感器芯片上。当AFB1时存在,AFB1与适配体结合,产生显著的SPR响应,SPR信号随着AFB1浓度增加而增强。在最佳条件下,该SPR适配体传感器的检出限低至0.4 nmol/L,并可用于复杂样品基质(在稀释100 倍的红葡萄酒和稀释50 倍的啤酒中AFB1的加标回收率为87%~102%)中AFB1的定量测定。该芯片具有良好的重复性和稳定性,4 ℃下储存80 d后,芯片仍可对AFB1作出良好响应。该方法简便快速、节省试剂,且具有高灵敏度,表现出良好的应用潜力。
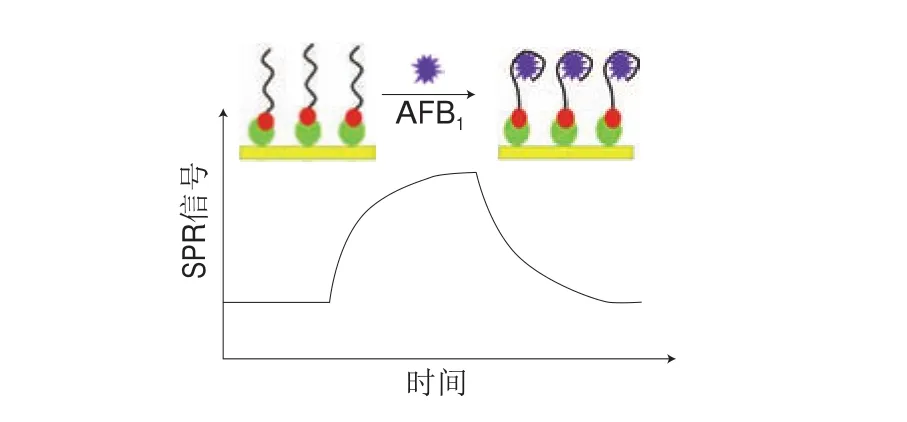
图 4 用于AFB1测定的SPR适配体传感器[55]Fig. 4 Surface plasmon resonance aptasensor for AFB1 determination[55]
Zhu Zhiling等[56]开发了用于OTA检测的SPR适配体传感器。将链霉亲和素固定在传感器芯片的表面上,通过链霉亲和素-生物素之间的强相互作用捕获生物素修饰的OTA适配体,在加入OTA后,OTA与适配体的特异性结合导致SPR信号的改变,通过直接测量最小反射强度的角度(与OTA质量浓度成正比)来实现OTA的定量测定。该传感平台的线性范围为0.094~10.000 ng/mL,检出限低至0.005 ng/mL,并已成功的用于葡萄酒(加标回收率:86.92%~116.54%)和花生油(加标回收率:87.76%~108.59%)中OTA的检测。该SPR适配体传感器无需标记,可实时进行高灵敏检测,实现了样品制备技术的简化。
2.4 基于先进材料的电化学适配体传感器
电化学适配体传感器是通过生物识别元件-适配体和目标分析物之间的生物化学反应来评估电参数(例如电流、阻抗、电导率、电压或电位信号)变化的传感平台[57]。设备简单、灵敏度高、易微型化,一直是分析工作者的重点研究对象[58-59]。近年来,结合先进材料的电化学适配体传感器由于可以克服原有传感器检测方法中选择性差、灵敏度低等缺陷而蓬勃发展。
Sun Aili等[60]利用GO-适配体和DNA酶I辅助OTA循环信号放大,开发出一种均相电化学检测法。硫堇标记的OTA适配体通过非共价作用附着在GO表面,形成的硫堇-适配体/GO纳米复合物悬浮在检测溶液中,产生较弱的电信号。当体系中存在靶标物OTA时,OTA与适配体反应形成硫堇-适配体/OTA复合物,电信号得以增强,DNA酶I可作用(切割)新形成的复合物并释放靶标物OTA,使其可以开始下一个靶标物循环过程,从而触发更多的适配体切割。该检测平台电化学响应良好,检出限低至5.6 pg/mL,检测小麦样品时的准确度与商业化的酶联免疫吸附测定(enzyme-linked immunosorbent assay,ELISA)试剂盒相当,能满足OTA的高灵敏测定。但是该方法耗时长(形成的硫堇-适配体/OTA复合物从GO的表面脱离需要90 min),限制了其应用。
Wang Chengquan等[26]将包被CdTe-QDs或PbS-QDs的二氧化硅分别标记OTA和FB1的特异性适配体,用Fe3O4@Au MBs固定相应适配体的互补DNA作为捕获探针,开发了可同时检测OTA和FB1的磁控电化学适配体传感器(图5)。OTA和FB1存在时,适配体优先与靶标物形成适配体-靶标复合物,使标记物远离MBs表面。经过一步培养和简单的磁分离后,通过峰电位的差异来测定与靶标物浓度呈负相关的标记物中所溶解Cd2+和Pb2+的信号。OTA的线性范围为10 pg/mL~10 ng/mL,检出限为5 pg/mL,FB1的线性范围为50 pg/mL~50 ng/mL,检出限为20 pg/mL。检测玉米样品时,OTA的加标回收率为85.0%~94.2%,FB1的加标回收率为92.0%~103.0%。该传感器具有仪器简单、样品用量少、检测时间短等优点,且能够通过不同的金属硫化物-QDs同时检测多种真菌毒素,为真菌毒素的快速筛选提供了新途径。

图 5 检测OTA和FB1的磁控电化学适配体传感器[26]Fig. 5 Magneto-controlled aptasensor for simultaneous electrochemical detection of OTA and
2.5 基于先进材料的ECL适配体传感器
ECL适配体传感器同时具备化学发光技术和适配体传感器的优点,能极大地提高检测的灵敏度,已成为适配体传感领域一个重要的研究方向[61]。
Zhao Yuan等[62]利用离子铱(Ir)络合物良好的电化学发光效率和AuNPs较大的比表面积、优异的导电性,开发了用于FB1高灵敏测定的AuNPs-Ir驱动的电化学发光适配体传感器,检出限低至0.27 ng/mL,并已成功的用于小麦样品中FB1的测定,加标回收率为97.6%~107.5%。Yang Mengli等[63]基于QDs-ECL和核酸外切酶辅助OTA循环信号放大,开发了一种高灵敏的ECL适配体传感器(图6)。在该体系中,当不存在OTA时,生物素修饰的适配体会和固定在修饰了CdTe-QDs电极表面的cDNA杂交形成双链DNA,并通过链霉亲和素-生物素之间的强相互作用捕获链霉亲和素修饰的碱性磷酸酶,在电位扫描期间,CdTe-QDs会和碱性磷酸酶产物的电氧化物质之间发生电子转移,导致低的ECL响应。当存在OTA时,OTA与生物素-适配体的特异性结合使其远离电极表面,电子转移被抑制,ECL信号得以增强,核酸外切酶可作用(切割)新形成的复合物并释放靶标物OTA,使其可以开始下一个靶标物循环过程,从而触发更多的适配体切割。该传感器灵敏度高(检出限低至0.64 pg/mL)、选择性强,测定红葡萄酒中的OTA(加标回收率为96%~110%)时,与商业化ELISA试剂盒(加标回收率为94%~112%)的检测结果具有良好的一致性。ECL适配体传感器在电化学适配体传感器的基础上进一步提高了检测的灵敏度和选择性,在真菌毒素检测领域具有良好的应用前景。

图 6 基于QDs-ECL和核酸外切酶辅助OTA循环信号放大的ECL适配体传感器[63]Fig. 6 Electrochemiluminescence aptasensor based on QDs-ECL and exonuclease-assisted OTA cycle signal amplification[63]
3 结 语
适配体所具有的特异性识别作用使其在用于真菌毒素测定的基于先进材料的传感器中格外具有吸引力。然而,目前仍有很多真菌毒素缺乏适配体,需进行大量真菌毒素的适配体筛选工作,完善真菌毒素适配体序列库;已筛选到的真菌毒素适配体在亲和力、特异性以及批次间的稳定性方面存在着不足,可以提出或修订一些适配体重点评价指标来评价和筛选适配体,且目前在真菌毒素检测应用报道中,大多已有序列在个别特定方法中表现良好,仅有少数适配体序列适用性比较强,成为研究者应用的“重点”序列,未来可以提出一些“重点”适配体的应用构型,进一步提高适配体的筛选效率和适用性。通过对文献的整理,分析和总结了现阶段各种基于先进材料的适配体传感器在真菌毒素检测领域存在的优缺点及应用现状(表2),基于先进材料的适配体传感器在真菌毒素快速检测方面的应用具有快速、高灵敏度和高特异性等优势,也存在稳定性差、开发难度大等方面的限制,未来应加强多种真菌毒素同时测定,尤其是真菌毒素现场实地检测中的应用开发。高灵敏度真菌毒素传感器及传感体系、小型便携式的商业快检设备和速测产品将是食品或农产品中多种真菌毒素检测的两大热点发展趋势方向。此外,未来可以考虑如何筛选和利用序列来实现不同种类、不同形态的真菌毒素检测。
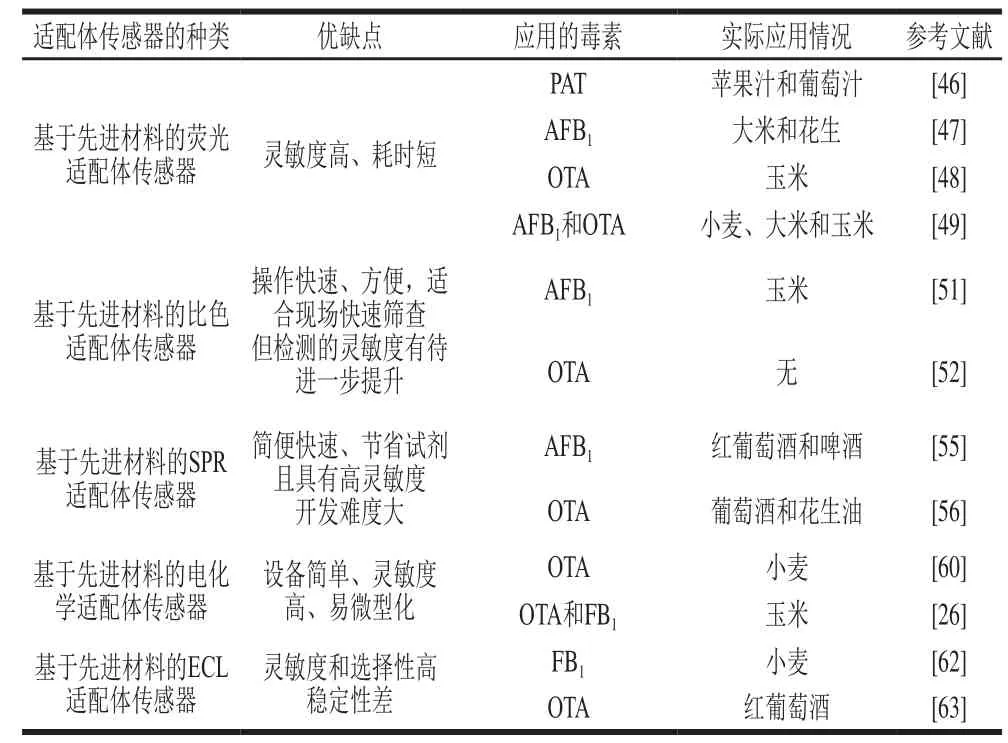
表 2 基于先进材料的真菌毒素适配体传感器Table 2 Aptasensor for mycotoxin detection based on smart materials

