大豆蛋白自组装凝胶研究进展
安 迪,洪 瑞*,李 良,*
(1.东北农业大学食品学院,黑龙江 哈尔滨 150030;2.东北农业大学学术理论部,黑龙江 哈尔滨 150030)
自组装是在平衡条件下,分子通过非共价键自发连接成的结构上具有明确定义的聚集体。分子自组装在生物系统中普遍存在,并且是各种复杂生物结构形成的基础。只要满足适当的条件,自组装就会发生在具有微观尺寸或宏观尺寸的组分中。分子自组装过程需要两个决定因素:自组装的驱动力和引导作用,自组装的驱动力指的是非共价作用为分子间的自组装提供能量;自组装的引导作用是指在自组装驱动力的作用下分子之间发生自适应的组装过程。
自组装不仅赋予蛋白质结构功能,例如良好的稳定性和更高的机械强度,而且在调节生物学功能中起关键作用[1]。自组装凝胶化可以更好地控制所产生凝胶的形状、结构和质地以产生良好的柔软性和生物相容性[2]。当凝胶植入人体组织时,仅会产生轻微的摩擦,且对组织的刺激很小。同时自组装凝胶会表现出较低的生物累积性,因为在大多数情况下自组装凝胶都是由低浓度的小结构单元构成,其在降解后可以通过肾系统排出体外,这可以极大地抑制体内应用时的异物反应[3]。
蛋白质是自然界中的主要构建块,用于构建执行其生物功能的各种复杂结构[4]。大多数蛋白质通过组装成寡聚体以显示出优于单独蛋白质的各种优点,包括稳定性、变构调节性和功能控制性等[5]。了解自组装机制具有非常重要的意义,其已成为形成新型纳米结构有效且前景良好的策略[6]。蛋白质自组装可以很好地解释分子尺寸的变化,同时蛋白质自组装也可以很好地解释从分子到自组装体尺寸变化的耦合现象[7]。
许多食物蛋白质包括卵蛋白[8]、乳清蛋白[9]、大豆蛋白[10]、牛血清白蛋白和溶菌酶[11]已被证实能够在某一特殊条件下(pH 2.0和低离子强度下进行加热)形成淀粉样纤维。Akkermans等[12]研究发现,大豆蛋白原纤维的大多数特性与近年来的研究热点乳清蛋白相当,甚至在某些方面要优于乳清蛋白,这使它们成为替代动物来源蛋白的良好候选物。
1 自组装的机理
1.1 蛋白质自组装的主要作用力
蛋白质分子的组装过程由分子内和分子间吸引力/排斥力的平衡所控制。分子发生自组装主要依靠非共价键的相互作用,常见的非共价键相互作用力包括氢键、疏水作用、静电作用、π-π堆积作用等[13]。氢键主要维持蛋白质最重要二级结构α-螺旋稳定。疏水作用对蛋白质三、四级结构的形成和稳定起着重要的作用。球蛋白由于疏水效应,从分子内到分子外,疏水残基逐渐减少,亲水残基不断增多。疏水侧链堆积形成蛋白质的疏水内核以维持蛋白质折叠的稳定,而极性侧链多暴露在表面,与水分子相互作用。研究表明,疏水侧链相互作用是蛋白质自组装聚合中起最关键作用的因素之一。蛋白质的氨基酸是两性电解质,具有可解离的性质,因此有的蛋白质带正电,有的带负电,而在等电点(PI)时蛋白质不带电。由于大部分的蛋白质带有电荷导致分子之间存在静电力。静电作用的大小不仅跟蛋白质本身氨基酸组成、结构和两个蛋白质之间的距离有关,还与蛋白质所存在环境(尤其是pH值和溶液电解质性质)有关。由于π-π堆积作用多数存在于多肽自组装过程中,所以此处不进行过多阐述。
1.2 蛋白质淀粉样纤维
过去的50 年中,一种特殊类型的蛋白质聚集反应产物(称为淀粉样纤维)出现在人们的视野中。蛋白质通过非共价键形成厚度为4 nm左右、长度在1~10 μm无枝杈的大分子淀粉样纤维结构的聚合物。研究者们发现这种不溶性的纤维性蛋白质其本质是一种高度有序的自组装纤维聚集体,这些原纤维在食品工业中起到了重要的作用,它们可以作为一种有效的增稠剂[14-15]。当蛋白质浓度、pH值、离子浓度和温度等条件符合自组装的要求时,蛋白质可以直接在溶液中自组装成原纤维,例如在初始溶液中增加盐浓度可以增加聚集速率[16]。
淀粉样纤维是高度有序的具有交叉β-折叠结构的蛋白聚集体。在蛋白质折叠过程中,不断重复的分子内β-折叠提供了一种结构的独特性,它通过募集相应的淀粉样纤维而生长。此外,淀粉样纤维中的一维晶体重复结构提供了富含多样性的结构框架[17]。研究者们发现许多疾病(如Alzheimer和Parkinson等)都与体内蛋白质发生β-折叠所导致的沉淀聚集有关[18-20],但这种聚集体同样具有生物功能性,如激素储存功能。另外,虽然淀粉样纤维中β-折叠结构占主导地位,但稳定的α-螺旋构象对于蛋白质自组装的研究同样具有极其重要的意义[21]。
过去的10 年中,科学家们对淀粉样纤维形成的方式进行了总结,大致分为3 类:1)蛋白质结构进行展开和折叠,纤维化的过程中伴随着结构的变化[22]。2)蛋白质或蛋白质片段在其天然状态下存在的不规则序列形成淀粉样纤维[23]。3)蛋白质中暴露出的特殊表面结构与另一个分子的表面结构结合,形成新的淀粉样纤维[24]。这一分类的依据是基于纤维聚合物的成核-聚集模型,如图1所示。这一模型将淀粉样纤维聚合物的形成过程分为成核期、增长期和稳定期3 个阶段。而滞后期的长短主要取决于蛋白质的浓度[25]。
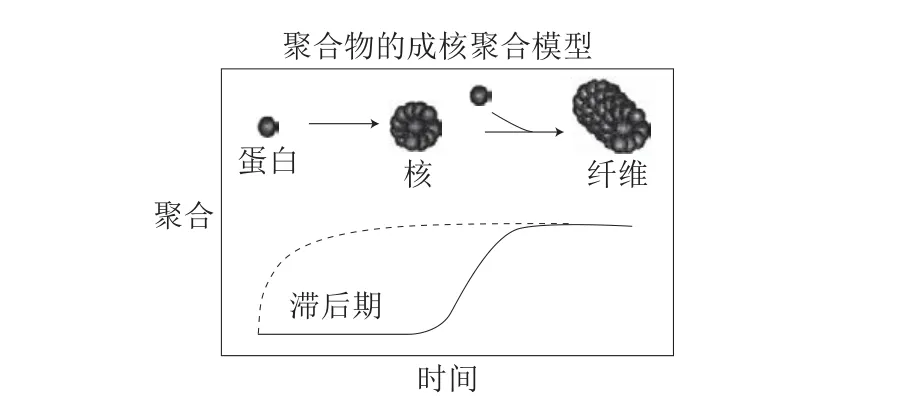
图 1 淀粉样纤维聚集的动力学曲线[25]Fig. 1 Kinetic curves of amyloid fiber aggregation[25]
1.3 蛋白质凝胶化
原纤维化的蛋白质能够在热、酸、盐等的作用下形成凝胶,这类凝胶具有统一的结构、较高的强度和在环境温度下的成胶能力[26-27]。基于原纤维组装的食品纤维蛋白凝胶通常表现出一些独特的质地、结构和感官特性[28]。Munialo等[29]介绍了成型纤维通过酸和加热形成凝胶的方法,通过使用葡萄糖酸-δ-内酯(gluconodelta-lactone,GDL)或通过热诱导进行凝胶化。Mohammadian等[30]通过添加锰和锌盐从原纤维化的蛋白溶液中产生凝胶,然后对所得凝胶样品进行表征并与钙盐诱导制备的凝胶样品进行比较。结果发现二价阳离子类型显著影响纤维蛋白凝胶的结构和功能特性。
2 大豆蛋白自组装纤维化
天然态的大豆球蛋白单体是热稳定的,难以发生聚集。研究发现,在远离蛋白质PI的pH值下进行热处理会使大豆蛋白会发生聚集,最终在疏水作用和静电斥力共同作用下形成纤维状聚集体。Morris等[31]更加详细地阐述了这种纤维化的过程,并设计了一个单体模型。它涉及以下步骤:通过部分变性、成核、聚合和生长阶段激活单体,最后进入终止步骤(图2)。
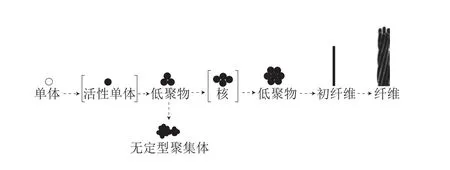
图 2 蛋白质纤维化的过程[31]Fig. 2 Protein fibrosis process[31]
但是,Akkermans等[32]发现了水解的特殊作用,并指出肽是纳米纤维的构建块而不是完整的单体。据此,开发了目前普遍接受的多肽模型,如图3所示。在该模型中,首先将蛋白质水解以产生形成原纤维的肽,以该预水解的蛋白质而不是完整的蛋白质来制备原纤维[33-34]。
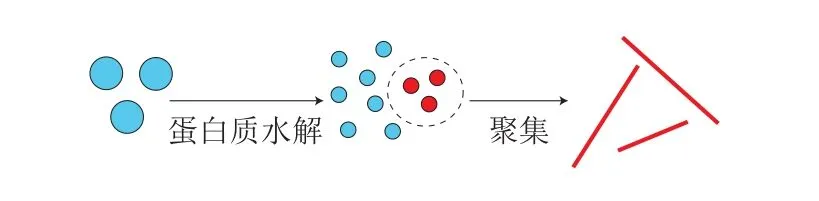
图 3 自组装多肽模型[32]Fig. 3 Self-assembling polypeptide model[32]
同时Akkermans等[12]报道了大豆分离蛋白(soybean protein isolate,SPI)和大豆11S球蛋白在pH 2.0、85 ℃下加热时都能形成柔性的长纤维。透射电子显微镜分析显示纤维的轮廓长度为1 μm,SPI形成的纤维比大豆11S球蛋白形成的纤维拥有更多的“枝杈”,透射电子显微镜图如图4所示。
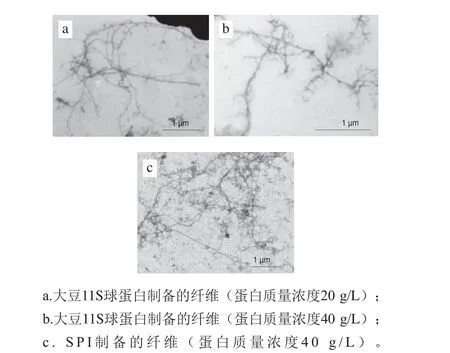
图 4 大豆蛋白纤维透射电子显微镜图[12]Fig. 4 Transmission electron microscopic images of soy protein fibrils[12]
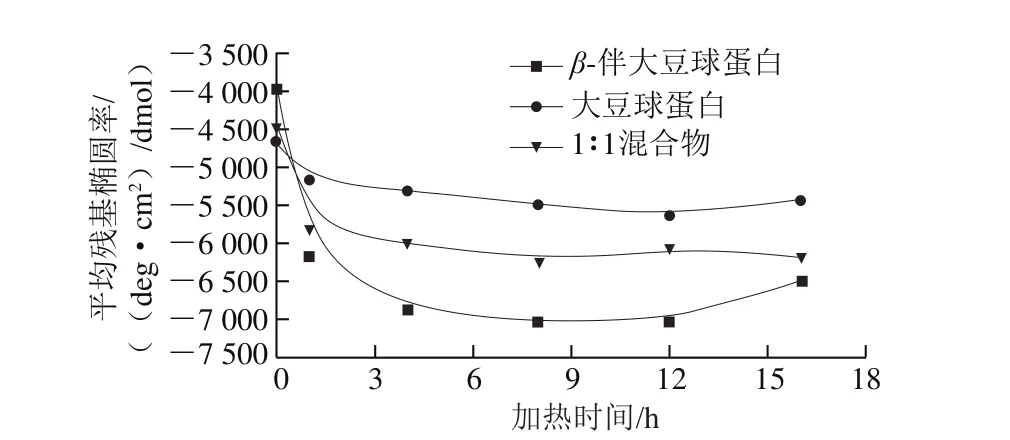
图 5 各种大豆球蛋白在210 nm波长处的负椭圆率随加热时间的变化[35]Fig. 5 Changes in magnitude of negative ellipticity band at 210 nm of various soy globulins with heating time[35]
在国内,Tang Chuanhe等[35]使用硫黄素T(thioflavin T,ThT)荧光光谱和刚果红染色技术研究了在80 ℃加热不同时间诱导β-伴大豆球蛋白、大豆球蛋白及其1∶1混合物在pH 2.0下的原纤维聚集情况。使用原子力显微镜表征形成的原纤维聚集体的形态,同时还评估了加热时蛋白质的构象变化和多肽水解过程。ThT荧光分析表明,β-伴大豆球蛋白具有比大豆球蛋白形成淀粉样纤维聚集体更高的潜力。利用不同加热时间在210 nm波长处负带幅度的变化反映β型二级结构的形态,如图5所示。初始加热期间(小于4 h)的变化更加明显,然后在进一步加热至12 h变化减慢,表明加热时β型二级结构形成。然而,后续研究发现并非所有的肽都参与形成原纤维。Lara等[36]发现水解先于聚集发生,并且发现不同的肽形成不同的结构,包括长的半柔性原纤维和较短的柔性链。Xia Wenjie等[37]将β-伴大豆球蛋白的选择性水解产物(DβH)与不添加蛋白酶的大豆分离蛋白(CSPI)进行比较实验。结果表明,当加热60 min时,CSPI倾向于形成短蠕虫状纤维,而DβH倾向于形成长的半柔性纤维。当加热时间延长至360 min时,二者形成的纤维都表现为簇状。而当加热至720 min时,没有出现纤维状聚集体。当加热至60 min时,CSPI和DβH中的α-螺旋和β-折叠的总量显著增加。其中,CSPI的β-折叠结构从21.9%增加到64.3%,DβH的β-折叠结构从18.4%增加到51.0%。这些结果可能表明蛋白质纤维化的开始,因为β-折叠结构是定义淀粉样纤维形成的标准之一[38]。
当蛋白溶液pH值远离球蛋白pI且离子强度较低时,蛋白质分子所带电荷无法有效地被盐离子屏蔽,此时静电斥力占主导作用,会发生高度有序的自组装纤维化聚集,形成串状的线性聚集体;反之疏水作用占主导,发生无规则杂乱的自组装纤维化聚集,形成球形聚集体[39]。Zhang Yuanhong等[40]研究发现大豆多肽自组装是几种作用力共同作用的结果。他们通过合成大豆肽纳米粒子——一种源于大豆蛋白分离物水解期间形成的肽聚集体,然后使用十二烷基硫酸钠(sodium dodecyl sulfate,SDS)、尿素和二硫苏糖醇(dithiothreitol,DTT)检验疏水作用力、氢键和二硫键。通过目视观察发现单独的DTT并未引起大豆肽纳米粒子的显著分散,而单独或组合的SDS和尿素可以使其发生明显的分散,上述情况表明疏水相互作用和氢键在构建大豆肽纳米粒子中起着至关重要的作用。通过研究粒径的变化发现单独存在的SDS可以使粒径明显下降,但是单独存在的DTT对粒径的影响可忽略不计,即使与SDS一起使用与单独使用SDS相比粒径只发生了微小的下降,这表明二硫键只起到了次要作用。因此,通过分析表明疏水相互作用是维持纳米颗粒内部结构的主要分子内作用力(二硫键起次要作用),而氢键在其外部结构中起关键作用。
3 大豆蛋白凝胶化的研究
凝胶化是食物蛋白质最重要的功能特性之一[41]。原纤化的食物蛋白质被认为是有效的凝胶剂,因为与天然蛋白质相比,它们能以更低的浓度形成凝胶。大多数使用原纤维化蛋白质的研究都采用冷凝胶法。Kuhn等[42]认为该过程包括两个步骤:在远离pI的pH值和低离子强度下加热使蛋白质变性,然后将pH值改变为pI并加入盐。近年来,应用原纤维化的食物蛋白质制造冷凝胶已经成为研究的趋势,下面介绍几种诱导大豆蛋白自组装凝胶的因素。
天然大豆球蛋白具有强烈的自发组装成自相似结构聚集体的趋势,自组装纤维化的反应条件是pH值远离PI,除了接近等电点的高浓度外,这些蛋白质在天然状态下不显示大规模自组装。当制备溶液接近中性pH值时,体系迅速达到稳态。在中性pH值下形成的天然大豆球蛋白的自组装结构类似于通过加热球形食物蛋白的水溶液形成的聚集体结构[43]。Chen Nannan等[44]研究了在pH 5.8~7.0之间pH值对无盐溶液的影响,同时在中性pH值下研究了添加一价盐的效果。当pH>6.4时,可以在低蛋白质量浓度和非常低的离子强度下获得不含聚集体的大豆球蛋白溶液。在较高的蛋白质量浓度下,大豆球蛋白自组装成自相似的聚集体,分形维数df=1.8,其大小随着蛋白质浓度的增加而增加。当溶液稀释时,聚集体在数周内缓慢解离。通过考虑大豆球蛋白的电荷密度,可以更好地理解pH值和蛋白质量浓度对自组装的综合影响。用重均摩尔质量(Mw)作为质量浓度(ρ)的函数,对于ρ>20 g/L时,Mw随着溶液质量浓度的增加而增加,这意味着增加蛋白质量浓度可驱动大豆球蛋白的自组装。无论溶液在静置过夜后稀释,还是在稀释之前静置10 d,结果都是相同的。为了研究pH值对大豆球蛋白自组装过程的影响,在一系列浓度下制备蛋白质溶液,将pH值固定在5.8~7.0,研究Mw对不同pH值下蛋白质浓度的依赖性。在pH 7.0~6.4之间,Mw随着ρ的增加而微弱地增加,并且无依赖效应关系,但是当pH值降低至6.0或更低时,Mw增加得更强。这种奇怪的现象是当pH值固定时,蛋白质的电荷密度随蛋白质浓度而变化。
蛋白质净电荷为零的pH值可以通过在不同NaCl浓度下滴定来确定,因为滴定曲线会在pI处交汇[45]。由于离子与蛋白质的结合,PI被定义为ζ电位为零时的pH值,最终发现天然大豆球蛋白的pI为4.6。pH值与PI处的盐浓度无关,但pH值与蛋白质平均电荷数之间的关系取决于较高或较低pH值下的盐浓度。在固定pH值下盐对平均电荷数的影响可以根据蛋白质的表面电位来解释,当蛋白质通过释放离子而开始“充电”时,这一变化改变了平移熵的增益,所以在固定的pH值下随着离子强度的增加表面电位降低。随后Chen Nannan等[44]又研究了每种蛋白质不同固定电荷密度下Mw对蛋白浓度的依赖性,对于固定的电荷密度,随着体系浓度增加,Mw逐渐增加,当蛋白质带电量较少时,随着浓度的增加,Mw增加更强,表明静电排斥抑制了自组装。接着将相同的数据绘制为固定蛋白质浓度下α(电荷数)的函数。对于给定的蛋白质浓度,Mw在α<-150时变化很小,然后在α于-150~-140之间急剧增加,最后在α>-140时依赖于α的程度变得相对较弱。就pH值而言,Mw的急剧增加发生在pH 6.0~6.4之间,但它取决于蛋白质浓度。对于给定的蛋白质浓度,聚集体在较低pH值下较大,这可归因于蛋白质的绝对净电荷密度(|α|)的降低。然而,为了理解浓度的影响,需要考虑到如果pH值固定,蛋白质的净电荷密度随着蛋白质浓度的增加而增加。当|α|固定后,随着蛋白质浓度的增加,摩尔质量逐渐增加,表明天然大豆球蛋白的自组装是通过静电相互作用决定的。
在pI方向上蛋白质发生热变性后,蛋白质溶液的缓慢酸化也可用于形成冷凝胶。GDL可以在加入水后部分水解成葡萄糖酸降低pH值[46-47]。根据GDL的这种特性,de Jongh等[48]使用GDL将原纤维化的豌豆蛋白、乳清蛋白和大豆蛋白诱导制备自组装凝胶:首先将豌豆蛋白、乳清蛋白和大豆蛋白在pH 2.0、85 ℃下诱导形成淀粉样纤维,然后将原纤维化溶液的pH值调节至7.0并加入GDL,最后在25 ℃下反应15 h。结果发现乳清蛋白原纤维比豌豆和大豆蛋白原纤维产生了更高储能模量的凝胶。
上述方法中原纤维化通常发生在非常低的pH值条件下,但Farjami等[49]用碱滴定原纤维化的溶液以产生盐诱导的凝胶化。为了制备无盐蛋白质凝胶,通过透析使原纤维化的蛋白溶液脱酸,产生无灰水凝胶。将不同浓度(0、20、40、80 mmol/L)的CaCl2添加到透析水中,Ca2+和Cl-逐渐渗入到蛋白质原纤维溶液中,这导致原纤维溶液缓慢凝胶化。零灰分含量的蛋白质水凝胶是用于传递对离子敏感的生物活性分子的潜在候选物,如某些由于与离子结合导致药效下降的药品。
4 结 语
目前,基于大豆蛋白的系统如水凝胶、乳液、薄膜、纤维和纳米颗粒被大量用于递送生物活性物质和营养保健品。此外,与动物来源的蛋白质相比,植物来源的蛋白质如大豆蛋白可能是更安全的传递系统[50]。然而,大豆蛋白在酸性pH值下的低溶解度,特别是在pH值约4.8时的低溶解度,限制了它们在酸性食品和饮料中的应用[51]。在此,研究人员专注于由大豆蛋白制成的水凝胶作为生物活性分子的有效载体。Hu Hao等[52]采用超声波处理蛋白质,然后利用转谷氨酰胺酶进行交联,所产生的凝胶疏水性增加,从而提高了核黄素的包封率。Chien等[53]在不使用化学改性剂或交联剂的情况下,制备具有不同质量分数(15%、18%和20%)的机械性能稳定的大豆蛋白水凝胶,该方法制备的水凝胶可以直接向体内注射。同时大豆蛋白自组装水凝胶由于其低成本和安全特性未来在食品领域的应用前景广阔[54]。
自组装凝胶将蛋白质科学和超分子化学融合在一起,目的是面向下一代再生医学、药物输送、催化生物材料等的高科技应用[55]。其卓越的特性是食品和制药领域运载各种营养保健品并保护其生物活性成分的有效工具。然而,未来的研究应该在大豆球状蛋白的基础上进行更多关于针对它们突出特征的水凝胶研究,例如产生较低浓度的凝胶化以制备低能量的递送系统。此外,缺乏体内实验给许多研究带来了局限性,这方面的研究应该成为未来的焦点。

