煎炸食品中多环芳烃的生成及其控制技术研究进展
张 浪,杜洪振,田兴垒,刘 骞,孔保华*
(东北农业大学食品学院,黑龙江 哈尔滨 150030)
煎炸是一种快速便捷的烹饪技术。在煎炸过程中,食物表面温度迅速升高,水分汽化而形成酥脆干燥的质地,油脂的热降解反应、蛋白质与还原糖之间的美拉德反应赋予食品特殊香味,如由低级的、不饱和的醇类和醛类构成的油脂香与由吡嗪、吡啶、呋喃酮等含氧、含氮的杂环化合物所构成的焦糖、烘烤香。此外,蛋白质与还原糖之间的美拉德反应、焦糖化反应等能使食品具有特殊色泽。煎炸食品因酥脆的口感、金黄的色泽和特殊的风味而深受消费者喜爱[1]。然而,食品在煎炸过程中也会产生多环芳烃(polycyclic aromatic hydrocarbons,PAHs)等有害物质,会对人体健康造成危害[2]。
目前,许多研究者报道了烟熏、焙烤和烧烤食品中PAHs的来源、形成机理、生成影响因素及控制方法。Ledesma等[3]发现肉制品在烟熏过程中可以被PAHs污染,并主要从烟熏历史、方式、目的以及烟的组成成分、PAHs的形成和转运机制、PAHs测定分析方法等方面进行了综述。此外,冯云等[4]介绍了PAHs对人体的危害作用,并主要综述了烘烤对肉制品中PAHs含量的影响及控制措施。然而,煎炸食品中PAHs的形成机理、影响因素、毒害机理和控制技术方面鲜有综述性报道。本文对PAHs的结构、来源、形成机理和危害进行了介绍,并对煎炸食品中PAHs生成影响因素及其控制技术等方面进行了综述,旨在为煎炸食品中PAHs控制与应用提供理论参考。
1 多环芳烃的概述
1.1 多环芳烃的结构与特性
PAHs是一大类由只含碳和氢原子的稠合芳环构成的有机化合物,含有5 个或更多个芳环的化合物称为高分子质量PAHs,而含有少于5 个环的化合物称为低分子质量PAHs[5]。PAHs具有许多物理和化学性质。在物理性质方面,PAHs常以淡黄色或绿黄色、白色或无色晶体形式存在,其主要特点是熔点和沸点高,但蒸气压和水溶性低,其中水溶性随着分子质量的增加逐渐减小,并且由于PAHs具有高度的疏水性而易溶于有机溶剂;在化学性质方面,PAHs具有抗氧化性和还原性,并且二者随着分子质量的增加而呈上升趋势[6]。这些物理化学性质能影响PAHs在环境中的分布。在水相环境中,PAHs通常吸附在颗粒物质上或溶解在油状物中,这可导致水体污染。在大气环境中,低分子质量PAHs分布在气相和颗粒之间,高分子质量的PAHs则仅分布在颗粒间[7]。
1.2 多环芳烃的来源及形成机理
1.2.1 多环芳烃的来源
PAHs是一大类通过有机物的不完全燃烧或热解产生并广泛存在于全球范围内的环境污染物,在各种燃烧和热解过程中可以形成和释放数百种不同PAHs[8]。研究表明,不同的食品加工方式,如焙烤、干燥、烧烤等是PAHs的主要来源[9]。有研究发现烘焙面包中PAHs的含量是原料面粉中PAHs的2~6 倍[10]。有研究者比较未经干燥茶叶和干燥茶叶时,发现干茶叶中PAHs含量是前者的3~211 倍[11]。还有研究发现菲、芴和蒽含量在生鳟鱼烧烤过程中增加了2~3 倍,芴、芘、菲、荧蒽和蒽含量在鲈鱼烧烤过程中升高了2 倍[12]。此外,大量研究表明森林大火、火山喷发时释放的浓烟中PAHs浓度较高,工业发电、焚烧、石油催化裂化、沥青、煤焦油和焦炭的生产过程也会产生PAHs[13-14]。
1.2.2 多环芳烃的形成机理
碳水化合物、脂肪、蛋白质等有机化合物是PAHs形成的重要前体物质,这些有机物质在不完全燃烧或热裂解过程中发生一系列的物理化学反应产生自由基,进而形成PAHs。有研究表明苯自由基与不饱和烃的反应是形成PAHs的主要途径。苯和苯自由基是形成PAHs的重要中间体[15-16],PAHs形成的第1个芳环可以由乙炔(C2H2)与C4Hx自由基反应形成,也可以由两个炔丙基(C3H3)反应形成[17-19]。
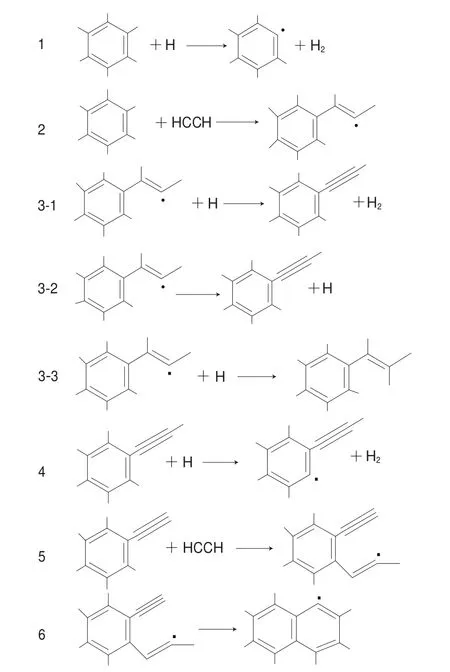
图 1 Frenklach机理[20]Fig. 1 Mechanisms proposed by Frenklach[20]
目前认为PAHs的生成机理主要有3 种,第一种是Frenklach机理,其反应过程如图1所示。首先,苯环先脱掉1 个H形成苯自由基和H2(反应1),接着乙炔加合到苯基自由基的自由电子的位置上形成苯乙炔自由基(反应2),苯乙炔自由基再脱去1 个H形成苯乙炔(反应3-1),而反应3-2没有反应3-1重要,只有在高温条件下才容易发生,反应3-3放出的热量比反应3-1和3-2多,从而直接生成苯乙烯,反应4与反应1相似,即苯乙炔先脱去1 个H形成苯乙炔自由基,然后乙炔分子会加合到苯环自由基的自由电子的位置上形成邻-乙炔自由基(反应5),最后邻乙炔自由基发生环化形成萘基自由基(反应6)[19-21]。
第2种是Bittner-Howard机理,如图2所示。该反应过程的前两步(反应1、2)与Frenklach机理相同,即苯环先失去1 个H形成苯自由基,然后与乙炔发生加合反应生成苯乙炔自由基,不同点在于第2个乙炔不是加合在苯环上,而是加合到新生成的乙炔自由基的自由电子的位置上(反应3),最后与已存在的苯环反应形成第2个环(反应4、5)[22]。
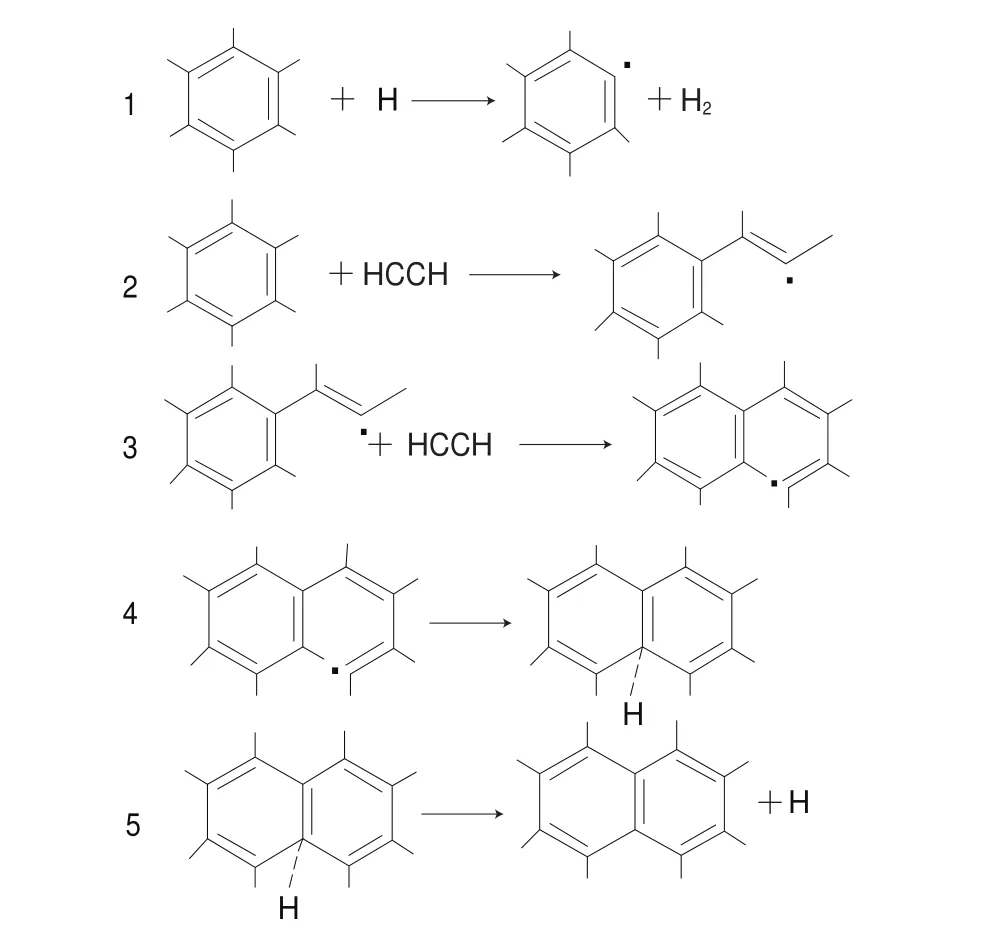
图 2 Bittner-Howard机理[20]Fig. 2 Bittner-Howard mechanism[20]
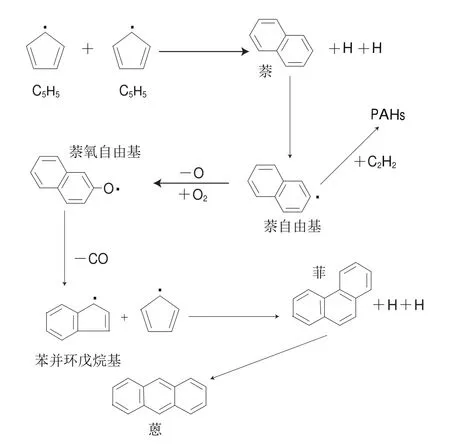
图 3 两个C5H5自由基反应机理[24]Fig. 3 PAHs produced from two molecules of CH[24]55
第3种机理涉及两个C5H5自由基的反应,如图3所示。首先两个C5H5自由基反应形成萘,然后萘失去1 个H形成萘自由基,萘自由基和乙炔经过一系列加成和脱氢反应形成PAHs。此外,萘自由基还会与O反应形成萘氧自由基,其再失去1 个CO形成苯并环戊烷基,然后与C5H5反应形成菲或蒽等产物[23]。
1.3 多环芳烃的危害及限量要求
1.3.1 致癌性
目前已有研究对2 000多种化合物进行了实验,发现500多种化合物具有致癌性,其中多达200种是PAHs及其衍生物[25]。Daniel等[26]通过组织学研究发现,人体对烤肉的摄入量与肾细胞癌风险增加有很大的相关性。Alomirah等[27]也发现科威特儿童、青少年和成年人的主要饮食(烤蔬菜、鸡肉以及烟熏食品)中存在PAHs,其还发现儿童、青少年和成人食用动物源食品后患癌症的风险增加,并推断这可能与食品中含PAHs相关。
近年来,许多学者对化学致癌物的致癌机制进行了大量的研究,发现主要存在两种致癌机制。第1种机制为化学致癌物(如PAHs)通过氧化途径代谢以产生亲电反应产物(如醇环氧化物),其与DNA中的亲核中心或细胞中的其他亲核物质(如蛋白质)发生共价反应以形成稳定的DNA或蛋白质加合物。第2种机制则为单电子氧化途径,形成不稳定的DNA加合物[28]。龙耀庭[29]发现化学致癌物与DNA相互作用形成DNA加合物后,如果得不到体内修复系统修复就可能诱发突变和癌变,因此DNA加合物是致癌和癌症病发之间的分子桥梁。苯并[a]芘(benzo[a]pyrene,BaP)作为PAHs的代表性物质,其本身没有致癌性,但在体内经氧化酶激活形成苯并[a]芘二氢二醇环氧化物(benzo[a]pyrene diol epoxide,BPDE)后就具有致癌性。BPDE具有亲电性,可与DNA的亲核位点鸟嘌呤的外环胺基端共价结合,形成BPDE-DNA加合物,诱发DNA碱基突变,引发癌症[30]。
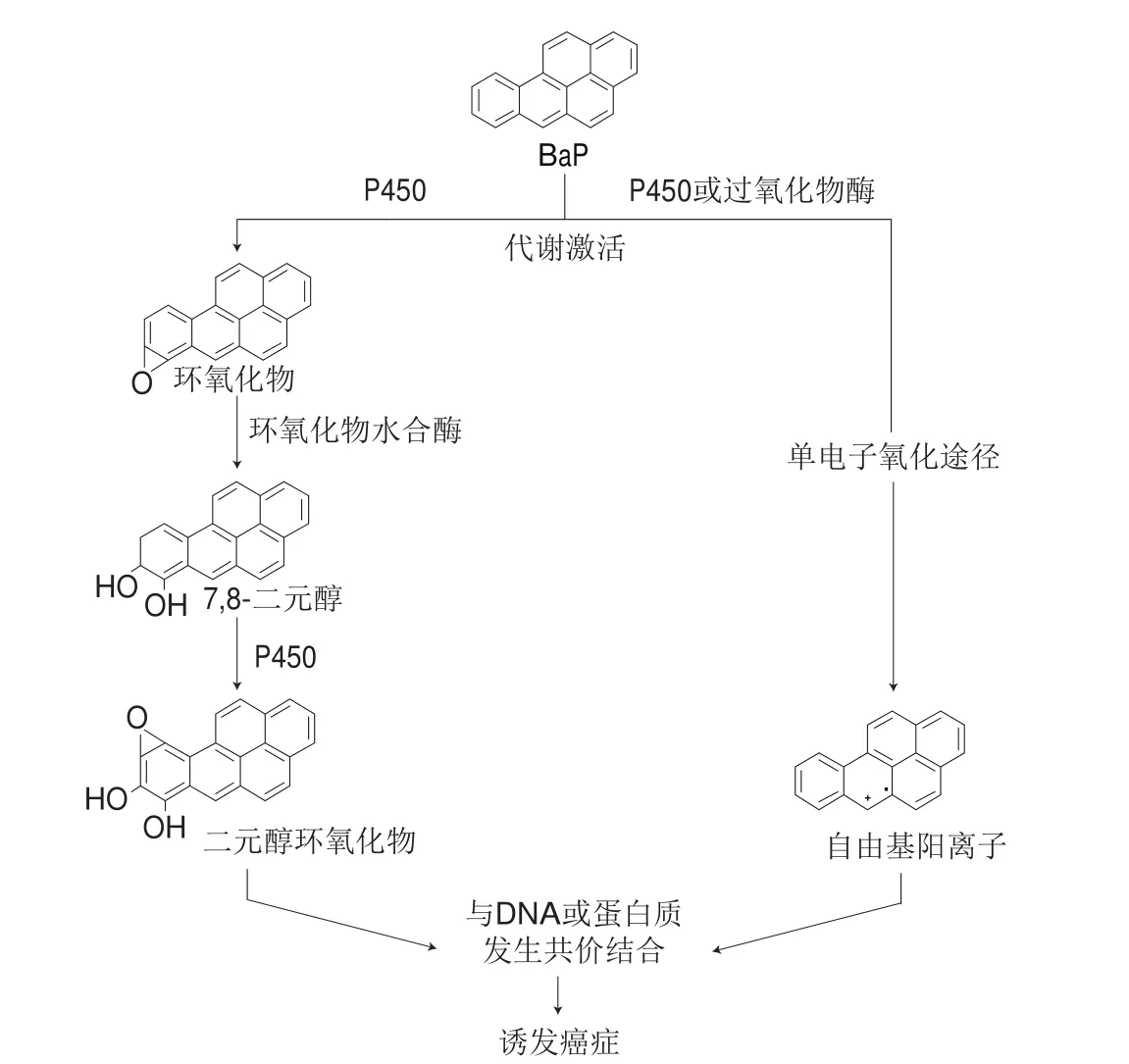
图 4 BaP的两种致癌机制[30]Fig. 4 Two carcinogenic mechanisms of benzo[a]pyrene[30]
图4列出了BaP的两种致癌机制。在氧化代谢途径中,BaP先经细胞色素P450激活生成环氧化物,然后在环氧化物水解酶的作用下形成7,8-二元醇,再经P450作用形成二元醇环氧化物,最后该亲电反应产物再与DNA或蛋白质发生共价反应,形成稳定的DNA加合物或蛋白质加合物;在单电子氧化途径中,BaP经P450或过氧化物酶作用失去1 个π电子形成自由基阳离子,然后该自由基阳离子会与DNA或蛋白质发生共价反应形成不稳定的DNA或蛋白质加合物,从而引发癌症[30]。
1.3.2 致畸性
目前有许多研究表明PAHs具有致畸性。Mu Jinli等[31]发现水生动物长时间接触菲、BaP和芘会对其胚胎产生毒性作用。小鼠实验研究表明,孕期间摄取高水平的BaP会导致后代身体缺陷和体质量下降[32]。目前尚不清楚这些情况是否会在人体内出现,但是Perera等[33]已证明不良分娩与怀孕期间接触PAHs相关,PAHs可导致后代出生时体质量下降、早产和后代发育迟缓。此外,还有研究发现母亲产前暴露于含PAHs的环境中,会对孩子的智力、知觉推理和记忆能力产生不良影响[34]。
1.3.3 基因毒性
PAHs的基因毒性已被啮齿动物和哺乳动物(包括人)的体外细胞系实验证明,大多数PAHs本身并不具有基因毒性,只有代谢为二醇类环氧化合物后与DNA发生共价反应,才能诱发基因毒性损伤。基因毒性在致癌过程中起着重要作用,可能在某些发育毒性中也发挥着作用[28,35]。有学者采用SOS显色试验标准试管法检测了32 种PAHs对大肠杆菌PQ37的遗传毒性,发现苯并[g,h,i]荧蒽、苯并[j]荧蒽、BaP、䓛和二苯并[a,l]芘,在外源代谢活化混合物存在下,培养时表现出很高的遗传毒性[36]。
1.3.4 免疫毒性
据报道,PAHs在啮齿动物体内能诱导免疫抑制反应。大量的研究表明BaP、3-甲基胆蒽和7,12-二甲基苯[a]蒽在人体中具有高度免疫毒性,而二苯并[a,c]蒽和二苯并[a,h]蒽具有中等毒性,9,10-二甲基蒽、苯并[e]芘和苯并[a]蒽具有轻度免疫毒性[37]。然而,PAHs诱导免疫毒性的细胞和基因水平确切机制尚不清楚,但是免疫抑制可间接地诱导癌症[38]。有研究发现免疫系统是许多毒性PAHs的作用对象,一方面,淋巴细胞可能受PAHs的影响,BaP和二甲基苯[a]蒽能抑制小鼠T和B细胞增殖,并改变T细胞相关细胞因子的产生。此外,它们还可以抑制人体T淋巴细胞的有丝分裂,并通过引发前B淋巴细胞凋亡来改变B淋巴细胞的生成。另一方面,巨噬细胞和树突状细胞也可能受PAHs的影响,BaP能抑制巨噬细胞的形成及其表现型物质CD71和CD64的表达,并能抑制其内吞和吞噬作用[39]。一些研究还发现免疫抑制反应可导致免疫细胞产生的细胞因子分泌增加,从而引起炎症、肿瘤和过敏反应的发生[40]。
1.3.5 限量要求
由于PAHs对人体具有潜在的毒性,因此许多国际机构如美国环境保护署、国际癌症研究机构、欧盟委员会的食品科学委员会和欧洲食品安全局等都对其进行了相关研究并制定了限量要求。美国环境保护署将苯并[a]蒽、萘、芘、䓛、苊烯、苊、芴、菲、蒽、荧蒽、苯并[b]荧蒽、苯并[k]荧蒽、BaP、二苯并[a,h]蒽、苯并[g,h,i]苝、茚并[1,2,3-c,d]芘这16 种PAHs列为“优先控制污染物”,即PAH16[41]。食品科学委员会也列举出15 种PAHs,并发现其对实验动物的体细胞具有致突变性和遗传毒性。表1列举了一些常见的PAHs的信息。此外在实验动物的各种生物测定中也发现15 种PAHs除了苯并[g,h,i]苝外都具有明显的致癌作用。食品科学委员会根据两种煤焦油混合物对小鼠致癌性的研究和食品中PAHs的光谱分析,建议将BaP作为食品中致癌性PAHs的生成和发挥作用的标志物[42]。然而,欧洲食品安全局认为BaP不适合作为食物中其他PAHs的标志物,而将苯并[a]蒽、BaP、苯并[b]荧蒽和䓛列为食物中PAHs的标志物,即PAH4,并将这些化合物的最高限量设为10 µg/kg[43]。到目前为止,不同国家和组织都设定了食用油或食品中PAHs的最高限量。欧盟将食品中的BaP的最高含量设定为2 µg/kg[44],德国脂肪科学协会建议高分子质量的PAHs的限量为5 µg/kg,总PAHs的限量为25 µg/kg[45],而GB 2716ü2005《食用植物油卫生标准》将BaP的限量定为10 µg/kg[46]。
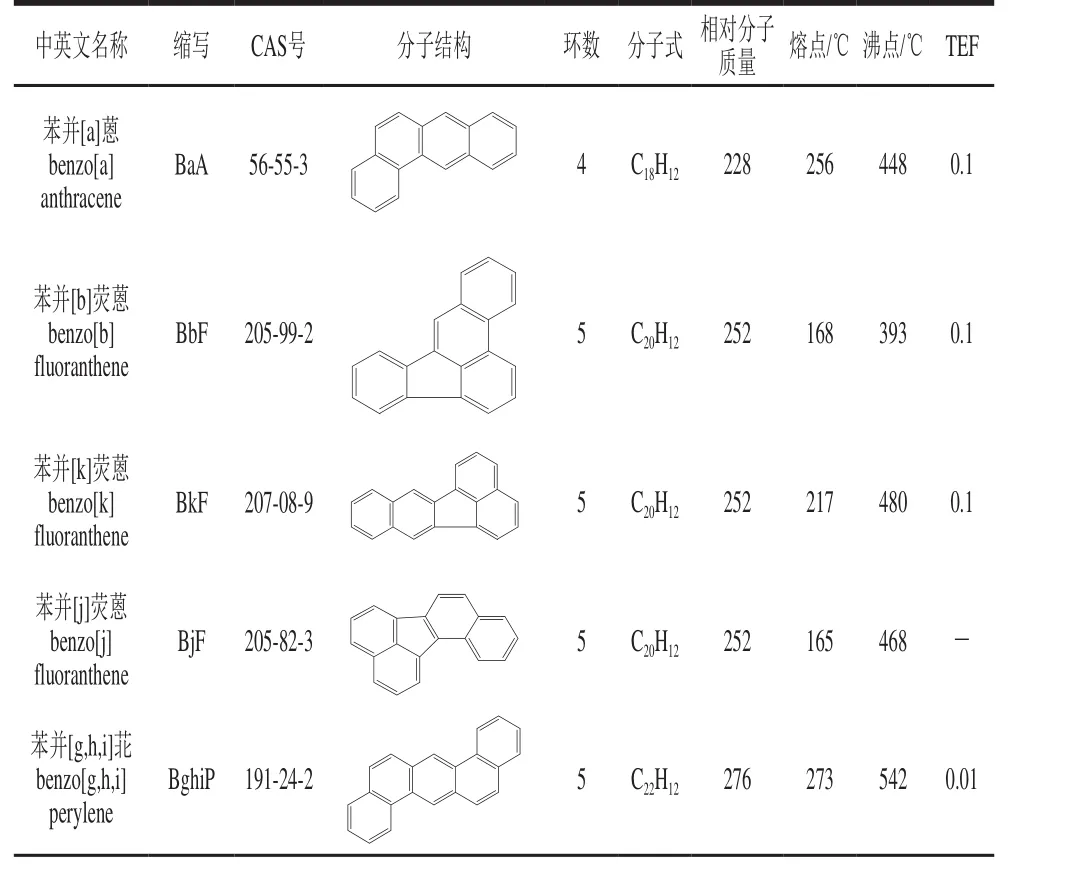
表 1 一些常见的PAHs的信息[3,24]Table 1 Information about some common PAHs[3,24]
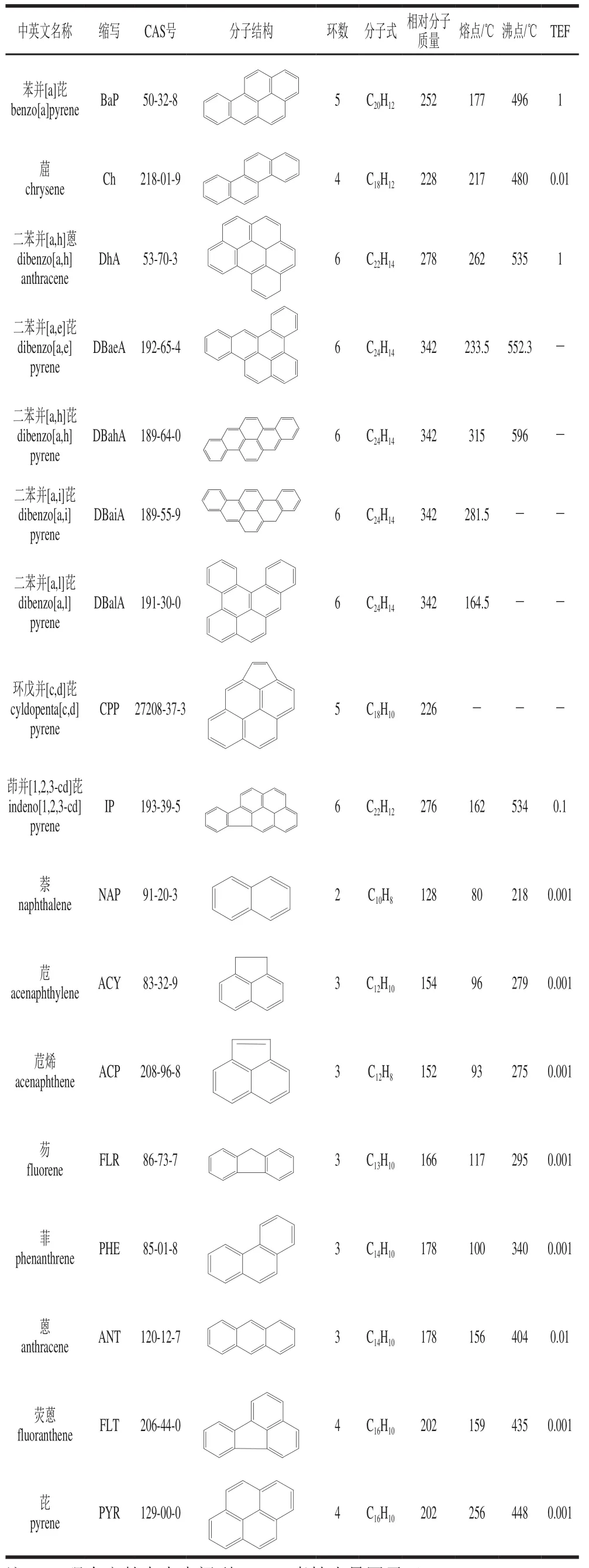
续表1
2 煎炸食品中多环芳烃生成的影响因素
2.1 温度和时间
PAHs的生成与温度和时间有着非常紧密的关系。研究发现当煎炸温度高于200 ℃时,脂肪、蛋白质和碳水化合物热解时可生成BaP[47]。还有研究表明,油温低于240 ℃时,产生的PAHs量相对较少,当油温达到270 ℃及以上时,产生的油烟中会含有大量的PAHs,因此煎炸温度一般控制在160~180 ℃[24]。有学者研究炸鸡块时发现,随着煎炸时间的延长,食用油中PAHs的浓度增加,尤其是高分子质量PAHs。煎炸45 min的样品中高分子质量PAHs含量是煎炸15 min的1.9 倍,是新鲜油的31.5 倍[48]。有学者研究不同煎炸温度和煎炸时间对茶叶籽油中BaP含量的影响,结果表明煎炸温度越高、煎炸时间越长,茶叶籽油及煎炸原料中BaP增加量越多。此外,还发现以鸡翅为煎炸原料,在煎炸第5天并在180 ℃温度下连续煎炸10 h后茶叶籽油中BaP含量由1.92 µg/kg升高至16.13 µg/kg,鸡翅中BaP的含量达1.59 µg/kg[49]。还有研究表明当煎炸温度较低时对PAHs浓度没有显著影响[50]。Purcaro等[51]用花生油炸薯条和鱼,保持温度在160~185 ℃,同样也发现在煎炸前后温度对PAHs无显著影响,这可能与不同油脂品种和PAHs从煎炸油向煎炸食品中的迁移率有关,这也说明在较低的煎炸温度和较短的煎炸时间条件下,食品中的PAHs含量相对较低,但如果长时间在较高温度下煎炸食品,食品中的PAHs会显著升高,因此控制合适煎炸温度和煎炸时间对减少煎炸食品中PAHs含量至关重要。
2.2 煎炸用油种类
煎炸用油的种类与PAHs的生成有很大的关系。有研究人员用大豆油和两种不同比例调和油(棕榈油精油、大豆油、高油酸葵花籽油,体积比分别为2∶2∶1和3∶2∶1)进行煎炸时,发现随着煎炸时间的延长,两种油中的PAHs含量增加,但大豆油中的PAHs含量显著增加[52]。还有研究者发现用花生、向日葵、菜籽、米糠、大豆和棕榈油为原料煎炸油条时,花生油中PAH16的含量最高,为169.9 µg/kg;而大豆油中PAH16的浓度最低,为18.7 µg/kg[53]。石龙凯等[54]用大豆油、米糠油和棕榈油煎炸油条,发现大豆油中BaP含量最高,而米糠油中的PAH4和PAH16增幅最大。由此可见,不同种类的煎炸用油会影响煎炸过程中PAHs的生成。
2.3 煎炸食材
不同食材由于化学组成和各种成分的不同,对煎炸过程中PAHs的含量也有影响。有学者研究了不同食材对PAHs含量的影响,结果表明煎炸食品中的PAHs含量最高,并且在所有的煎炸食材中沙丁鱼中的PAHs含量最多[55]。罗凡等[56]在180 ℃条件下用油菜籽油分别煎炸香蕉、面条、瘦肉和豆腐等,发现煎炸12 h后不同食材中的PAHs含量均显著增加,但煎炸豆制品中PAHs上升速率最快。还有研究者用棕榈油煎炸鸡心、鸡腿、鸡胗、鸡胸和鸭腿,发现家禽肉中的PAHs含量都上升,但是煎炸15 min后鸭腿中的PAHs含量最高[57]。齐颖[24]也发现煎炸猪肉和羊肉中PAHs含量和种类存在较大差异,其中在羊肉中检测出7 种PAHs,而猪肉中只检测到6 种。
3 煎炸食品中PAHs控制技术
3.1 煎炸用油的选择
煎炸用油在高温下长时间加热会产生初级氧化产物,这些产物又会分解产生对人体健康有不利影响的醛、酮和酸等物质。因此,选择合适的煎炸用油至关重要。动物脂肪(例如猪油和牛脂)具有良好的感官品质和货架期,自快餐时代开始以来动物脂肪通常被用作煎炸用油。然而动物脂肪含有饱和脂肪和胆固醇,大量食用后会对人类健康产生危害,所以现在选择植物油(棕榈油、葵花油、大豆油、花生油等)作为煎炸用油[58]。但由于油脂加工工艺和煎炸原料的不同,煎炸过程中产生的PAHs差异较大。杨晓倩等[59]检测了济南市售食用油中15 种PAHs含量,结果表明花生油中PAHs含量最高,色拉油中最低。Shi Longkai等[60]分析了国内85 种市售植物油中16 种PAHs的含量,发现花生油和芝麻油PAHs含量最高,大豆油和葵花籽油PAHs含量最低。从总体来看,花生油和芝麻油中的PAHs含量较高,这是因为在制油过程中为了获得香味而采用高温炒籽工艺,并且为了保持香味而没有对油进行精炼处理,导致成品油中PAHs污染程度较高。同时,由于大豆油进行了精炼处理,所以大豆油中的PAHs含量较低。因此,从控制煎炸过程中PAHs产生的角度来说,应尽量选用PAHs含量低的新油进行煎炸[61]。
3.2 添加抗氧化剂
已有研究证明PAHs的形成过程包括一系列自由基反应,而抗氧化剂可以捕获自由基,如PAHs的中间体可以防止PAHs的形成[62]。有报道表明肉制品腌制过程中,加入的大蒜和洋葱中因含有亲脂性多酚、VE和VC等抗氧化成分,可以清除烃类裂解和芳香化合物环化过程中产生的自由基,从而抑制PAHs的形成[63-64]。因此,向煎炸肉制品中添加适量的抗氧化剂是一种非常有效的减少PAHs生成的方法。人工合成的抗氧化剂,如丁基羟基茴香醚、丁基羟基甲苯、没食子酸丙酯和叔丁基对苯二酚等,虽然对PAHs的生成具有一定的抑制作用,但是由于其对人体有致癌作用而在欧洲和其他一些国家被禁止添加[65]。因此,选择一种可替代的、对人体无毒害作用的抗氧化剂至关重要。有研究者发现天然来源的抗氧化剂,如大蒜、洋葱、辣椒、黑胡椒和姜可以用作煎炸食品的添加成分。因为大葱中含有的二烯丙基硫醚和二烯丙基二硫化物等有机硫化物,洋葱和黑胡椒中含有的槲皮素,辣椒中含有的胡萝卜素和辣椒素,生姜中含有的姜辣素都是非常好的抗氧化成分,具有清除自由基的能力[66-68]。有研究者将大蒜和洋葱添加到猪肉中,发现洋葱可以将煎炸肉中PAHs总含量减少60%,大蒜可以将肉中的PAHs总含量减少54%[8]。齐颖[24]研究竹叶提取物和大蒜提取物对煎炸猪肉中PAHs生成的影响,发现竹叶和大蒜提取物对PAHs生成具有一定的抑制效果,并且在一定添加量范围内随着添加量的增加抑制效果增强。
3.3 工艺控制及设备选择
3.3.1 温度和时间
控制煎炸温度和时间是减少煎炸食品中PAHs生成的关键步骤,食品中的糖类、蛋白质和脂肪等有机物质由于煎炸温度较高,会发生热聚合、热分解等一系列物理化学反应,生成PAHs等有害物质,会对煎炸食品的品质产生不良影响;因此,可以通过控制煎炸温度和时间以减少PAHs的生成。有研究者发现煎炸油不能进行长时间煎炸,应及时更换或部分更换新鲜用油。此外,要尽量减少煎炸油反复使用次数,煎炸油反复使用总时间要控制在8 h以内[69]。煎炸时如果将温度控制在150 ℃以内,则最多可以连续煎炸4 h;如果温度达到200 ℃,煎炸时间则缩短至2 min[70]。煎炸鱼和肉时要采取间断煎炸的方法,不能连续高温烹炸[47]。
3.3.2 煎炸油过滤
煎炸过程中,一些食物残渣在煎炸后会留在油中,如果不及时清除,杂质会因反复加热而产生PAHs并附着在食品表面[71]。目前,常采用滤膜、滤纸和助滤剂对煎炸油进行过滤,过滤是商业煎炸中一种常规的手段[72]。有研究者在170 ℃下用经吸附处理的葵花籽油煎炸薯条,发现油的过氧化物含量和共轭二烯值降低[73],这能使油中PAHs含量降低,因为PAHs含量与油脂氧化直接相关[74]。Kubátová等[75]研究发现甘油三酯高温条件下裂解形成许多产物,其中接近20%的是环化的烷基化合物,而这些环化物质与Diels-Alder反应相关。Diels-Alder反应(图5)即共轭二烯化合物与亲二烯体间发生环化从而形成PAHs等环化物质,所以共轭二烯值的降低有利于减少PAHs的生成。还有研究者在165~185 ℃下煎炸鸡肉馅饼,并用滤纸布过滤煎炸用油,发现游离脂肪酸和总极性化合物含量分别降低了72%和30%[76],这有利于减少煎炸油中的PAHs含量,因为极性化合物的含量与PAHs之间存在很大的相关性[53]。研究表明脂肪酸可以发生脱氧作用产生烷基和烷烯自由基,然后烷烯自由基会发生环化作用生成PAHs等物质,所以游离脂肪酸和总极性化合物含量的下降有利于降低油中PAHs含量[76]。由此可见,通过煎炸油过滤操作能有效地改善煎炸用油的品质,对健康食用煎炸食品有积极作用。
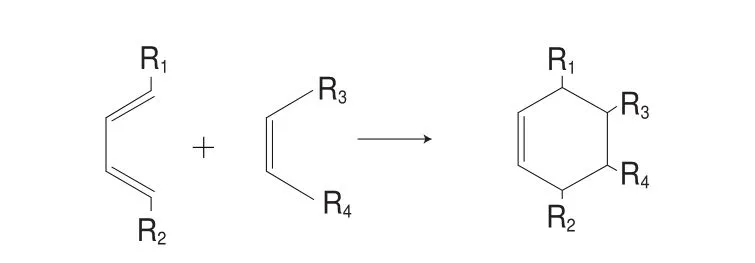
图 5 Diels-Alder反应[74]Fig. 5 Diels-Alder reaction[74]
3.3.3 煎炸设备
有报道发现微量元素(铁、铝和铜等)在煎炸过程中,可加速过氧化氢的分解,使自由基的产生速率提升,从而加速脂质氧化并产生PAHs等有害物质[77]。因此,煎炸设备最好选用不锈钢设备。还有研究者在180 ℃条件下测定煎炸油的折射率,发现深度煎炸锅的表面积和煎炸油体积比是影响热氧化反应的重要因素[78]。Negishi等[79]也发现煎炸锅的表面积和油的体积比越小,可以越有效地抑制深度煎炸过程中的热氧化速率,从而减少煎炸过程中PAHs的生成。此外,食物在煎炸过程中发生剧烈化学变化后产生的一些成分复杂的油烟,成为厨室内主要污染物之一。油烟组分复杂,主要为油脂及食物本身所含脂质的热氧化分解产物,其中包含PAHs[80]。因此,要选择抽油烟机以除去油烟,减轻油烟中有害成分对人体健康的伤害。
4 结 语
PAHs是一类由于有机物不完全燃烧或高温热解产生的致癌、致突变性的物质,对人体健康具有不利影响。有大量研究表明,食品在煎炸过程中会产PAHs,因此煎炸食品的安全性日益受到消费者的关注,也成为了当下亟需解决的安全性问题。本文主要分析了PAHs的来源、形成机理及危害作用,还综述了煎炸食品中PAHs生成影响因素及相应的控制措施。然而由于PAHs的种类较多,影响因素复杂,现在研究报道的PAHs形成机理多集中在化石燃料和环境领域,且由于煎炸食品成分复杂,煎炸过程中可能发生的化学反应也非常多样;所以煎炸食品中PAHs的形成机理有待于进一步研究,建议利用PAHs的前体物质建立模拟体系,以深入研究PAHs的形成机理。此外,本文主要介绍了PAHs对人体健康的危害作用,而BaP、PAH4、PAH16等在致癌、致突变等方面的差异性还有待进一步的研究。PAHs在人体中的消化吸收和代谢途径也是未来研究值得关注的方向。

