高效氯氰菊酯降解菌米曲霉SSCL-3的分离筛选及降解能力研究
陈 锐,门 欣,瞿 佳,邓 媛,赵玲侠,孙晓宇,沈卫荣
(1.陕西省微生物研究所微生物资源研究中心,陕西 西安 710043;2.陕西省科学院秦岭天然产物工程中心,陕西 西安 710043)
【研究意义】菊酯是一种被广泛使用的杀虫剂,主要应用于家庭、农业、及环境等区域内蚊、蝇、蚜虫、鳞翅目害虫等的毒杀。菊酯分为天然除虫菊素及拟除虫菊酯类,拟除虫菊酯为天然除虫菊素的衍生物,目前共有30余种。高效氯氰菊酯是氯氰菊酯的一个异构体,因其生产成本低、药效高以及对哺乳类动物毒性低等特点,在我国广泛使用。菊酯类农药有触杀作用,通过作用于神经突触和神经纤维,扰乱昆虫电位性钠离子通道使之过度兴奋、运动失调继而麻痹死亡[1]。过去普遍认为菊酯属低毒杀虫剂,对环境友好,但目前许多研究表明菊酯对斑马鱼、蜜蜂、水藻等有较高毒性[2-4],导致脊椎动物内分泌紊乱[5],干扰免疫系统[6],具遗传毒性[8],危及孕妇及胎儿[7]。【本研究切入点】利用微生物降解土壤中残留的菊酯类农药是一种经济的方法,并且该方法不产生二次污染[9]。微生物可将复杂有机分子最终分解成为H2O和CO2,利用微生物增殖速度快的特点,在短时内快速降低土壤中农药残留的水平,使土壤恢复健康状态[10]。【前人研究进展】已有研究表明细菌[11]、真菌[12]均具有效降解菊酯类农药的潜能。但目前均处于实验室研究阶段,尚未发现适宜应用的生产型菌株。【拟解决的关键问题】本研究从土壤中筛选获得一株真菌菌株,该菌可利用高效氯氰菊酯作为其碳源,对多种菊酯类农药均有作用,或能解决土壤中残留菊酯类农药的问题。
1.1 材料
1.1.1 样本 样本来源于陕西省周至设施棚室、果园及秦岭田峪植物根际或露地土壤,共收集土壤样本70余份。
1.1.2 无机盐培养基 硫酸铵 0.4 g,硝酸铵 1.2 g,磷酸二氢钾 0.5 g,磷酸氢二钾1.5 g,硫酸镁 0.5 g,氯化钠 0.5 g,酵母提取物0.05 g,pH 7.0,蒸馏水定容至1 L。121 ℃ 灭菌20 min。
1.1.3 产毒培养基(AFPA) 蛋白胨 1 g,酵母粉1 g,柠檬酸铁0.05 g,四氯醌0.0002 g,琼脂2 g,加蒸馏水定容至1 L,121 ℃ 灭菌20 min。灭菌后加入1.5 %的氯霉素。
1.2 方法
1.2.1 高效氯氰菊酯降解菌的分离 在100 mL液体无机盐培养基摇瓶中加入1 mL高效氯氰菊酯(终浓度1 g/L,10 %悬浮剂)混匀。加入土样5 g,28 ℃ 150 r/min 连续培养7 d,转接1 mL 发酵液至新摇瓶(含高效氯氰菊酯1g/L 100 mL液体无机盐培养基),连续转接3次。将发酵液梯度稀释,取100 μl涂布于含高效氯氰菊酯(1 g/L)的无机盐固体培养基上,28 ℃培养,待菌落形成。真菌进行PDA平板划线纯化3次,再接种于PDA斜面保藏。
1.2.2 菌株降解能力的初步测定 将真菌孢子接种于PDA液体培养基,28 ℃ 150 r/min摇瓶震荡发酵24 h,形成微小的菌丝球悬液。90 mL无机盐培养液中分别加入终浓度为500 mg/L的高效氯氰菊酯,接入菌丝球悬液10 mL,以无菌培养液作为空白对照,3次重复,28 ℃,150 r/min震荡培养,第0、12、24小时测定高效氯氰菊酯含量。标准试剂购自沈阳化工研究院(含量大于99.5 %),方法参照文献[13]。菌悬液5 mL加石油醚10 mL萃取。振荡器震荡1 min,静置10 min。吸取上层有机相,紫外235 nm测定高效氯氰菊酯浓度。
1.2.3 降解菌的形态鉴定 梯度稀释孢子悬液,将适量孢子接种于MA及CYA平板,观察其生长及菌落形态。取少量菌丝接种于PDA插片平板,待菌丝长至盖玻片上后,镜检观察。取少量菌丝接种于PDA插片平板,待菌丝长至盖玻片上后,镜检观察。
1.2.4 黄曲霉毒素测定 取少量孢子接种于AFPA平板, 28 ℃ 培养,观察平板背面色泽变化[14]。将菌株在PDA液体培养基中进行发酵,第 24、48、120、168、240小时各取样1次,120 ℃灭菌,测定发酵液中黄曲霉毒素的含量[15]。
1.2.5 降解菌的ITS rDNA序列鉴定 取摇瓶菌丝球2 mL,离心取菌体,液氮研磨法提取菌株的基因组(TIANGEN DP305)。PCR扩增ITS序列,引物采用ITS1及ITS4序列,测序(奥科)。测序结果在GenBank数据库中进行比对,用系统发育树软件Clustal X及MEGA 4构建分类系统发育树。
1.2.6 降解菌的生长特性 摇瓶生长曲线:转接孢子斜面至平板划线3次活化菌株,培养120 h待生成孢子。将孢子重悬至生理盐水,梯度稀释至10-5,接1 mL孢子悬液入PDA液体摇瓶中, 28 ℃,150 r/min培养,每12 h取样1次,测至96 h,设3个重复。将100 mL菌体过滤至定量滤纸,70 ℃ 烘干恒重,称重计算菌丝生长情况。产孢量测定:以麸皮 50 g,稻壳5 g,水40 mL,豆粕0.1 g∶葡萄糖1 g∶植物油0.5 mL的比例配制固体培养基,107 ℃,灭菌 2 h。取摇瓶菌丝球悬液接种固体发酵,接种量5 %,28 ℃ 240 h静置培养,待孢子充分形成。取培养发酵固体物1 g,放入49 mL 0.5 %的吐温-80生理盐水液中(加玻璃珠),震荡混匀,梯度稀释,涂布于PDA平板,28 ℃,培养48 h,菌落形成计数,计算产孢量。
1.2.7 HPLC法对高效氯氰菊酯残留量测定 准确称取 0.0500 g 高效氯氰菊酯标准品,乙腈溶解,定容至10 mL容量瓶,终浓度5000 mg/L,梯度稀释,HPLC测定,制作标准曲线。
高效氯氰菊酯乳油500 μl加入90 mL无机盐培养基中(终浓度为500 mg/L),接入菌丝球悬液 10 mL,28 ℃、150 r/min震荡培养。0、12 、24 h分别取样测定高效氯氰菊酯含量。在50 mL发酵液中加入等量石油醚,震荡萃取1.5 h,转入分液漏斗,取下层有机相,上层水相转入三角瓶,萃取3次。合并有机相,加入无水硫酸钠去除水份,再转入250 mL烧瓶,56 ℃负压旋转蒸干。分3次加入石油醚溶解,定容至20 mL,待HPLC测定[16]。HPLC检测:色谱柱依利特C18柱,粒径5 μm,流动相:水+乙腈(80:20),流速:1 mL/min,检测波长:235 nm,进样量:10 μl,柱温:35 ℃。
1.2.8 降解菌株对其他菊酯类农药耐药能力测定 在50 mL无机盐培养基中分别加入不同浓度的氯菊酯(25 %粉剂)、溴氰菊酯(2.5 %粉剂)、氯氟氰菊酯(10 %粉剂)、氰戊菊酯(20 %乳油)、联苯菊酯(5 %乳油)(终浓度为50、100、150、200、250 mL/L)的,接入菌丝球悬液5 mL,28 ℃、150 r/min 培养48 h,观察菌株的生长耐受情况。
1.2.9 菌剂制备及土壤室内试验验证 将固体发酵物平摊在台面,自然条件下晾干。按照 固体发酵物∶葡萄糖∶麸皮∶高岭土=2∶1∶4∶3,搅拌混合均匀,作为出发菌剂。在室内进行初步土壤降解试验,土壤盒尺寸为45 cm×30 cm× 20 cm,土壤为无菌营养土,重量约4 kg。首先在土壤中人工添加高效氯氰菊酯,使高效氯氰菊酯含量达到400 mg/kg,再加入菌剂40 g搅拌均匀,保持室内温度20~34 ℃,定期轻翻土壤、喷施补充水份,保持土壤湿度40 %~60 %,一个月之后测定土壤高效氯氰菊酯残留量。
2 结果与分析
2.1 高效氯氰菊酯降解菌的分离
从土壤中分离获得1株在1 g/L高效氯氰菊酯平板上正常生长的微生物菌株,形态观察为真菌。该菌不可在单纯无机盐平板上生长,可以认为该菌以高效氯氰菊酯作为其唯一碳源,是化能异养型菌株,将该菌命名为SSCL-3。
2.2 SSCL-3降解能力初步测定
第0、12及24小时取发酵液,石油醚震荡萃取,取有机相,紫外分光光度计235 nm测定吸光度。与空白对照相比,SSCL-3显著降低了高效氯氰菊酯在发酵液中的含量,12 h发酵液中残留量为70 %,空白对照为99 %。24 h时残留量为27 %,空白对照为89 %,具有显著差异(图1,P<0.01),SSCL-3可有效降解高效氯氰菊酯。根据标准曲线的适用范围来看,当发酵液中高效氯氰菊酯含量低于100 mg/L时,残留量计算值不可取信,因此,为了准确确定发酵后SSCL-3的降解率,需进行HPLC测定。
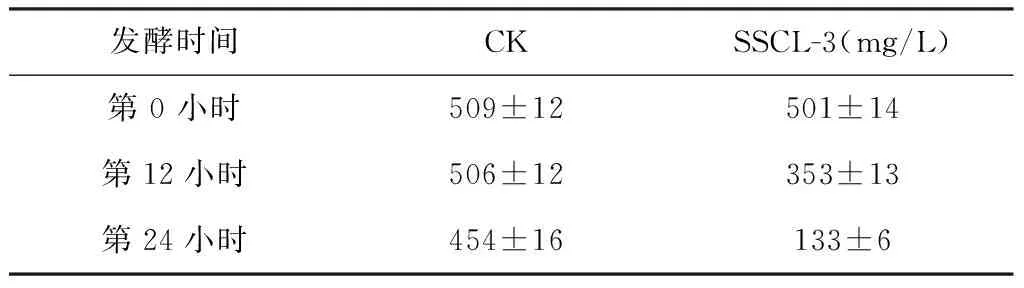
表1 发酵第0、12 及24 小时发酵液中高效氯氰菊酯残留浓度Table 1 β-Cypermethrin residual quantity in fermentation at 0 hour 12 hour and 24 hour
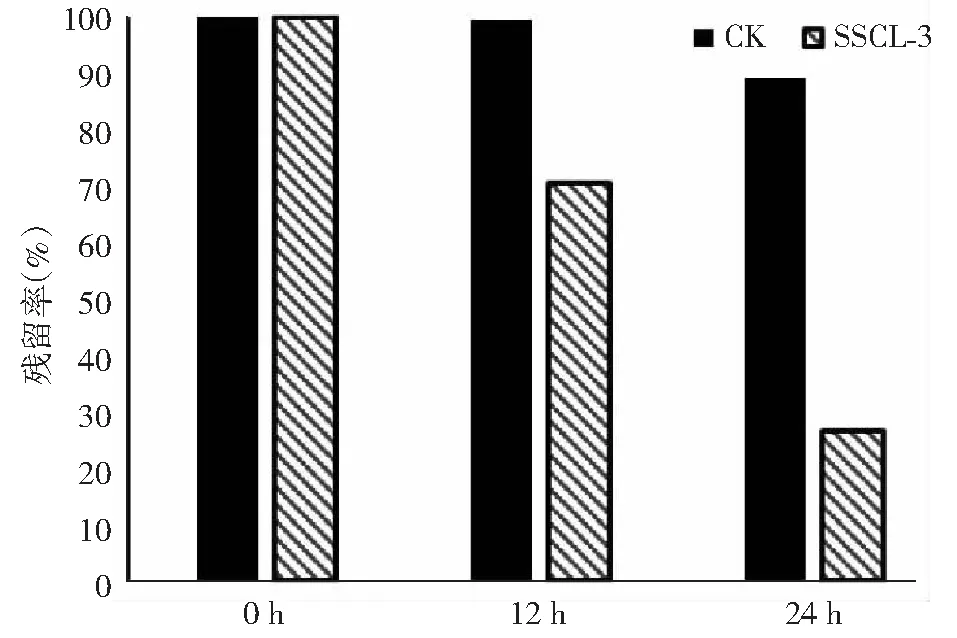
图1 高效氯氰菊酯残留率Fig.1 β-Cypermethrin residual rate in fermentation at 0 hour 12 hour and 24 hour
2.3 降解菌SSCL-3形态鉴定
高效氯氰菊酯降解菌SSCL-3在MA平板上生长缓慢,在CYA平板上生长快,绒状,菌丝松散,背面无色。具有浓密孢子,起初黄绿色,后期褐色。PDA插片镜检观察其分生孢子囊泡膨大形成球形,顶端放射状生出小梗,分生孢子圆形。显示该菌为曲霉(Aspergillussp.)[17](图2)。形态接近黄曲霉与米曲霉,需要对其进行进一步鉴定。
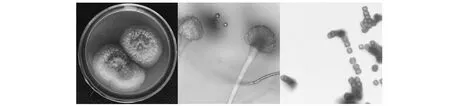
图2 SSCL-3菌株形态鉴定Fig.2 Morphological identification of strain SSCL-3
2.4 黄曲霉毒素测定
在产毒培养基AFPA上接种培养,该菌背面未产生亮黄色物质,培养基呈初始淡黄色(图3)。黄曲霉毒素测定显示该菌发酵至72 h仍不产生黄曲霉毒素。
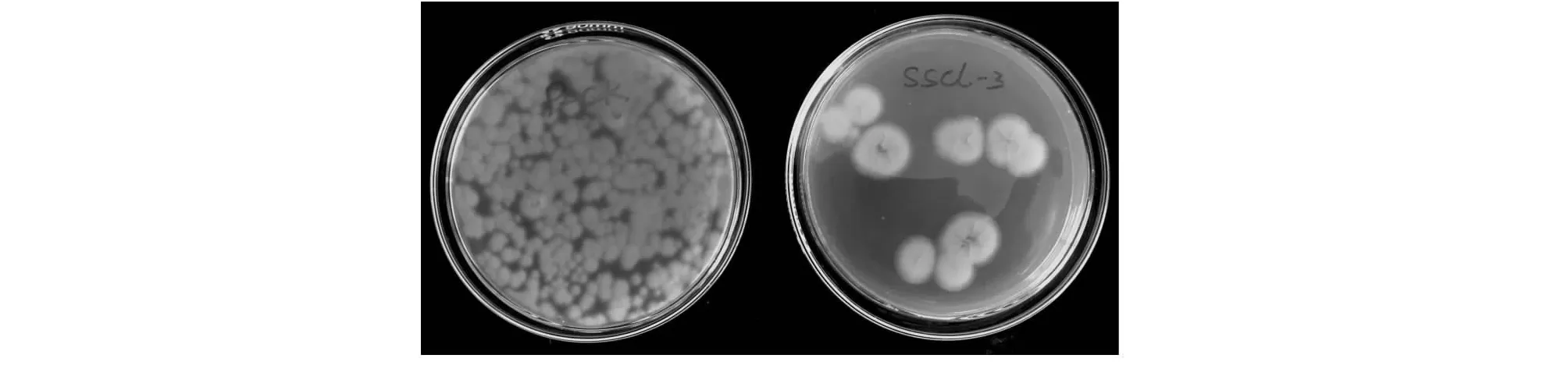
图3 菌株SSCL-3在AFPA培养基上的特征Fig.3 The characteristic on AFPA of strain SSCL-3
2.5 降解菌SSCL-3的ITS序列鉴定
将降解菌ITS 1~4之间序列基因扩增测序,经GenBank数据库比对,与米曲霉及黄曲霉其同源性可达99.79 %。选取CBS、ATCC、NRRL等库藏曲霉属菌株核酸序列作为参考,用系统发育树软件Clustal X及MEGA4构建系统发育树(图4)。系统发育树显示该菌为曲霉属(Aspergillussp.)。ITS鉴定显示接近米曲霉与黄曲霉,产毒试验证明该菌不产黄曲霉毒素,因此可以鉴定该菌为米曲霉(Aspergillusoryzae)。将该序列提交基因bank,登录号为: MK 163533。

图4 SSCL-3与模式菌株建树Fig.4 Phylogenetic tree of strain SSCL-3
2.6 降解菌SSCL-3的生长特性
该菌以孢子悬液接种,28 ℃,150 r/min培养,于48 h进入对数生长期,大约在60 h进入平台期,平台期可一直维持至72 h(图5)。在固体发酵过程中,适当的稻壳有利于通气,易于菌丝深入培养基,大量孢子一般形成于第7天,形成大约 3×1010/g的孢子。

图5 SSCL-3菌株菌丝生长特性Fig.5 Mycelial growth characteristics of strain SSCL-3
2.7 米曲霉SSCL-3对高效氯氰菊酯的降解率测定
不同浓度标准品经HPLC测定,绘制标准曲线Y=617.54x+2032.1 (R2=0.9999),曲线适用范围为5~1000 mg/L。经石油醚萃取,HPLC法测定,摇瓶发酵24 h后测定高效氯氰菊酯残留量(图6)。12 h后高效氯氰菊酯在SSCL-3发酵液中残留量为 74.6 %,与无菌对照具极显著差异(P<0.05)。24 h后,SSCL-3发酵液中残留量为11.1 %,空白对照的残留量为 85.4 %,具有极显著差异(P<0.01)。可以认为米曲霉在无机盐培养基中将高效氯氰菊酯作为碳源进行分解利用。

*同列差异达,显著水平(P<0.05),**同列差异达极显著水平(P<0.01)*Values are significantly different at the 0.05 probability level;** values are significantly different at the 0.01 probability level
2.8 米曲霉SSCL-3对其他菊酯类农药耐受测定
对某一种菊酯农药有降解能力的微生物对其他菊酯类农药也具有一定的降解能力[18],为了验证米曲霉SSCL-3对其他菊酯类家族的耐受能力,制备了其他5种菊酯类农药:氯菊酯、溴氰菊酯、氯氟氰菊酯、氰戊菊酯、联苯菊酯。将不同浓度的菊酯农药加入无机盐培养基,通过观察菌丝球在其中生长是否受到抑制或增殖判断米曲霉SSCL-3是否能耐受该浓度的菊酯类农药。米曲霉SSCL-3具有广泛的菊酯类农药的耐受能力,并且可能具有降解其他菊酯类农药的潜能(表2),降解能力待进一步检测验证。

表2 米曲霉SSCL-3对其他菊酯类农药的耐受
2.9 菌剂制备及土壤室内试验
SSCL-3固体发酵后期形成大量褐色孢子,干燥后与麸皮、葡萄糖、高岭土复配后形成棕色菌剂。土壤室内实验中依照土壤重量的百分之一施用菌剂,保持室内温度20~34 ℃,保持土壤相当的湿度及松散度定期进行补水及翻动,可以在土壤盒内观察到白色菌丝迅速布满土壤表面的过程。经石油醚萃取,HPLC法测定,土壤中400 mg/L的高效氯氰菊酯被降解至222.8 mg/L,降解率达45.60 % (表3)。延长测定时间或降低土壤中受测高效氯氰菊酯的原始含量有利于菌剂对高效氯氰菊酯的降解。
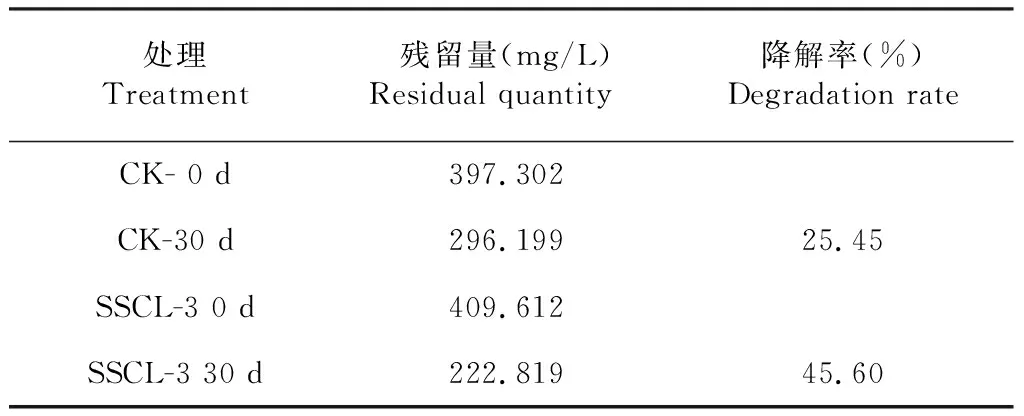
表3 土壤室内试验高效氯氰菊酯残留量及降解率Table 3 β-Cypermethrin residual quantity and degradation rate in soil at lab
3 讨 论
农业生产过程中使用农药可有效控制作物虫害,提高作物产量,促进经济发展。然而不当使用农药亦引起了一些新问题[19]。残留于土壤中的农药一部分发生降解转化,其余则通过各种途径进入环境,或累积于土壤或挥发进入大气或进入地表、地下水或被植物吸收[20-21]。农药残留物引起了生态改变,造成脊椎动物发育和生殖畸形或慢性细胞毒性等问题[22]。研究表明氯氰菊酯在土壤中的消解动态均符合一级动力学方程,原始沉积量与施药量、施药次数密切相关[23]。
微生物法降解土壤残留农药对于恢复生态环境、降低脊椎动物风险具有重要意义[24-25]。目前发现对菊酯类农药具有降解能力的微生物有很多,Tallur等[26]报道微球菌属(Micrococcussp.)菌株CPN-1可将1000 mg/L的氯氰菊酯在8 d内降解90 %。赵浩宇等[27]报道小链小杆菌属(Catellibacteriumsp.)菌株CC-5可将500 mg/L的氯氰菊酯在7 d内降解56 %。在室内土壤实验中据Akbar.等[28-29]报道氯氰菊酯(200 mg/L)在42 d内可被醋酸钙不动杆菌(Acinetobactercalcoaceticus)菌株MCm531、鞘氨醇菌属(Sphingomonassp.)菌株RCm6、副短短芽孢杆菌(Brevibacillusparabrevis)菌株FCm9、巨大芽孢杆菌(Bacillusmegaterium)菌株JCm2、红球菌属(Rhodococcussp.)菌株JCm5或人苍白杆菌(Ochrobactrumanthropic)菌株JCm1降解90 %以上。陈少华等[30]报道在田间试验中金色链霉菌(Streptomycesaureus)菌株HP-S-01可将氯氰菊酯(50 mg/L)降低81.1 %。Tallur、赵浩宇及陈少华等[26-27,30-31]均研究了氯氰菊酯在细菌(微球菌、芽孢杆菌、金黄色葡萄球菌、链球菌、地衣芽孢杆菌和鞘氨醇单胞菌)中的降解途径。细菌主要通过羧酸酯酶的酯键水解作用产生羧酸和醇。经过羧酸酯酶的作用可将氯氰菊酯水解,3-苯氧基苯甲酸是氯氰菊酯细菌降解的主要代谢产物之一。而3-苯氧基苯甲酸属雌激素类物质,具有相当的生殖毒性[32]。在本研究中除米曲霉SSCL-3以外也发现无色杆菌(Achromobactersp.)、恶臭假单胞菌(Pseudomonasputida)、贝莱斯芽孢杆菌(Bacillusvelezensis)、噬线沙雷氏菌(Serratianematodiphila)等菌株,对氯氰菊酯具有一定的降解性能。但部分菌株具有条件致病性如苍白杆菌(Ochrobactrumanthropi)[33]、克雷伯氏菌属(Klebsiellasp.)[34]等,部分不形成孢子的细菌例如鞘氨醇杆菌(Sphingobacteriumsp.)[35]、韩国假单胞菌(Pseudomonaskoreensis)[36]等,不利于应用型研究的开展。目前有关真菌降解菊酯类农药的研究报道不多,但真菌可产生大量孢子有利于生产制备及其在土壤环境中定殖。本研究获得的米曲霉经验证不产生黄曲霉毒素,是较为合适的应用型菌株。其代谢途径及盆栽、田间试验需进一步进行研究。
4 结 论
本研究筛选获得一株可分解利用高效氯氰菊酯的微生物菌株SSCL-3,该菌株可在含1000 mg/L的高效氯氰菊酯无机盐培养基中正常生长。经鉴定确定该菌为米曲霉(Aspergillusoryzae),不产生黄曲霉毒素。经紫外分光光度法及HPLC证实,在含高效氯氰菊酯500 mg/L无机盐液体培养基中,28 ℃、150 r/min摇瓶培养24 h,高效氯氰菊酯的降解率为88.9 %。米曲霉SSCL-3可在其他多种菊酯类农药中正常生长。土壤室内试验证明:土壤水分含量保持40 %~60 %,室内温度20~34 ℃、30 d条件内,米曲霉SSCL-3可将土壤中400 mg/L的高效氯氰菊酯降解45.6 %,显示该菌具有解决土壤残留高效氯氰菊酯问题的潜能。

