CT肠道成像定量评分系统在回结肠克罗恩病活动性评估中的应用价值
吴慧, 程静云, 王艳, 冷小园, 陈敏, 黄梅芳, 吴光耀, 徐国斌
克罗恩病(Crohn′s disease, CD)是一种与基因、环境、免疫及肠道菌群相关的慢性非特异性肉芽肿性炎症,可累及整个消化道,具有反复发作的特点,其特征是肠壁节段性受累和透壁性炎症[1]。 内窥镜仍是胃肠道病变的首选检查方法[2],可直接观察胃肠道黏膜病变,获取病变组织,极大地提高了病变诊断准确率;但其侵袭性常给患者带来不适,并存在相关并发症的发生风险,且无法观察肠腔外肠系膜及其淋巴结表现。CT肠道成像(computed tomography enterography,CTE)可无创性显示肠腔内外病变,成像速度快,患者舒适度高,多平面重建(multiplanar reformation,MPR)可多方位显示病灶,是内镜检查和临床评估等传统方法的有效补充,并且很多研究证实,CTE可用于CD病变活动性和严重程度评估以及临床疗效评估[3-5]。然而,目前仍缺乏一个通用的CTE定量评分系统用于评估和预测CD活动性及严重程度。本研究旨在探讨各CTE征象与内镜评分的相关性,并试图建立一个用于评估和预测CD活动性及严重程度的CTE定量评分系统。
材料与方法
1.病例资料
搜集2016年3月-2019年2月间在我院行CTE检查并经内镜、病理及临床随访确诊的CD患者。病例纳入标准:①按照炎症性肠病诊断与治疗专家共识意见[6],经临床、结肠镜、病理及影像综合诊断为CD;②进行过常规结肠镜及CTE标准化检查,两种检查时间间隔小于1周;③临床、影像及实验室检查资料完整;④CTE检查前,患者无肠切除术病史;⑤肠道充盈及图像质量良好,不影响病变评估者。病例排除标准:①CTE检查发现合并肠道其他病变(如恶性肿瘤、严重肠瘘、腹腔脓肿等)者;②病变局限在末端回肠以上者。
本研究共纳入110例CD患者,其中男82例,女28例,年龄16~62岁,平均(32±12)岁;病程1~60个月,中位病程11个月。另外,本研究新搜集了2019年2月~5月间在我院行CTE检查并符合以上全部标准的CD患者30例(88个肠段),用于对建立的定量评分系统进行验证。
2.CTE检查方法
检查前1天中、晚餐流质或半流质饮食,晚上冲服聚乙二醇电解质散剂120~180 g清洁肠道;检查前70~80 min间断口服2.5%等渗甘露醇溶液1500~2000 mL(以患者体格及舒适度为限),分5~6次等量服用,每次间隔约10 min,扫描前追服300 mL以充盈胃腔和空肠上段;扫描前10 min肌肉注射盐酸山莨菪碱10 mg抑制肠道蠕动,有青光眼、前列腺增生等禁忌证者除外。
CT检查采用德国Siemens Definition 64层双源CT扫描仪。扫描前训练患者呼吸,吸气末屏气扫描。扫描范围从膈顶至耻骨联合下缘。扫描参数:管电压120 kV,管电流160~240 mAs,层厚5 mm。平扫结束后,采用高压注射器以2.5 mL/s流率一次性团注对比剂碘海醇(碘浓度350 mg/mL),剂量1.5 mL/kg,注射对比剂后20~30 s、60~65 s分别行动脉期和静脉期增强扫描。常规扫描后在德国Siemens后处理工作站(Syngo CTWorkplace,VA44A)行1 mm薄层重建以及MRR处理。
3.CTE图像评估
由2位具有副主任医师以上职称,从事腹部影像诊断的放射科医师独立评估图像,采用双盲法对图像进行分析,评价2位医师间测量结果的一致性,各CTE指标取2人的平均值进行后续分析,评估过程中意见不一致时经讨论达成一致意见。观察记录的内容包括病变部位、肠壁厚度、有无肠壁分层强化(门静脉期)、ΔCT值(ΔCT值=门静脉期黏膜CT值-增强前黏膜CT值)、有无肠腔狭窄、有无肠系膜血管增粗(梳征)及肠系膜纤维脂肪增生、病变肠段周围最大淋巴结短径。
病变部位:为了便于比较每个肠段的CTE和内镜评估结果,笔者将病变肠段分为五段(末端回肠、升结肠、横结肠、降结肠及乙状结肠、直肠);同时为了评估各段中CD病变的严重程度,在每个肠段中选取病变最严重处进行评估。肠壁厚度:选取病变肠段充盈较好的部分,在横轴位上同时测量该肠段内径和外径,肠壁厚度=(外径-内径)/2。肠壁强化方式:A型肠壁呈多层状(3层或3层以上);B型肠壁呈双层状,由明显强化的黏膜层及低密度的黏膜下层组成;C型肠壁呈双层状,但无黏膜层明显强化;D型肠壁均匀强化,无分层[7]。在评估时,将A、B两型归为分层强化,计1分;而C、D两型归为无分层强化,计0分;评估强化方式时以门静脉期图像为参照。ΔCT值的测量:首先将每个感兴趣区(ROI)的大小设定为3~6 mm2,采用规则圆形ROI,并将ROI手动置于肠黏膜区域,测出其CT值;同时在其邻近肠黏膜区域以相同的方法勾画两个ROI并记录其CT值,最后计算3个CT值的平均值,即为最终的肠黏膜CT值[8]。本研究采用门静脉期图像来测量肠壁强化程度是基于Wold等[9]的研究结果。由于肠黏膜厚度有限,测量相对比较困难,因此测量时应将图像尽可能放大。肠腔狭窄的评估:为了最大限度地减少假阳性结果,本研究将肠腔狭窄定义为CTE图像上表现为肠腔缩小(内径<1.0 cm),并且伴有明确的近端肠管扩张(为邻近正常肠管的1.5倍)[10],同时结合CT多期扫描图像来区分器质性狭窄(即固定狭窄)和肠收缩所致的一过性狭窄。肠系膜纤维脂肪增生的评估:主要通过测量肠系膜脂肪的密度,若肠壁与肠系膜界面变模糊,且病变肠段周围肠系膜脂肪密度较正常肠段周围肠系膜脂肪密度增高20 HU以上,则认为病变肠段周围肠系膜脂肪增生[11]。病变肠段周围肠系膜淋巴结的测量:本研究将病变肠段周围淋巴结定义为其周围5cm范围内最大的淋巴结,并测量其短径。遇到淋巴结同时属于两个肠段周围,测量其与病变肠段的直线距离,并将其归属于距离较近的肠段。
4.结肠镜检查及评估方法
由一位有经验的肠镜医师采用单气囊电子结肠镜(日本 SIF-Q260 Olympus)进行结肠镜检查。常规清洁肠道后,静脉注射丙泊酚 1.5~2.0 mg/kg诱导麻醉,6.0~8.0 mg/kg·h维持麻醉,经肛进镜至回盲瓣约150 cm行结肠镜检查。
根据克罗恩病简化内镜活动性评分(simplified endoscopic activity score for Crohn disease,SES-CD)[2]对病变肠段进行评估,评估内容包括:溃疡大小(0~3分)、溃疡面积(0~3分)、病变累及范围(0~3分)及肠段狭窄(0~3分)。病变肠段分为5段(末端回肠、升结肠、横结肠、降结肠及乙状结肠、直肠),每个肠段评分的可能值在0~12分之间。根据评估结果将CD患者分为非活动组(0~2分)、轻微活动组(3~6分)及中重度活动组(≥7分),其中轻微活动组和中重度活动组均为活动组。
5.统计学处理

结 果
1.患者基线特征
110例CD患者纳入本研究,其中男82例,女28例,年龄中位数为28岁(16~62岁),病程1~60个月,中位数为11个月。共评估298个病变肠段,其中非活动组80个,轻微活动性组142个,中重度活动组76个。SES-CD为0~11分,中位数为4分;ESR(红细胞沉降率)为4.0~140.0 mm/1 h,中位数为22.5 mm/1 h;CRP(C-反应蛋白)为1.4~134.8 mg/L,中位数为22.2 mg/L。

图1 中重度活动期CD患者,女,22岁,右半结肠、横结肠及左半结肠的SES-CD均为8分。a) 增强扫描门静脉期图像示右半结肠、横结肠及左半结肠肠壁增厚(箭); b) 横轴面图像示横结肠肠腔狭窄(箭); c) 结肠镜示横结肠黏膜充血水肿,结肠袋不典型,血管网欠清,可见多发不规则纵行溃疡及铺路石样改变。
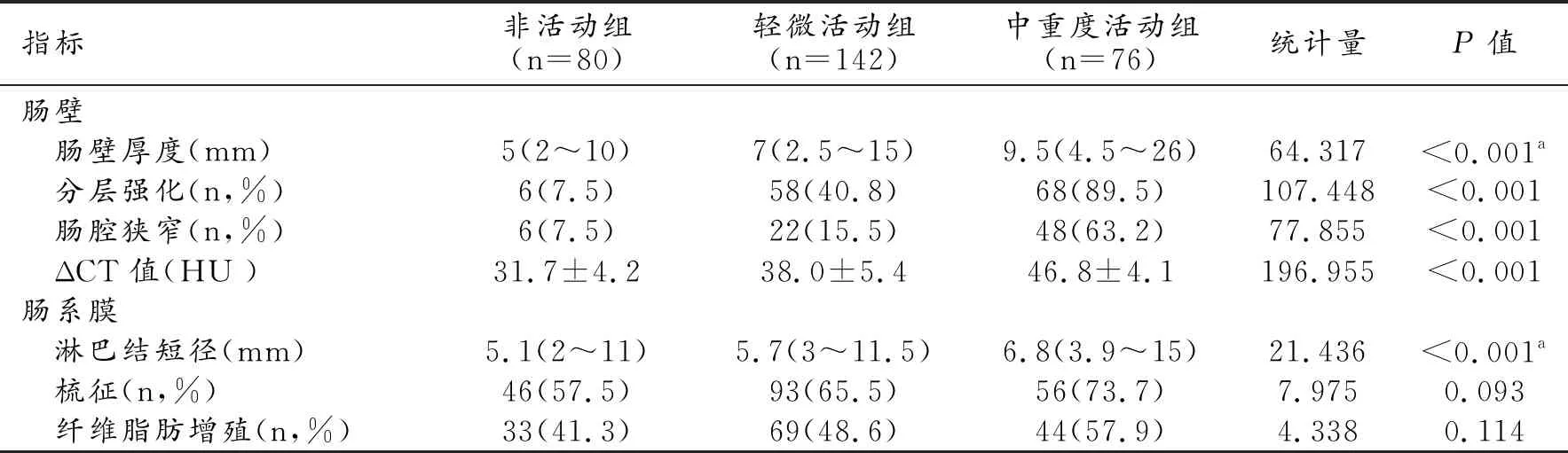
表1 CD各组间的CTE征象比较
注:a表示采用Kruskal-Wallis秩和检验
2位医师对CTE指标测量及评估的一致性均较好,肠壁厚度、ΔCT值、淋巴结短径对应的ICC分别为0.83、0.80、0.85(P值均<0.01);肠壁分层强化、肠腔狭窄、肠系膜血管增粗(梳征)、肠系膜纤维脂肪增生对应的kappa值分别为0.88、0.90、0.89、0.81(P值均<0.01)。
2.CD患者的CTE表现
通过单因素分析发现,各组间的肠壁厚度(图1~3)、ΔCT值、淋巴结短径、肠壁分层强化(图2a)及肠腔狭窄(图1b)的差异均有统计学意义(P值均<0.05),而肠系膜血管增粗(梳征)、肠系膜纤维脂肪增生的各组间差异均无统计学意义(P值>0.05,表1)。
3.CTE指标与内镜评分的相关性分析
相关性分析结果显示,肠壁厚度、ΔCT值、肠壁分层强化与SES-CD均呈中度相关,肠腔狭窄、淋巴结短径与SES-CD呈轻度相关(表2)。通过多分类有序logistic回归模型,初步计算出一个CTE定量评分系统,即CTE评分=0.185×肠壁厚度+0.311×ΔCT值+1.416×肠壁分层强化+1.809×肠腔狭窄(简化CET评分=0.2×肠壁厚度+0.3×ΔCT值+1.5×肠壁分层强化+2×肠腔狭窄)(表3)。
30例(88个肠段)CD患者的验证分析结果表明,该简化CTE
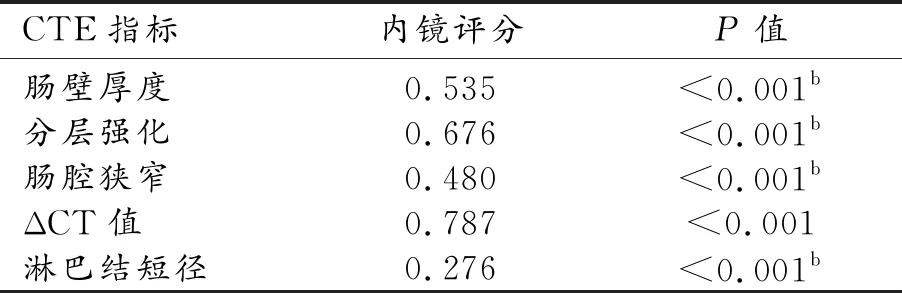
表2 各CTE指标(P<0.05)与内镜评分的相关性
注:b表示采用Spearman相关。
评分系统与SES-CD高度相关,r=0.866(P<0.001)。ROC曲线分析结果显示,简化CTE评分在评估CD活动性与非活动性、区分CD轻微活动组与中重度活动组中的价值均优于单一的CTE评估指标(表4)。当CTE评分=13.3时,其在区分CD活动组与非活动组中的灵敏度和特异度分别为80.3%、95.5%,AUC=0.906(图4);当CTE评分=16.5时,其在区分CD轻微活动组与中重度活动组中的灵敏度和特异度分别为96.3%、90.2%,AUC=0.961(图5)。

图2 轻微活动期CD患者,男,20岁,SES-CD为5分。a)增强扫描门静脉期图像示左半结肠肠壁增厚伴明显分层强化(箭);b)结肠镜示多发不规则小溃疡及充血水肿糜烂。 图3 CD患者,男,22岁,SES-CD为1分。a)增强扫描门静脉期图像示乙状结肠肠壁稍增厚(箭);b)内镜示乙状结肠散在分布针尖样糜烂灶。
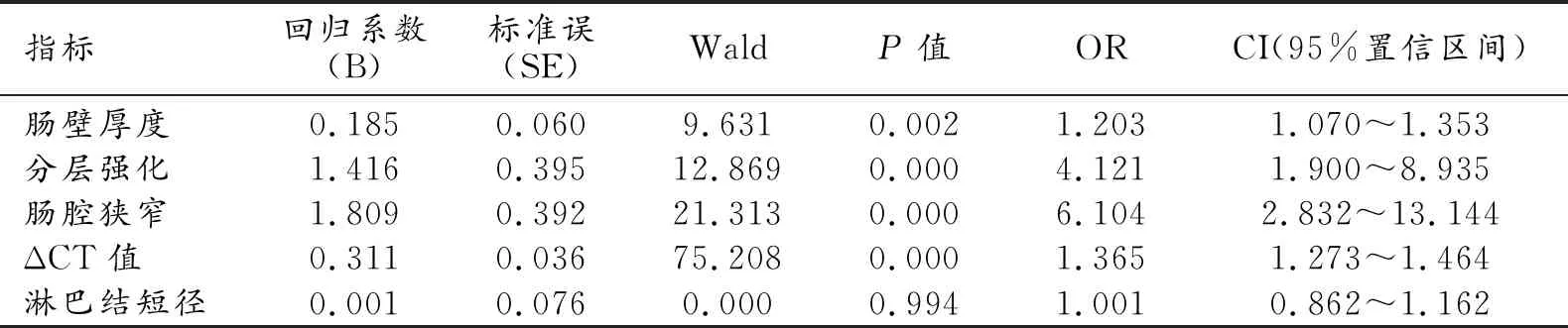
表3 多元有序Logistic回归模型分析结果
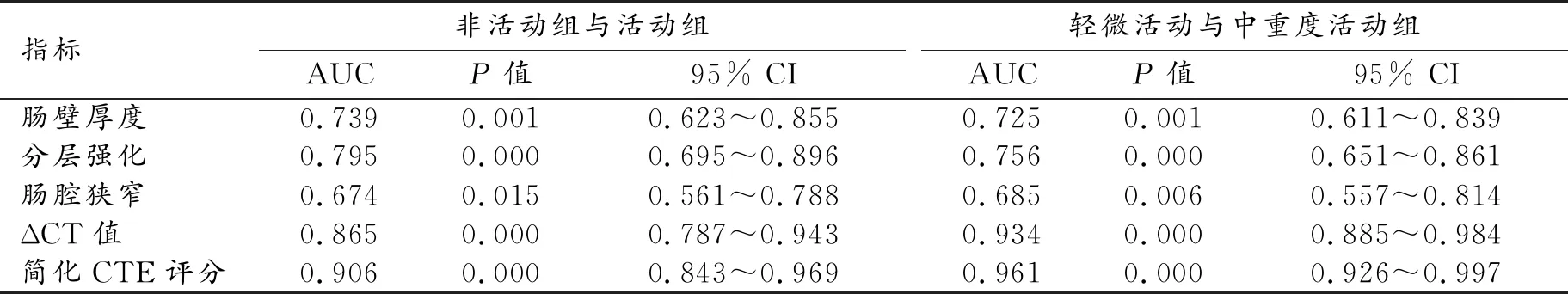
表4 CTE多个指标预测CD活动性的ROC曲线分析结果
讨 论
1.CTE征象在CD活动性评估中的价值
本研究结果显示,肠壁厚度、ΔCT值、肠壁分层强化与SES-CD均呈中度相关,这与以往研究结果一致[12]。CD活动期往往会出现肠壁增厚、分层及黏膜高度强化,其中肠系膜侧肠壁偏心性增厚和明显强化是CD的特征。肠壁分层强化的病理基础为黏膜、浆膜层的充血和黏膜下的水肿或脂肪沉积,增强时在CTE图像上黏膜层、浆膜层表现为高密度,而中间的黏膜下层呈低密度,即分层强化。对于那些病程太长和透壁纤维化的患者,肠壁的分层改变会消失,而且在CT扫描时病变肠壁的密度通常均匀降低。肠壁分层及明显强化可能表明透壁纤维化尚未发生,并且被认为与疾病的临床活动性相关[13,14]。
Bodily等[13]的研究表明,肠壁高强化与组织学炎症相关,是反映CD活动性最敏感的指标。本研究中,ΔCT值在模型中的作用最为显著,这可能提示ΔCT值可作为CD活动性评估的独立预测因子。Adler等[15]的研究表明,CD的肠腔狭窄既可以是炎性水肿引起,也可以由肠壁纤维化所致,仅靠CTE很难鉴别两者,同时肠腔的明显狭窄经常与肠壁纤维化相关,这可以解释为什么在本研究中肠腔狭窄与SES-CD仅呈轻度相关。
CD是透壁性炎症,肠壁炎症可以延伸到邻近的周围脂肪及小肠肠系膜组织中。肠壁炎症的渗透会导致肠周脂肪密度的增加,即肠系膜纤维脂肪增殖,而“梳征”是肠系膜炎症所致充血直小血管的一个表现,它们均与CRP升高相关[16,17]。CT增强扫描时,当出现肠系膜血管增多伴管腔扩张、迂曲和广泛分布的直小血管时,就产生了“梳征”,它归因于病变部位肠系膜血流及纤维脂肪增殖的增加,所以在CD病变中“梳征”和肠系膜纤维脂肪增殖经常同时存在。相关研究表明,CD患者若在CT上出现“梳征”,表明病变在临床上处于活动期、进展期[18,19]。本研究结果显示,非活动组、轻微活动组、中重度活动组出现“梳征”的概率依次增高,但三组间的差异并无统计学意义。在我们的评估过程中发现,有44个非活动性肠段出现“梳征”表现,这可能是由于此处的肠系膜炎症尚未恢复,且其滞后于肠黏膜炎症的愈合;另外,有64个活动性肠段的炎症局限于肠黏膜或肠壁,肠周未见“梳征”表现。类似的情况也见于“肠系膜纤维脂肪增殖”,这表明黏膜炎症与肠系膜炎症并不一致。在此基础上,Colombel等[17]的研究表明,CRP仅与肠周炎症(如“梳征”、肠系膜脂肪密度的增加)显著相关,而与肠黏膜炎症无相关性,且与黏膜组织活检的炎症无关(r=0.08,P=0.49)。笔者判断CD活动性是以内镜评估为标准,而内镜只能反映病变肠黏膜的情况,并不能反映肠周的炎症。仅使用内镜作为参考标准可能会产生假阴性结果,因为当肠黏膜正常而CTE发现肠壁及肠系膜存在炎症时,若以内镜为标准,它将被归为假阳性[5]。这也许可以解释为什么本研究未发现三组在“梳征”及“肠系膜纤维脂肪增殖”上的差异。
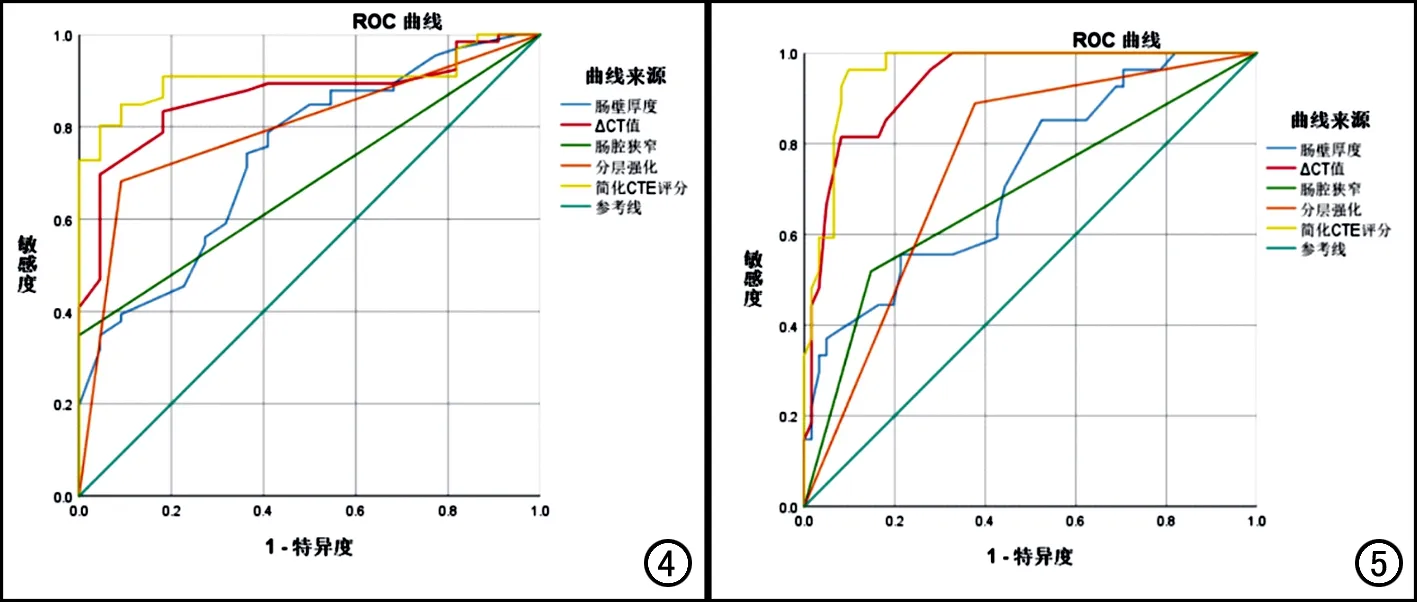
图4 各CTE指标及简化CTE评分鉴别CD活动组与非活动组的ROC曲线图。 图5 各CTE指标及简化CTE评分鉴别CD轻微活动组与中重度活动组的ROC曲线图。
2.CTE定量评分系统在CD活动性预测中的潜在价值
对CD病变的准确评估有利于患者管理,临床上主要结合临床症状、内镜检查及各种实验室化验指标综合评估CD活动性及严重程度。最常用的症状评分系统有克罗恩病活动指数(Crohn's Disease Activity Index,CDAI)[20],但其存在一定的主观性,并且临床症状常与肠道炎症水平并不相关,而实验室检查(如CRP或其他标志物的血清水平)也不是评估CD严重程度的充分指标[21];内镜检查是目前公认的评估CD病变的金标准,相应的评分系统如简化的克罗恩病内镜下活动性评分(SES-CD)[2]已经得到广泛认可,但内镜是一项侵入性检查,患者对其耐受性差,并且存在肠穿孔等风险。因此,各种替代检查方法如CTE、MRE等开始出现,与此同时,各种磁共振定量评分系统也相继出现,其中磁共振活动性指数(magnetic resonance index of activity,MaRIA)的应用最为广泛[22]。
然而,到目前为止大部分CTE的研究都只是基于CTE的半定量评分,因此本研究第一次尝试使用多分类有序logistic回归模型建立了一个CTE定量评分系统,并且它与内镜评分高度相关,基于ROC曲线分析,CTE定量评分系统具有预测CD活动性及严重程度的潜在能力。本研究结果显示CTE定量评分系统能更好地区分轻微活动组与中重度活动组,当CTE评分截值点为16.5时,敏感度(96.3%)和特异度(90.2%)均很高,这可能是由于随着炎症程度的增加,CTE征象更容易识别。
3.本研究的局限性
首先,本研究是一项单中心回顾性研究,且CTE定量评分系统并未对肠腔狭窄和肠壁分层强化进行分级量化,因此仍需多中心、大样本的研究对此评分系统进行修正、改进;其次,纳入患者有不同的病程并且可能接受了不同种类的药物治疗,导致某些CTE征象无法呈现,从而在一定程度上影响了分析结果;再次,采用内镜作为金标准会造成一定程度的假阴性情况,在未来的研究中,若采用内镜下活检病理作为炎症活动性标准,可让模型具有更高的可靠性;最后,尽管CTE检查有其独特的优势,但仍有潜在的电离辐射风险,尤其对于年轻患者,因此不适合患者的长期随访。
综上所述,CTE定量评分系统为准确评估CD病变提供了定量基础,该评分系统有望用于CD活动性及严重程度评估,从而指导临床治疗、评估预后。

