胰腺实性假乳头状肿瘤的影像特征分析
龚毅,汪晓红,张盛箭,王葳,信超
胰腺实性假乳头状瘤(solid pseudopapillary tumor of the pancreas,SPTP)是一种少见的、发病机制不明确的低度恶性肿瘤,其遗传特征是在WNT号通路中激活β-连环蛋白及其靶基因。据文献报道SPTP在亚裔及非裔群体中发病率较高[1-3],年轻女性多见(男女比约为1:10)[1,2],临床多表现为腹部隐痛、不适或无症状且实验室检查无特殊,病灶发现时往往较大[1-5],但根据笔者观察发现小肿块、较大年龄及男性患者并不少见。本文回顾性分析经手术病理证实的56例SPTP患者的临床、病理、CT及MRI表现,旨在提高对本病的认识。
材料与方法
1.病例资料
搜集上海复旦大学附属肿瘤医院2013年8月-2018年8月间所有经手术切除后病理证实的SPTP患者,共计56例,回顾性分析其临床表现、影像学特征及病理结果。56例患者中男19例,女37例,就诊时的平均年龄为(36.3±1.53)岁(15~60岁),3例患者年龄<20岁,31例患者年龄为20~40岁,22例患者年龄>40岁。主诉为无症状(30例)、腹部隐痛不适(18例)或可触及肿块(8例)。56例患者中20例同时进行了CT和MRI检查,35例只进行了CT检查,1例只进行了MRI检查,9例患者另外还进行了内镜超声及细针穿刺活检。所有患者实验室检查均无明显异常。
2.检查方法
55例患者采用Siemens Somatom Sensation-40或Philips Brilliance 64 Slice CT扫描仪行上腹部CT扫描,扫描前禁食8 h,口服清水500~800 mL。扫描参数:管电压120 kV,常规扫描层厚3 mm,重建层厚0.60~1.25 mm。平扫完成后分别于注射对比剂后35 s、70 s行动脉期、门脉期增强扫描。CT增强扫描采用高压注射器经肘静脉注入非离子型对比剂(优维显或欧乃派克,浓度300 mg I/mL),流率3 mL/s,总量95~100 mL。
21例患者采用GE Signa 1.5T/3.0T超导磁共振扫描仪行MRI检查,体部表面相控阵线圈;扫描序列包括轴面同反相位T1WI及T2WI、抑脂T2WI序列、DWI、冠状面T2WI平扫,其中轴面T1WI及T2WI层厚为5 mm,层间距为2 mm;MRI增强扫描经肘静脉注入对比剂马根维显,流率1.5 mL/s,剂量15 mL,以20 mL生理盐水封管,行抑脂T1WI增强三期扫描。
3.图像分析
56例患者的图像均由2位影像诊断医师进行回顾性阅片分析评估,总结分析病变的形态学特征,包括肿瘤的部位、形态、最大径、肿块性质(实性、囊性或囊实性肿块)、密度或信号特点、有无内出血及钙化、胰管扩张及强化方式。若2位医师的意见不一致,则由第3位高年资副主任医师进行评判及诊断。据笔者观察发现,小肿块并不少见且影像学特征不同于较大肿块,为此,以最大径3 cm为标准[4,6],将SPTP分为大病灶(最大径>3 cm)和小病灶(最大径≤3 cm)进行比较分析。
4.统计学分析
采用SPSS 19.0软件进行统计学分析,组间比较采用独立样本t检验、卡方检验及方差分析。以P<0.05为差异有统计学意义。
结 果
56例肿瘤的平均最大径为(4.19±0.34) cm(0.9~14.5 cm),其中35例为大病灶(最大径>3.0 cm),21例为小病灶(最大径≤3.0 cm);大病灶与小病灶SPTP在病灶分布、形态、性质及有无钙化上差异有统计学意义(P<0.05,表1)。
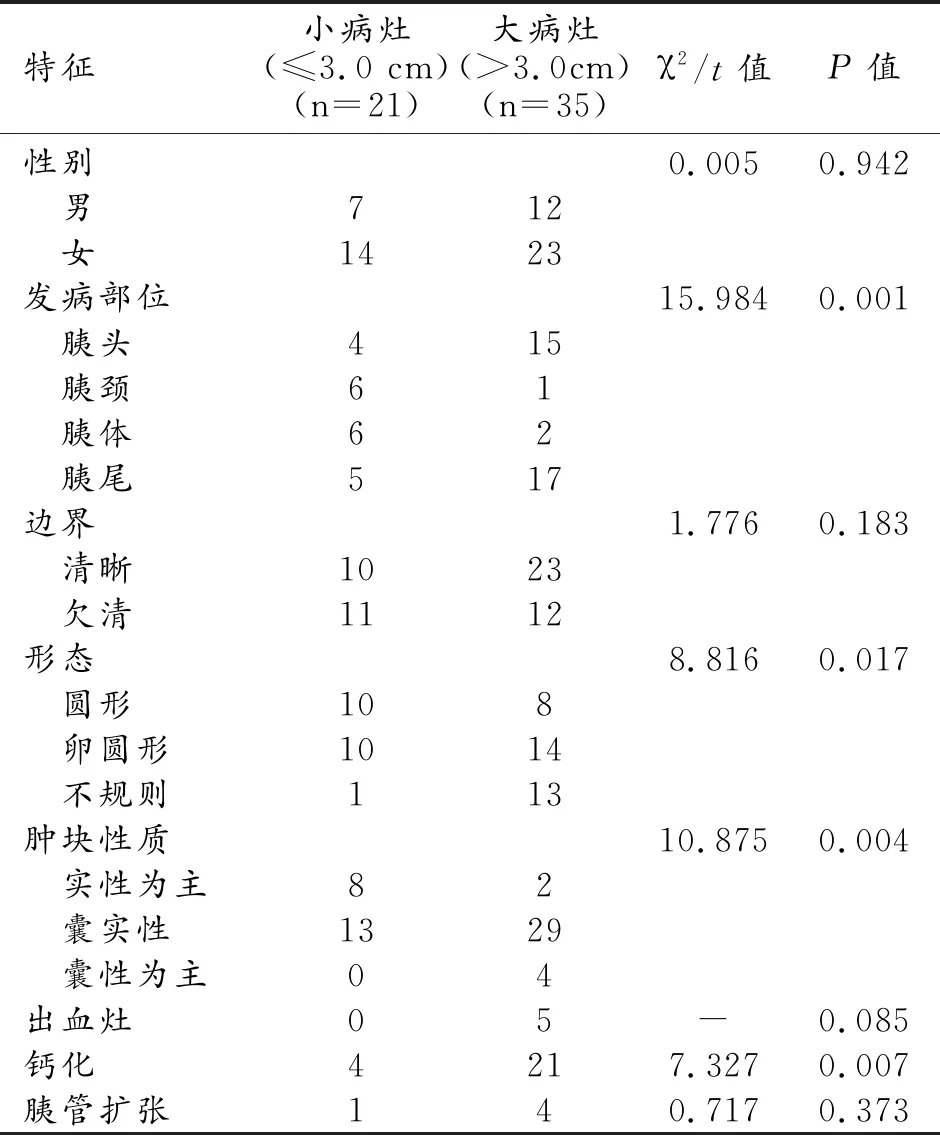
表1 大病灶与小病灶SPTP的特征比较 (例)
行CT平扫的55例患者中,14例肿块密度较均匀(图1、2),41例肿块密度不均匀(图3);行MRI平扫的21例患者中,4例信号均匀,17例信号不均匀(图4a~c)。CT/MRI动态增强扫描9例肿瘤实性部分呈较均匀持续强化(图1b、c,2b、c),34例肿瘤实性部分呈不均匀持续强化(图4d~f);4例囊性肿块中,1例可见强化壁结节,其余3例强化不明显(图3b、c)。大病灶与小病灶SPTP在MRI信号及强化形式上差异有统计学意义(P<0.05,表2)。

图1 SPTP患者,男,32岁,胰颈体部占位性病变。a) 轴面CT平扫示胰颈体部圆形实性肿块(箭),最大径约2cm,密度均匀,边界显示不明显; b) 轴面CT增强扫描动脉期示肿块(箭)呈轻度均匀强化,强化程度较周围胰腺稍低,边界较CT平扫清楚; c) 轴面CT增强扫描门静脉期示肿块(箭)呈持续强化。 图2 SPTP患者,男,31岁,胰体尾部占位性病变。a) 轴面CT平扫示胰体尾部椭圆形实性肿块(箭),最大径约2.3cm,密度均匀,边界欠清; b) 轴面CT增强扫描动脉期示肿块(箭)呈轻度均匀强化,强化程度较周围胰腺稍低; c) 轴面CT增强扫描门静脉期示肿块(箭)呈持续强化。 图3 SPTP患者,女,54岁,胰尾部囊性占位性病变。a) 轴面CT平扫示胰尾部类圆形囊性肿块(箭),最大径约4cm,呈均匀低密度影,边界较清,囊壁可见钙化;b) 轴面CT增强扫描动脉期示囊性肿块(箭)未见明显强化;c) 轴面CT增强扫描门静脉期示囊性肿块(箭)亦未见明显强化,边界较前清楚。
男性、女性SPTP患者在肿瘤部位、大小及发病年龄上差异均无统计学意义(P>0.05,表3)。
讨 论
1.SPTP的临床及病理
SPTP在胰腺各部位均可发生,文献报道成人中以胰尾部最为多见,其次是胰头部和胰体部[4,5],这与本研究结果是一致的;儿童最常见的发病部位则是胰头部。小病灶肿瘤常见于胰颈部及体部,笔者认为可能与这些部位的肿瘤容易引起腹部症状而常于起病早期进行影像学检查有关。SPTP组织起源尚不明确,目前关于SPTP的起源有两种基本理论:一种认为SPTP来源于胰腺干细胞;另一种因其流行病学特点认为其来源于女性生殖脊细胞。相关文献报道,通过显微镜分析有两种类型的细胞排列,即实性和乳头状[7-9]。另有研究报道,肿瘤开始为实性肿块,肿块内的肿瘤血管发育异常,随着肿瘤的生长、增大,导致远离肿瘤血管的组织常由于得不到足够的营养而发生囊变坏死、出血和钙化等退行性改变[9,10]。
表2 SPTP的密度/信号特征及强化方式比较 (例)

特征小肿瘤(≤3.0 cm)(n=21)大肿瘤(>3.0cm)(n=35)χ2/t值P值CT平扫密度2.8610.091 均匀86 不均匀1328MR平扫信号0.028 均匀31 不均匀215强化方式8.6360.013 较均匀持续强化72 不均匀持续强化1430 无明显强化03
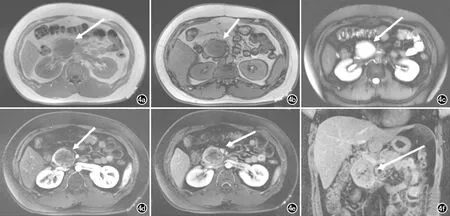
图4 SPTP患者,男,20岁,胰头占位性病变。a) 同相位T1WI示胰头部圆形肿块(箭),最大径约4.8cm,呈不均匀稍低信号; b) 反相位T1WI示肿块(箭)信号无明显变化,边界较同相位T1WI清楚; c) T2WI脂肪抑制序列示肿块(箭)呈混杂等高信号,边界较清; d) 轴面T1WI增强动脉期示肿块(箭)实性部分呈轻度不均匀强化,囊性部分未见明显强化,边界较平扫清楚; e) 轴面T1WI增强门静脉期示肿块(箭)实性部分持续强化,囊性部分仍未见强化; f) 冠状面T1WI增强扫描延迟期示肿块(箭)实性部分持续强化,囊性部分未见强化,肿块边界不如动脉期显示清楚。
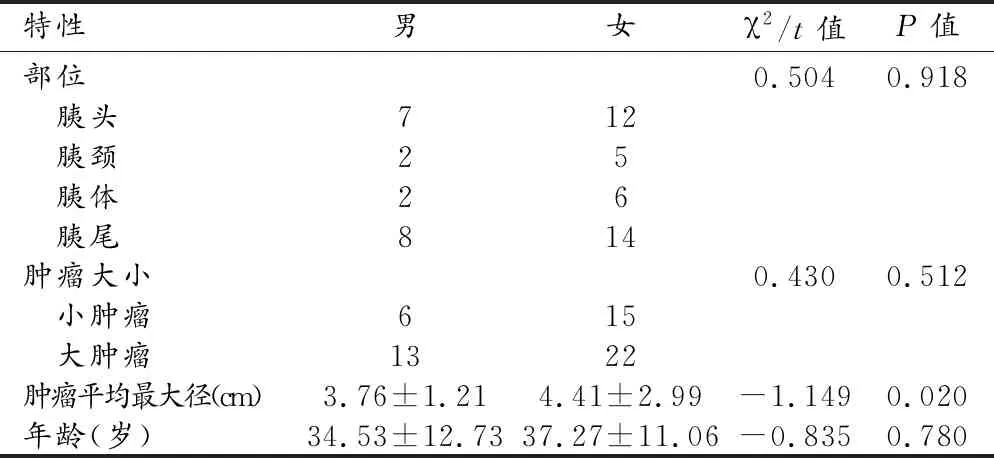
特性男女χ2/t值P值部位0.5040.918 胰头712 胰颈25 胰体26 胰尾814肿瘤大小0.4300.512 小肿瘤615 大肿瘤1322肿瘤平均最大径(cm)3.76±1.214.41±2.99-1.1490.020年龄(岁)34.53±12.7337.27±11.06-0.8350.780
SPTP的免疫组化具有特征性并且显示出对α-1抗胰蛋白酶、孕酮受体、波形蛋白和神经元特异性烯醇化酶的阳性反应[5,9]。肿瘤大小与恶性潜能之间的相关性存在争议,血管侵袭、高度核异型、高有丝分裂计数和大型坏死簇的存在被认为具有高恶性潜能。由于SPTP很少具有侵袭性,具有低度恶性潜能并且在完全切除后具有良好的预后,因此应该区别于其他更具侵袭性的肿瘤,如腺癌和内分泌肿瘤[8,11,12]。SPTP转移病例仅占所有病例的5%~15%,常见侵犯部位包括肝脏、门脉系统及脾等[12,13]。
2.SPTP的影像学表现
相关研究发现,SPTP肿块较小(≤3.0 cm)时,通常表现为实性肿块,较少出现出血、囊变及钙化等继发性改变;随着SPTP肿块的逐渐增大(>3.0 cm),肿块内的囊性坏死成分逐渐增多形成比较明显的囊实性肿块,少数为完全囊性肿块[4,6]。多数SPTP不会出现胰胆管扩张或胰腺实质萎缩,这与肿瘤生长缓慢、发病时间较长有关。较大肿瘤可出现明显的外生性表现,其对周围组织器官呈推移挤压改变而没有明显侵犯表现,均与恶性肿瘤的表现不一样[12-14]。超声通常表现为边界清楚的低回声实性肿块、囊实性肿块或囊性包块,可合并强回声后伴声影的钙化灶或不均匀稍强回声的出血灶,边界通常较为清楚[15]。CT比较容易发现肿瘤钙化和急性出血的存在;而与CT相比,MRI在很多方面有优势,如发现不同时期的出血灶,包膜的存在及分析囊液成分等。T1WI在出血区域中可观察到高信号区域,包膜通常表现为薄的低信号边界,MRI还可提供有关肿瘤可切除性的信息,这对于患者治疗方式的选择非常重要[4,6,7]。有研究显示,包膜的局灶性不连续,肿瘤大小(>6.0 cm)和病灶位于胰尾位置可能表明SPTP的潜在恶性;具有多发散在钙化的实性肿瘤则可能是偏良性的[12,13]。
对于较大肿块,多表现为囊实性,其CT、MRI表现也最具特征性。CT平扫呈等低密度肿块,有时可见钙化及出血灶;MRI平扫实性成分呈稍长T1、稍长T2信号影,其内可出现低信号的钙化和信号不同的出血灶,囊性区由于囊液成分的不同而可表现出不同的信号强度。CT/MRI动态增强扫描肿瘤实性成分呈渐进性强化,强化程度低于正常胰腺组织,瘤体与胰腺交界处可出现“杯口征”改变。囊性肿块中的实性成分通常呈壁结节改变,可出现乳头状突起或典型“云絮样”改变。当SPTP表现为完全囊性肿块时,CT/MRI特征可呈现囊肿改变,边界清楚,囊液密度或信号均匀,囊壁可以无强化或呈轻度强化,囊壁有时可见钙化[4,7,12]。
实性肿块在较小的SPTP中更为多见,其CT/MRI表现并不如囊实性肿块那么典型。由于较少出现钙化、出血及囊变等改变,所以CT平扫通常呈均匀稍低密度,与正常胰腺组织分界不清;MRI平扫通常表现为边界清楚的均匀稍长T1、稍长T2实性肿块,DWI扩散受限。CT/MRI动态增强扫描表现为较均匀的渐进性强化,其强化程度明显低于正常胰腺组织,在周围组织的衬托下肿块的形态较平时显示清楚[4,6,7,12]。
本研究发现SPTP的大小与边界清晰与否无明显相关性,笔者认为这可能有两方面原因,首先,小肿瘤实性成分较多,部分病灶CT平扫密度与周围组织相差不大、对比不明显而造成边界显示不清,而MRI的信号特点可以使小肿瘤得以更好地显示;大肿瘤多出现囊变坏死,肿瘤与周围组织对比明显而边界显示清晰。另一方面,部分潜在恶性的大肿瘤生长较快具有一定侵袭性时,亦可对周围组织浸润造成边界显示欠清。
3.鉴别诊断
SPTP需与其他胰腺肿瘤,如胰腺癌、神经内分泌肿瘤、浆液性囊腺瘤及黏液性囊腺癌等鉴别,有时还需与胰腺假性囊肿等良性病变相鉴别[3,6]。一般来说,囊实性SPTP的影像表现比较典型,鉴别诊断相对简单:患者为年轻女性,没有特异性的临床症状及实验室检查异常,影像学检查表现为胰腺边界清楚的囊实性肿块且实性部分呈渐进性强化,要首先考虑SPTP的可能。如果肿块表现为比较典型的影像学征象,即使不是SPTP的好发年龄或性别,也要考虑到SPTP的可能[13,14]。较小的实性肿块平扫密度/信号较为均匀,动态增强扫描呈较均匀或欠均匀的渐进性强化且强化程度较正常胰腺组织稍低时,也要考虑SPTP的可能[4,6]。仍有少数SPTP的影像学表现并不典型,此时需结合临床其他相关检查进行综合判断,必要时可考虑通过超声内镜进行病理穿刺活检[15]。
综上所述,SPTP的影像学表现具有一定的特征性,而大病灶与小病灶SPTP的影像学特征有所不同,肿瘤在发病年龄、部位及大小方面没有显著的性别差异。当胰腺肿瘤表现出典型的SPTP影像学征象,即使并非SPTP的好发年龄、性别,仍需考虑或排除本病的可能。

