微小肝细胞癌(≤1 cm)的钆塞酸二钠增强MRI表现分析
杨丽, 曾蒙苏, 饶圣祥, 杨春, 丁莺, 陈财忠
肝细胞癌(hepatocellular carcinoma,HCC)发病率及致死率较高,早期诊断、及时干预对于提高患者的生存率具有重要意义。微小HCC(≤1 cm)起病隐匿,肿瘤标志物可呈阴性表现,因此在临床工作中容易误诊。动脉期高强化、非周边廓清和强化包膜为HCC的主要MRI征象[1]。然而HCC体积越小,其影像学表现往往越不典型[2]。近年来,肝胆特异性磁共振对比剂钆塞酸二钠的临床应用日益广泛,其在微小HCC的检出和定性诊断方面的优势逐渐凸显[3,4]。本研究回顾性分析经病理证实的113例微小HCC患者(125个HCC病灶)的钆塞酸二钠增强MRI表现,旨在提高对微小HCC影像表现的认识,提高微小HCC的检出率及确诊率。
材料与方法
1.病例资料
回顾性分析2012年3月-2018年12月于复旦大学附属中山医院肝外科行肝切除术患者的临床、病理与影像学资料。病例纳入标准:①术前行钆塞酸二钠增强MRI检查;②经手术病理证实为HCC;③所有病灶直径≤ 1cm;④手术前未行介入治疗。病例排除标准:MR图像质量不佳,不能用于分析者。本研究共纳入113例患者(125个HCC病灶),其中男101例,女12例,年龄30~81岁,平均年龄(52.4±5.5)岁。113例患者中107 例为乙型病毒性肝炎,1例为酒精性肝病,其余5例病因不明;53例甲胎蛋白>20 ng/mL,15例甲胎蛋白>200 ng/mL。经病理证实82例病灶周围肝实质存在肝硬化,43例无肝硬化。125个HCC中,术前3个误诊为不典型增生结节,1个误诊为再生结节,其余均正确诊断为HCC;术后病理示Ⅰ~Ⅱ级87个,Ⅲ~Ⅳ级38个。
2.检查方法
所有患者均采用德国西门子Magnetom Aera 1.5T磁共振扫描仪及相控阵体线圈和脊柱线圈行MRI检查和图像采集。患者检查前空腹4~6 h,严格训练屏气。先行冠状面上腹部T2WI真实稳态进动快速成像,以此为参照,以肝脏为中心依次进行如下序列横轴面扫描:①自由呼吸单次激发平面回波DWI,TR 5100 ms,TE 55 ms,b值为0、500 s/mm2,层厚6 mm,矩阵192×120;②屏气正反相位梯度回波T1WI,TR 6.88 ms,TE 2.39 ms/4.77 ms,层厚3.5 mm,矩阵320×165;③屏气脂肪抑制三维容积内插屏气检查序列T1WI平扫和增强三期扫描,TR 3.47 ms,TE 1.36 ms,层厚3 mm,矩阵320×195;④呼吸触发快速自旋回波脂肪抑制T2WI,TR 3074~5449 ms(随呼吸频率变化),TE 106 ms,层厚5.5 mm,矩阵384×205;⑤肝胆特异期T1WI,参数同T1WI平扫。平扫完成后,经肘静脉注射钆塞酸二钠(德国拜耳先灵公司生产),流率1 mL/s,剂量0.025 mmol/kg,注射完毕后以20 mL生理盐水进行冲洗。注入对比剂后60~70 s、150~180 s及20 min分别采集门脉期、过渡期及肝胆特异期图像,采用Care Bolus自动触发采集动脉期图像(对比剂到达升主动脉时触发)。
3.图像分析
由2位高年资放射科医生共同分析肿瘤的以下表现:①于横轴面肝胆特异期图像上测量微小HCC的最大径;②DWI(b=500 s/mm2)、T2WI、增强前T1WI、动脉期、门脉期、过渡期及肝胆特异期图像上HCC的信号强度,以周围背景肝实质为参照,分为高信号、等信号与低信号;若病灶于增强前T1WI为低信号,动脉期呈高信号,则判定为高强化;若病灶于增强前T1WI呈高信号,则将T1WI与动脉期相同层面的图像进行减影后再评价动脉期是否强化;③病灶内含有脂质,即与正相位比较,反相位图像上病灶信号强度减低;④强化包膜,即门脉期或过渡期肿瘤周边可见强化的包膜样结构;⑤动态增强方式。“快进快出”,即病灶动脉期高强化,门脉期对比剂廓清呈低信号;“快进慢出”,即病灶动脉期高强化,门脉期呈等或高信号,过渡期为低信号;相对乏血供,即动脉期呈等或低信号,门脉期呈等或低信号,过渡期呈低信号;持续强化,即病灶动脉期呈等、低或高信号,门脉期及过渡期呈等或高信号。两位阅片者意见不一致时由两人协商达成一致意见。
4.统计学分析
采用Medcalc 18.2.1软件进行统计分析。计数资料采用频数与百分比来表示,定量资料采用均值±标准差表示。采用McNemar检验比较不同MR序列对微小HCC的检出率。以P<0.05为差异有统计学意义。
结 果
1.微小HCC的MRI信号特征
125个微小HCC的MR信号特征见表1。125个微小HCC中,多数病灶不含脂质(94/125,75.2%),少数病灶内含脂质(31/125,24.8%);动脉期以高强化为主(102/125,81.6%),少数可呈等信号(15/125,12%)或低信号(8/125,6.4%);门脉期或过渡期多可见强化包膜(80/125,64%),少数无强化包膜(45/125,36%)。动态增强约半数呈典型“快进快出”(67/125,53.6%;图1),其余病灶呈“快进慢出”(25/125,20.0%)、相对乏血供(21/125,16.8%;图2)或持续强化(12/125,9.6%;图3)。125个病灶中61个(61/125,48.8%)各序列均呈典型表现,即DWI与T2WI呈高信号,T1WI呈低信号,动脉期高强化、门脉期为低信号(“快进快出”强化),过渡期与肝胆特异期为低信号;64个(64/125,51.2%)病灶在一个或多个序列中表现不典型(图4)。
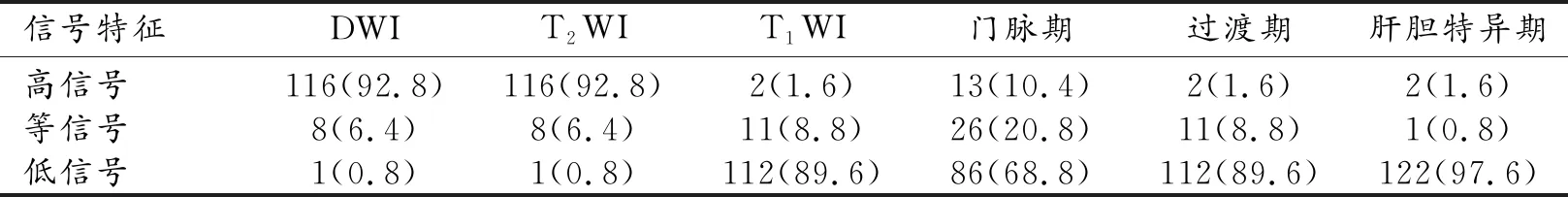
表1 125个微小HCC 的MR信号特征 (n,%)
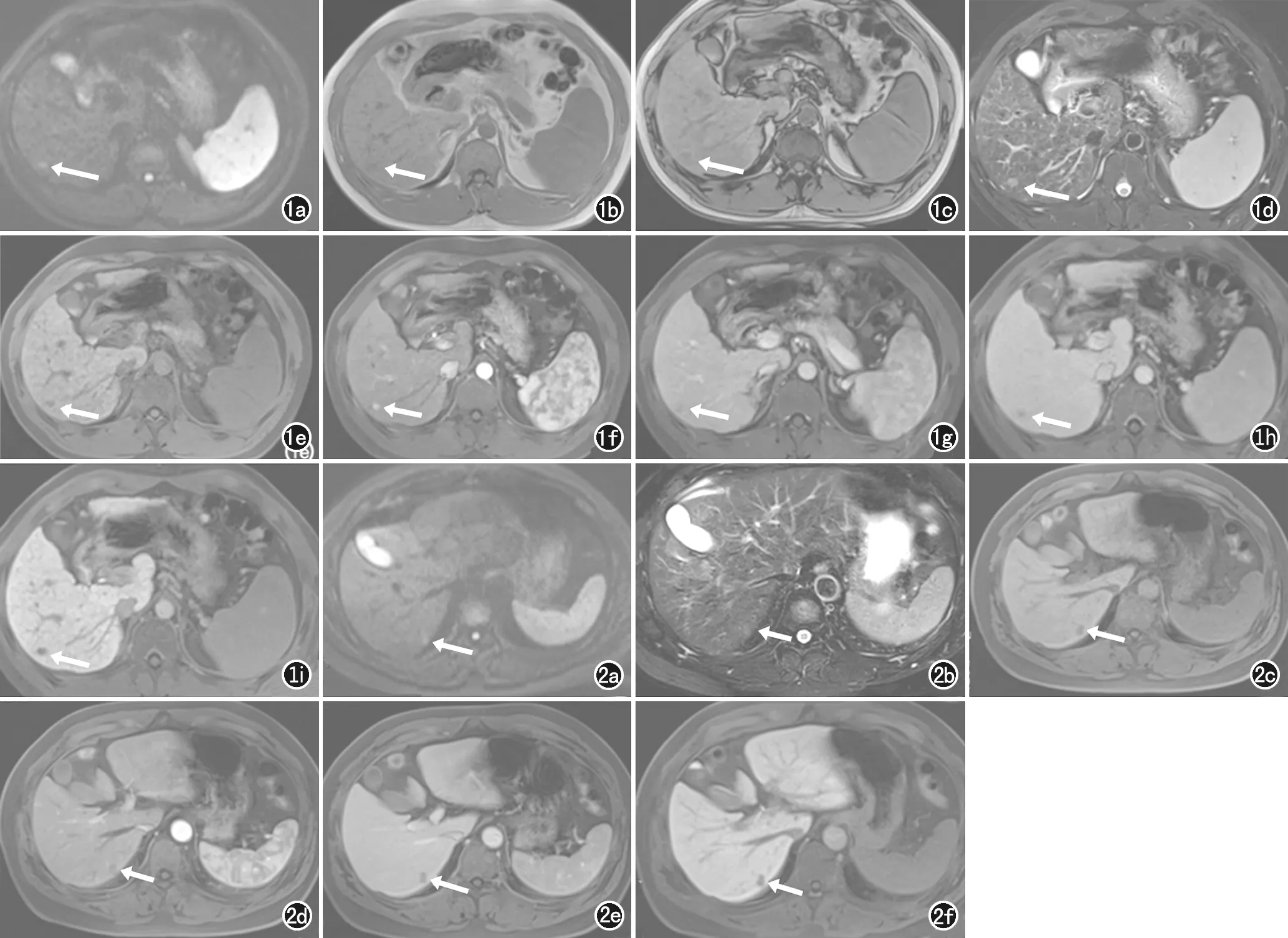
d) T2WI上病灶呈高信号(箭); e) 增强前抑脂T1WI病灶呈低信号(箭); f) 钆塞酸二钠增强动脉期病灶呈高强化(箭); g) 门脉期病灶呈低信号(箭); h) 过渡期病灶呈低信号(箭); i) 肝胆特异期病灶为低信号(箭)。 图2 微小HCC患者同一层面的MRI轴面图像。a) 病灶位于肝S6段,DWI呈高信号(箭); b) T2WI上病灶呈稍高信号(箭); c) 增强前抑脂T1WI病灶呈低信号(箭); d) 钆塞酸二钠增强动脉期病灶呈低信号(箭); e) 门脉期病灶呈低信号(箭); f) 肝胆特异期病灶为低信号(箭)。
图1微小HCC患者同一层面的MRI轴面图像。a) 病灶位于肝S6段,DWI呈高信号(箭); b) T1WI正相位病灶呈低信号(箭); c) T1WI反相位病灶呈低信号(箭);
2.钆塞酸二钠增强MRI各序列对微小HCC检出率的比较
113例患者的125个微小HCC中,101例为单发,12例有2个病灶。病灶最大径为0.4~1.0 cm;最大径平均值为(0.84±0.14) cm。就微小HCC的检出率而言(以HCC典型表现为标准),DWI优于动脉期(92.8% vs 81.6%;χ2=6.50,P<0.01)、门脉期(92.8% vs 68.8%;χ2=22.13,P<0.01)以及“快进快出”强化(92.8% vs 53.6%;χ2=47.08,P<0.01);T2WI优于动脉期(92.8% vs 81.6%;χ2=7.04,P<0.01)、门脉期(92.8% vs 68.8%;χ2=22.13,P<0.01)以及“快进快出”强化(92.8% vs 53.6%;χ2=49.00,P<0.01);动脉期优于门脉期(81.6% vs 68.8%;χ2=4.74,P=0.04)与“快进快出”强化(81.6% vs 53.6%;χ2=33.03,P<0.01);过渡期优于门脉期(89.6% vs 68.8%;χ2=21.81,P<0.01)与“快进快出”强化(89.6% vs 53.6%;χ2=42.32,P<0.01);肝胆特异期优于T1WI(97.6% vs 89.6%;χ2=5.79,P=0.01)、动脉期(97.6% vs 81.6%;χ2=13.88,P<0.01)、门脉期(97.6% vs 68.8%;χ2=32.40,P<0.01)、过渡期(97.6% vs 89.6%;χ2=7.11,P<0.01)以及“快进快出”强化(97.6% vs 53.6%;χ2=51.27,P<0.01)。DWI联合“快进快出”强化优于动态增强“快进快出”强化(92.8% vs 53.6%;χ2=47.08,P<0.01);肝胆特异期联合“快进快出”强化优于动态增强“快进快出”强化(99.2% vs 53.6%;χ2=57.00,P<0.01);肝胆特异期联合“快进快出”强化优于DWI联合“快进快出”强化(99.2% vs 92.8%;χ2=4.90,P<0.01)。
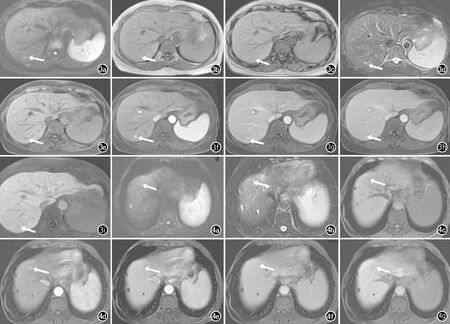
图3 微小HCC患者同一层面的MRI轴面图像。a)病灶位于肝S7段,DWI呈高信号(箭);b)T1WI正相位病灶呈稍低信号(箭);c)T1WI反相位较正相位病灶信号减低,提示病灶内含脂质(箭);d)T2WI病灶呈高信号(箭);e) 增强前抑脂T1WI病灶呈低信号(箭);f) 钆塞酸二钠增强动脉期病灶呈高强化(箭);g) 门脉期病灶呈高信号(箭);h)过渡期病灶呈等信号(箭);i)肝胆特异期病灶为低信号(箭)。 图4 微小HCC患者同一层面的MRI轴面图像。a)病灶位于肝S8段, DWI呈等信号(箭);b)T2WI上病灶呈低信号(箭);c) 增强前抑脂T1WI病灶呈等信号(箭);d) 钆塞酸二钠增强动脉期病灶呈高强化(箭);e) 门脉期病灶呈稍高信号(箭);f)过渡期病灶呈等信号(箭);g)肝胆特异期病灶为低信号(箭)。
讨 论
1.钆塞酸二钠增强MRI在微小肝癌诊断方面的优势
大多数HCC发生于慢性肝炎肝硬化背景下,经历了由再生结节、低度异型增生结节、高度异型增生结节到HCC的多步发展的癌变过程[5]。研究表明HCC越小,其微血管浸润的发生率越低,而微血管浸润与HCC的预后密切相关。因此,早期诊断和治疗HCC对于降低HCC术后复发率与提高患者的生存率至关重要。微小HCC患者血清甲胎蛋白的诊断敏感性往往不高,因此影像学检查对于微小HCC的诊断显得尤为重要。肝胆特异性对比剂钆塞酸二钠的广泛应用,使得微小HCC的检出率和确诊率显著提高[3,4]。一方面,钆塞酸二钠增强MRI可以提供类似Gd-DTPA的动态增强图像;另一方面,约有50%的钆塞酸二钠经肝窦面肝细胞膜上的有机阴离子转运多肽8(Organic Anion Transporter 8,OATP8)吸收至肝细胞内,再由胆道面上多重耐药蛋白2排泄至胆系,静脉注射钆塞酸二钠后约20 min(即肝胆特异期),功能正常的肝实质最大程度地摄取钆塞酸二钠表现为高信号,而在肝硬化结节多步癌变过程中,肝细胞膜上的OATP8表达逐渐减少[6]。据文献报道,约有90%的微小HCC不摄取钆塞酸二钠,肝胆特异期呈低信号改变,这与周围可摄取钆塞酸二钠的正常肝实质或硬化结节的等、高信号形成鲜明对比,因此有利于微小HCC的检出。本研究亦证实肝胆特异期与T1WI、动脉期、门脉期及过渡期相比,对微小HCC的检出率更高。
2.微小HCC的MR诊断
根据2018版肝脏影像学报告及数据系统[7],动脉期高强化、非周边廓清和强化包膜为HCC的主要征象。Yu等[8]报道了72个小HCC(≤1 cm)中79%的病灶动脉期呈富血供,50%的病灶有门脉期对比剂廓清。Choi等[9]报道50%的小HCC(<1 cm)符合典型的动脉期强化伴门脉期对比剂廓清。本研究纳入的125个微小HCC中,81.6%表现为动脉期高强化,53.6%强化呈“快进快出”,与文献报道相仿。病理上,从肝硬化再生结节、增生结节逐步发展为HCC的过程中,病灶内的孤行动脉逐渐增多,动脉供血随之增加,而门静脉供血逐步减少,因此典型的HCC动态增强扫描表现为对比剂的“快进快出”。本研究中另有近半数的微小HCC动态强化表现不典型,20.0%呈“快进慢出”,16.8%呈相对乏血供,9.6%呈持续强化,这可能是由于微小HCC发生的初始阶段,门静脉血供仍然存在,肿瘤供血动脉形成较少所致[10]。Cho等[11]认为动脉期乏血供、肝胆特异期为低信号的结节中,42.7%的结节在随访中转变为动脉期富血供。Golfieri等[12]发现联合肝胆特异期低信号可以显著提高动脉期乏血供小HCC(≤2 cm)的诊断灵敏度。本研究中,虽然近半数微小HCC的强化方式不典型,但平扫T1WI上89.6%呈低信号,T2WI和DWI上92.8%呈高信号,97.6%肝胆特异期不摄取对比剂表现为低信号。因此对于强化不典型的微小病灶,结合其他MRI序列,尤其是肝胆特异期低信号这一特征,有助于HCC的诊断。
3.微小HCC的检出
本组125个微小HCC中,DWI上116个(92.8%)病灶呈高信号,动态增强仅有67个(53.6%)病灶呈“快进快出”强化,而动态增强联合DWI序列检出了116个(92.8%)微小HCC,较单纯应用“快进快出”强化显著提高了微小HCC的检出率,与相关文献报道一致[13]。DWI可以通过水分子扩散情况来反映组织微观结构与功能变化,对于微小HCC的早期发现与诊断具有重要价值。本组肝胆特异期呈等或高信号的3个病灶中,DWI均呈高信号,这亦提示联合DWI图像可以提高微小HCC的显示能力。本组另有9个(7.2%)病灶DWI呈等或低信号,这可能与HCC的分化程度及病灶内含有脂质成分有关;此时就需要联合动态增强及肝胆特异期来协助诊断。虽然本组病例中116个(92.8%)病灶T2WI呈高信号,但是T2WI采集时间较长,极易受患者呼吸和运动伪影的影响,进而降低了图像质量与诊断信心。本组病例中122个(97.6%)病灶肝胆特异期呈低信号,肝胆特异期联合“快进快出”强化检出124个(99.2%)微小HCC,这显著高于DWI联合“快进快出”强化对HCC的检出率,因此联合肝胆特异期更有利于微小HCC的检出。
本研究存在以下局限性:一方面,本研究为回顾性研究,患者的选择可能会存在偏倚;另一方面,本研究只包含微小HCC,未纳入肝脏其他微小病变(包括再生结节、低级别异型增生结节、高级别增生结节及其他良性病变等)进行鉴别。
综上所述,微小HCC 钆塞酸二钠增强MRI表现各异,各序列上可表现为高信号、等信号或低信号,动态增强强化方式常常不典型,其肝胆特异期结合DWI有助于微小HCC的诊断。

