胰腺癌影像学进展与思考
边云,陆建平
胰腺癌(pancreatic cancer,PC)是一种恶性度极高的肿瘤,医学界奋斗50年,5年生存率仍然不到6%。国家癌症中心的数据显示,我国每年PC病例数约占全部恶性肿瘤的2.42%,发病例数为1.89万[1]。预计到2030年,PC将成为恶性肿瘤中的第2位致死原因[1]。近年来随着肿瘤综合治疗理念的推进,PC不再是单纯的外科疾病,已上升为多学科联合攻关的重点疾病。由于PC的复杂顽固,诊治的热点与难点也争议不断。本文从PC影像诊断、TNM分期预测、可切除评价、新辅助疗效评价等四大方面,阐述当今作为多学科团队中的影像医生,所面临的机遇和挑战。
影像学诊断现状
PC的镜下特征是肿瘤细胞和大量间质纤维化混杂,比例无规则,绝对个性化[2],该病理学基础决定了PC基本上为“硬癌”。CT平扫肿瘤呈低密度,在T1WI上呈低信号,T2WI上呈略高信号。因肿瘤血管内有效血管面积不足,增强后表现为轻度或几乎无强化(图1)。PC大部分起源于导管上皮,因此,它另一个重要征象是容易累及胰管,出现上游胰管扩张(图2),有时甚至是早期诊断线索。然而,即使影像表现相似的PC在镜下也表达各异,例如:起源于背胰或腹胰的肿瘤位置的差异;肿瘤细胞可源于导管上皮也可源于腺泡细胞向导管分化的细胞;肿瘤细胞分化程度不一;肿瘤微血管密度、面积和热点区分布不同;肿瘤与炎症的比例和分布各异;肿瘤细胞和间质的比例和分布差异悬殊;间质内纤维结缔组织致密程度和排列不同等。PC的这些病理特征无疑与诊治疗效密切相关,但这些差异信息即使在影像上有所表达,仍缺少量化标准,也没有被充分挖掘。如何将影像学与镜下特征密切对应,建立能够细分PC亚型的量化指标,提出影像学的分型,是我们面临的挑战。
进展期PC的影像检出及诊断早已不是难题,但2 cm以下的小胰癌[3](定义:肿瘤直径≤2 cm,无论有否胰外浸润和淋巴转移)的发现和诊断仍然是医学界的难点,也是影响总体预后的重要原因。从正常上皮的基因突变到T1期的PC历时(11.7±3.1)年,从T1发展至T2期历时(6.8±3.4)年[4]。然而,多数患者首次就医确诊PC时已属T3或T4期,T1和T2期的比例只有5%左右。笔者所在单位的胰腺中心2016年9月至2019年7月病理确诊683例PC,T1和T2期所占比例分别为7.17%(49例)和29.43%(201例)。相关文献也报道,T1期占手术切除病例的2.95%,其中直径<1.0 cm的PC仅占全部手术切除病例的0.55%[5]。关于直径<1.0 cm PC的影像学文献仅为个案报道。这充分说明了当前的检出方法,如肿瘤标志物和超声检查,在PC早期诊断中价值非常有限。相关研究结果显示增强CT、EUS及EUS引导下细针穿刺活检(EUS-FNA)和ERCP等对PC高危人群进行筛查,EUS和ERCP的灵敏度和特异度虽然较高,但难以满足临床大规模筛查的需求[6]。目前发表的文献中关于影像学诊断早期PC的研究极少[7],因此,PC的早期检出是关键的关键,突破的路径可从如下方面着手:改进现有CT和MRI技术,进一步提高空间分辨率;采用能谱CT寻找微小密度差异病灶;对50岁以上人群进行基线影像筛查,并采用组学方法检出小病灶,诸多方面需要我们协同研究甚至是流调研究,以期找到一种智能、高效、经济、便捷的PC筛查手段,从而在PC诊治领域,影像能起到像早期肺癌、乳腺癌诊治中一样的重要作用。

表1 美国癌症研究联合会第七、八版肿瘤T分期比较
TNM分期
2018年AJCC第八版对PC的T分期较第七版做了较大改变[8],重点是T1期的细分(表1)。
影像上胰腺肿块大小与肿瘤的T分期密切相关,但是否能精准预测T分期?在临床实践中,影像上通常采用RECIST1.1肿瘤疗效评价标准的单径法测量肿瘤大小[9],该方法简单、误差小,可重复性高,且可客观评价放化疗前后的变化。但AJCC的T分期是基于离体后病理大体标本肿瘤最大径的测量,而影像T分期是基于在体断面图像的最大径测量,两者仍有一定差异(图3)。Kassardjian等[10]将CT、MRI、超声内镜(EUS)与大体病理上的病灶尺寸和T分期进行对比,发现影像测得的肿瘤直径均小于大体病理直径,影像T分期低估于病理分期。我院的研究表明CT与MRI在评估肿瘤直径方面较为一致(ICC=0.88),当直径大于30 mm时,两者测值均小于大体病理,平均小于大体病理最大径4.3 mm 和5.8 mm[11]。在我们所完成的大病理组织切片上,测得的肿瘤最大径与影像测值更为接近,其原因可能是PC周围的炎性反应等,使得病理标本上最大径均大于影像和镜下。因此,PC病灶在影像上、大体病理上及大组织切片镜下的最大径,究竟哪个指标更为精准并与患者预后分层相关,值得我们关注及进一步研究。
影像学诊断转移阳性淋巴结的标准为:短轴直径>10 mm,密度不均匀,不均匀强化,内部有坏死、融合,边缘模糊,累及周围脏器或血管。多数文献以淋巴结最短径或长短径比做为判断标准[12-15],当直径>10 mm时,特异度为88%,但漏诊率为81.2%,有许多较小转移淋巴结漏诊;若将淋巴结直径减小到>3 mm或长短径之比<2为阳性标准,虽然敏感度可达100%,几乎无漏诊,但误诊率也可高达100%[12]。我院对经病理证实的30例PC淋巴结转移患者分别进行CT和MRI回顾性研究,结果表明CT诊断阳性淋巴结53枚,准确率为84.1%(53/63)[16];而MRI分别采用ADC值和淋巴结最大短径进行诊断,ROC曲线下面积分别为为0.894和0.876,敏感度分别为85.2%和68.5%,特异度分别为85.2%和90.7%[17],磁共振DWI对胰腺癌淋巴结转移有较高的诊断价值。一项Meta分析结果表明CT评估淋巴结转移的汇总敏感度为25%,特异度为86%,阳性预测值为31%,阴性预测值为84%[18]。由于淋巴结转移与大小、肿瘤T分期均无明显相关性,且与炎性增生的淋巴结难以鉴别。因此,术前影像对阳性淋巴结检出和鉴别的难度,导致影像的N分期价值有限[19]。此外,病理对胰周淋巴结取材缺乏规范与标准,区域淋巴结无明确界定;影像诊断的阳性淋巴结很难与病理阳性淋巴结建立一一对应的联系,导致影像术前诊断、外科淋巴结清扫、病理结果三者之间脱节。目前有研究将影像组学运用于膀胱癌、直肠癌和胆管癌淋巴结预测,建立的组学预测模型对淋巴结转移预测的准确性均高于单纯的影像诊断[20-22]。影像组学预测模型的建立有望运用在PC淋巴结转移的预测中。
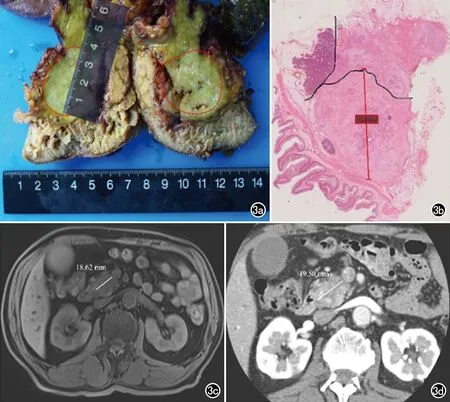
图3 胰腺癌不同测量方法比较。a)胰十二指肠标本,测得胰头部肿块最大径为31mm,T2;b)病理大组织切片测得胰腺肿块最大径为23.85mm(×20,HE),T2;c)横轴面脂肪抑制T1WI图像上测得的胰头部肿块最大径为18.62mm,影像预测为T1;d)横轴面动脉晚期CT图像测得的胰头部肿块直径为19.50mm,影像预测为T1。
PC在确诊时约有34%~50%的病例已发生肝转移,MSCT表现为单发或多发类圆形低密度灶,增强后呈环形强化。然而,仍有40%术前CT评价为可切除的PC,在术中发现肝脏和腹膜表面的微小转移灶,MSCT对这些微小转移灶的可视化程度低,易遗漏,从而导致部分M1分期误诊为M0分期。
由此可见,影像学在PC的TNM分期预测方面虽有一定价值,但在精准T分期、淋巴结转移、肝脏和腹膜微小转移评估等方面,仍有较多的问题有待研究解决。
PC手术可切除评价
PC手术可切除评价主要围绕肿瘤与其周围动静脉之间的关系进行评价,目前主流评价指南为美国国立综合癌症网络(NCCN)PC可切除评价标准,该标准将胰周动脉、静脉和胰头、体尾癌分别进行评价,并对肿块与血管接触以180°划分,再结合肿瘤的部位、接触的血管类型和接触角度分为可切除(resectable pancreatic cancer,RPC)、交界可切除(borderline resectable pancreatic cancer,BRPC)、不可切除局部进展期(1ocally advanced pancreatic cancer,LAPC)和转移性PC[23]。在可切除评价过程中,BRPC的定义最有争议,NCCN标准、美国MD安德森癌症中心(MDACC)标准、美国肝胰胆协会/美国肿瘤外科协会/消化道外科学会(AHPBA/SSAT/SSO)和肿瘤学临床试验联盟(alliance for clinical trials in oncology)4个指南之间的定义存在较大差异[24-26](表2)。AHPBA/SSAT/SSO指南将任何邻近肠系膜上静脉的肿瘤都定义为BRPC;而在NCCN指南中,即使肠系膜上静脉已经侵犯,只要能够切除重建,均定义为RPC。在我国胰腺手术高容量中心,PC联合门静脉和/或肠系膜上静脉切除重建技术已非常成熟,手术并发症发生率与病死率均较低,大部分患者可以获得R0切除,预后与未侵犯门静脉和/或肠系膜上静脉患者相当。因此,国内相关指南与共识在定义BRPC时主要参考NCCN指南。

图4 胰腺癌术前可切除评价。a)增强扫描门脉期CT图像示胰头部低密度软组织肿瘤(黄虚线),肿块与肠系膜上静脉(SMV)直接接触角度<180°,静脉无变形,影像判断为可切除;b)病理切片示肿瘤肠系膜上静脉切缘阳性,肿瘤距切缘距离为0.03mm(×20,HE);c)增强扫描动脉晚期CT图像示胰头部低密度软组织肿瘤(黄虚线),肿块与SMV直接接触角度>180°,SMV变形,影像判断为可能切除;d)病理切片示肿瘤肠系膜上静脉切缘阳性,肿瘤距切缘距离为0.12mm(×20,HE)。

表2 不同机构对临界可切除PC的判断标准
注:NCCN:美国国立综合癌症网络,AHPBA/SSAT/SSO:美国肝胆胰协会/消化外科学会/肿瘤外科学会, Alliance肿瘤学临床试验联盟
血管与肿块间的关系影响到手术决策,术前MSCT对血管的详细评估对手术方案的制定至关重要。常规CT检查对肿块不可切除性判断的准确率几乎达到100%,但对可切除性的判断中约有1/3患者手术证实为不可切除[27,28],约20%~40%根治性切除的术后病理证实为姑息性切除[29]。Hong等[30]以NCCN指南为标准,对371例PC患者术前CT进行评价,结果表明肿瘤直径>4 cm、肿瘤与PV有接触均是R1/2切缘的高危因素;术前CT判断为BRPC的104例患者中,术后47例病理证实为R1/2切缘。由此可见,以解剖学标准判断肿瘤是否可切除具有很大的局限性,部分患者无法从手术治疗中获益。
Katz等[31]在2008年就提出判断BRPC时,应考虑肿瘤的生物学行为和患者的全身状态。2016年在国际胰腺病协会(international association of pancreatology,IAP)年会上,专家们就PC的可切除性进行了充分讨论,并对BRPC达成了共识,这个全新定义包含了A、B、C三个方面的内容,即肿瘤的解剖学因素(anatomical,A)、肿瘤的生物学特征(biological,B)和患者的全身状态(conditional,C)[32]。肿瘤的生物学特征采用CA 19-9水平、是否有局部淋巴结转移进行评价;患者的全身状态采用行为状态评分(performance status,PS)进行评价。按照这个共识,当肿瘤无远处转移时,尽管解剖学上属RPC,但CA19-9>500 U/mL或活检、PET-CT检查证实有局部淋巴结转移,也应属于BRPC(B因素);同样,影像上肿瘤无远处转移、解剖学上属于BRPC,如果PS评分≥2分,也划归为BRPC (C因素)。因胆道梗阻会影响血清CA 19-9水平,CA 19-9的测定应以减黄以后测定的数值为依据。对于Lewis抗原阴性的PC患者,血清CA19-9水平往往低于1 U/mL,上述指标不适用。Hayasaki等[33]对285例在新辅助治疗后手术切除的PC患者采用上述共识进行了重新评估,发现在可切除组中CA 19-9>500 U/mL患者的相关生存率明显低于CA 19-9≤500 U/mL者;PS评分≥2分患者的预后也明显差于<2分的患者。该研究表明,在PC可切除性评估中除了肿瘤与重要血管的关系外,肿瘤的生物学特征及患者的全身状态也是不可忽视的因素。
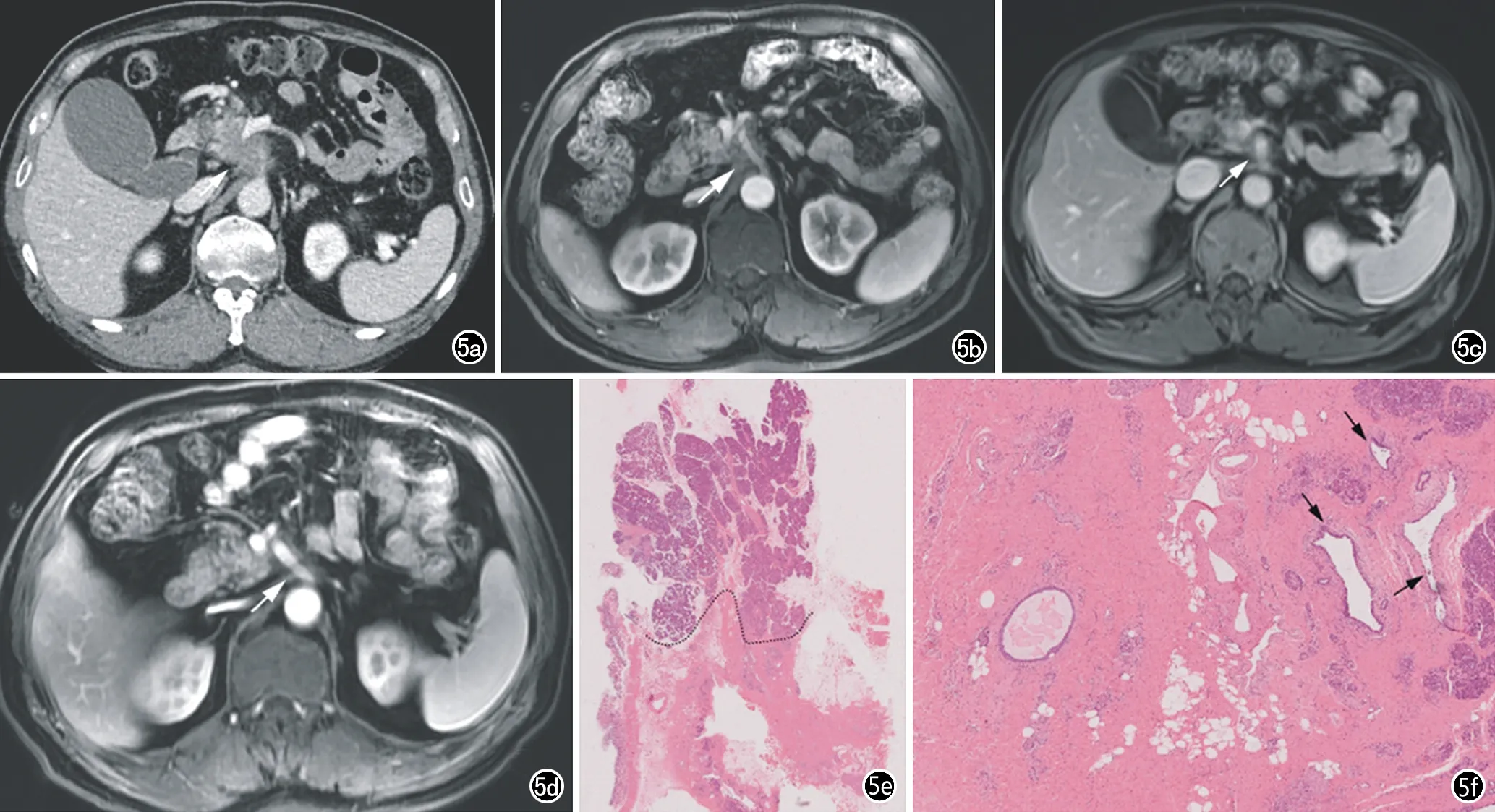
图5 胰腺癌新辅助化疗。图a~d为新辅助化疗前影像检查图像,a为2019年3月增强CT门脉期图像,b~d分别为2019年5、8、10月的MRI复查增强扫描FS-T1WI门脉期图像。治疗前胰头部肿块与肠系膜上静脉接触>180°,静脉变形,影像判断为可能切除,接受三期化疗后肿块体积明显缩小(箭),与肠系膜上静脉接触角度<180°,转变为可切除;e)病理大组织切片,黑虚线为正常胰腺与肿瘤的界限,下半部分为肿瘤(×1,HE);f)高倍镜下可见肿瘤大片间质化,仅见少量残存肿瘤细胞(箭),肿瘤降期分级为I级(×20,HE)。
由此可见,肿瘤生物学行为的异质性,影像学如果仅仅停留在与血管接触“180°”解剖学标志和形态学层面判断PC是否可切,会导致“部分患者R1/2切除,无法从手术中获益”这样一个尴尬的局面(图4)。目前迫切需要一种更符合肿瘤生物学行为的影像学指标和系统,能够更加精准地评估手术的可切除性。
PC新辅助治疗的评价
手术技巧和材料的进步并没有明显改善PC患者的预后,于是PC的诊疗模式也在慢慢发生改变。首先是从“surgery first”向多学科综合治疗协作组(multidisciplinary team,MDT)模式转变;其次,相关研究发现即使无转移的PC也是一种系统性疾病,手术时机的选择也与预后相关。当直接手术不能让无转移性PC患者获益时,术前新辅助治疗逐渐得到重视[34]。美国临床肿瘤协会(ASCO)指南认为NCCN指南中“可能切除”的定义,在不同的医疗中心受临床医生手术水平及其他主观因素影响较大,于是依据肿瘤生物学行为将PC划分为3类,分别为潜在可治愈PC、局部进展期不可切除PC以及转移性PC[35-37]。ASCO指南中的“潜在可治愈PC”对应于NCCN指南中的可切除和可能切除两类PC[38,39]。
诸多研究表明,对于BRPC和LAPC,术前行新辅助治疗后再手术较直接手术的R0切除率明显提高,前者的术后生存期明显延长(5个月)[40],表明新辅助治疗疗效显著,并被提倡和推广。2018年NCCN指南更新后明确指出:BRPC患者优先进行手术,但对于高危因素(较高水平的血清CA 19-9,较大的胰腺原发肿瘤,广泛的淋巴结转移,严重消瘦和极度疼痛等)患者,先行新辅助治疗后再行手术治疗[39]。
新辅助治疗的优势在于:消除可能存在的循环肿瘤细胞和微转移灶,降低术后肿瘤快速进展的风险,提高手术价值;使局部肿瘤缩小,降低临床分期,提高R0切除率;筛选出恶性程度高、疾病进展迅速、预后差的患者,免受外科手术创伤[41,42]。
PC新辅助治疗的疗效评价和手术时机选择一直以来是研究的热点之一。新辅助治疗周期过短担心治疗不足,而过长的治疗周期又容易诱导肿瘤耐药和疾病进展延误手术时机。回顾文献,目前对新辅助治疗评价的转归指标主要有五大类:①CA19-9水平;②RECIST1.1实体肿瘤评价原则和影像T分期预测;③病理T分期;④肿瘤切缘;⑤肿瘤化疗后的降期分级(tumor regression grading,TRG)。①为实验室评价指标,②为影像学评价指标,③~⑤均为术后病理评价指标。Cassinotto等[43]对47例PC患者新辅助治疗前后的CT图像进行分析,结果表明肿瘤治疗后CA 19-9水平、肿瘤最大径变化、肿瘤最大和最小径之和及治疗前后肿瘤与SMV/PV接触角度的改变,均与肿瘤术后T分期和切缘高度相关。应用于PC新辅助治疗评价最广泛的MRI技术是扩散加权成像(Diffusion weighted imaging,DWI),治疗前肿瘤ADC基线值越低,对化疗的疗效越差,低ADC值预示着肿瘤恶性程度高和进展[44,45]。也有CT和MRI灌注成像(perfusion weighted imaging,PWI)应用于新辅助治疗疗效评价的相关报道,研究结果表明治疗前后肿瘤内较多的灌注参数(blood flow,wash-in slope,wash-out slope)变化与治疗后疗效具有显著相关性[46,47]。PET/CT的相关研究表明新辅助治疗前后肿瘤SUV值的降低与疗效显著相关[48-50]。
影像学是新辅助治疗前后疗效评价最主要的方法,主要评价指标为肿瘤的最大径变化(图5)。功能成像(如DWI、PWI、PET/CT)的指标参数为PC新辅助治疗疗效评价带来更多有价值的信息。从已有的文献看,与新辅助治疗相关的影像评估研究很少,纳入研究患者样本量小,且均为回顾性研究。结合我院的PC新辅助治疗随访,有的PC病灶缩小明显,再手术甚至找不到肿瘤细胞,有的PC病灶控制无效甚至进展,疗效差异很大。因此,如果能对PC患者的影像信息进一步挖掘,再结合临床、检验及活检标本信息,分层PC患者,建立肿瘤新辅助疗效评价的预测模型,无疑将大大推进中晚期PC治疗的进步。
综上所述,PC早期检出难,影像与病理T分期不完全契合,影像、术中和病理学评估淋巴结三者的脱节,微小转移灶难发现,可切除评价仅以解剖学标志的局限性、预测新辅助治疗疗效的分层模型缺失等,这些都是影像、临床和研究亟待解决的问题。虽然有影像组学和人工智能运用于胰腺疾病方面的研究[51-53],但相关研究数量甚少且深度有限。未来,影像学医生能否借助大数据挖掘和人工智能等手段,从单纯的形态学过渡到肿瘤生物学,从影像学表征精准反映肿瘤病理学,也许是突破胰腺癌诊治模式、明显改进疗效的模式。

