富马酸酮替芬片处方工艺筛选及生物等效性研究
茅为 赵海涛 丁盛 王兵

摘 要 目的:筛选富马酸酮替芬片的处方,制备与参比制剂具有相同质量及生物利用度的自制片。方法:以溶出曲线评价结果,筛选原料药粒径和各辅料用量并考察原辅料混合方式和制粒时间等工艺参数。结果:确定富马酸酮替芬原料药及各辅料的用量,采用“一锅法”进行原辅料混合,3批采用验证工艺生产的富马酸酮替芬自制片与参比制剂质量相近且生物等效。结论:本实验筛选的处方和工艺能保证自制片质量与参比制剂一致。
关键词 富马酸酮替芬片 处方筛选 工艺研究 生物等效
中图分类号:R976; R944.4 文献标志码:A 文章编号:1006-1533(2020)17-0059-06
Study on the formulation and process of ketotifen fumarate tablet and its human bioequivalence
MAO Wei*, ZHAO Haitiao, DING Sheng**, WANG Bing
(Changzhou Pharmaceutical Factory Co., Ltd., Jiangsu Changzhou 213000, China)
ABSTRACT Objective: To study the formulation of ketotifen fumarate tablets in order to prepare home-made tablets having the similar bioequivalence to the reference preparation. Methods: The amount of active pharmaceutical ingredient and all excipients was screened out based on the in vitro dissolution behavior, and the effects of process parameters such as raw material and auxiliary material mixing methods and granulation time were also investigated. Results: The amount of active pharmaceutical ingredient and each excipient was determined. Three batches of ketotifen fumarate home-made tablets produced by the verification process had similar quality and bioequivalent to the reference preparation when raw materials and excipients were mixed by one-pot blend method. Conclusion: The formulation and process selected in this study can ensure that the quality of home-made tablets is consistent with the reference preparation.
KEy WORDS ketotifen fumarate tablets; prescription screen; process research; bioequivalence
富馬酸酮替芬片是新型抗变态反应药物,能有效抑制过敏反应介质,同时具有组胺H1受体拮抗作用和抑制过敏反应介质释放作用抗过敏作用较强,且药效持久,临床上主要用于治疗变异性咳嗽、变异性支气管哮喘和慢性荨麻疹等疾病[1-3]。在我国患过敏性鼻炎和过敏性支气管哮喘人数众多,且患者多为婴幼儿。因此需尽快完成该品种的质量一致性研究,提升药物的质量。
本研究以溶出曲线为考察指标,对原料药粒径、辅料种类和用量、混合和制粒工艺进行研究,最终确定本品处方组成和生产工艺。按照确定的处方和生产工艺制备的自制片与参比制剂生物等效。
1 材料和方法
1.1 仪器
Waters e2695-2489型高效液相色谱仪和X-bridge C18色谱柱(4.6 mm×150 mm,5 mm)均购自美国Waters公司;708DS溶出仪(美国Agilent公司);MS105型电子天平和MJ33型水分测定仪(瑞士Mettler-Toledo公司);DRAL10型和DRAL400型高速混合搅拌制粒机(比利时Collette公司);FLZB-1.5型、FLZB-150型旋转整粒机和HAD-50型多向运动混合机(浙江小伦制药机械有限公司);HAD-200型多向运动混合机(迦南科技有限公司);FLG-1.5型和FLG-120型高效沸腾干燥器(创志机电科技发展(上海)有限公司);ZP19/2型旋转式压片机(北京新龙立科技有限公司);P2020型压片机(菲特中国制药科技有限公司);YD-35型片剂硬度仪(天津天大天发科技有限公司)。
1.2 试药
富马酸酮替芬原料药(批号:5504-17-001M,浙江华海药业股份有限公司);富马酸酮替芬对照品(批号:100230-201703,中国食品药品检定研究院);富马酸酮替芬片原研药(批号:Y0198,诺华制药);淀粉(批号:170909,曲阜市天利药用辅料有限公司);乳糖(批号:L101850217A54500,德国Meggle公司);微晶纤维素(批号:170608A,曲阜市天利药用辅料有限公司);聚维酮K30(批号:0002140566,美国ISP公司);交联聚维酮(批号:0001734520,美国ISP公司);硬脂酸镁(批号:161129,浙江中维药业股份有限公司);其他化学试剂均为分析纯(国药集团化学试剂有限公司);水为纯化水。
1.3 方法
1.3.1 溶出实验方法
取本品,采用中国药典2015年版四部通则0931第二法进行溶出实验,pH 1.2、pH 4.5、pH 6.8溶液和水为介质,介质体积900 ml,温度为(37±0.5)℃,转速为50 r/min,取样时间为5、10、15、20、30 min。
1.3.2 测定方法
性状、鉴别、溶出度、含量、有关物质、含量均匀度参照日本医疗用药品品质情报集富马酸酮替芬胶囊溶出曲线检测方法[4]和2015版中国药典检测方法[5]进行检测。
1.3.3 原料药粒径研究
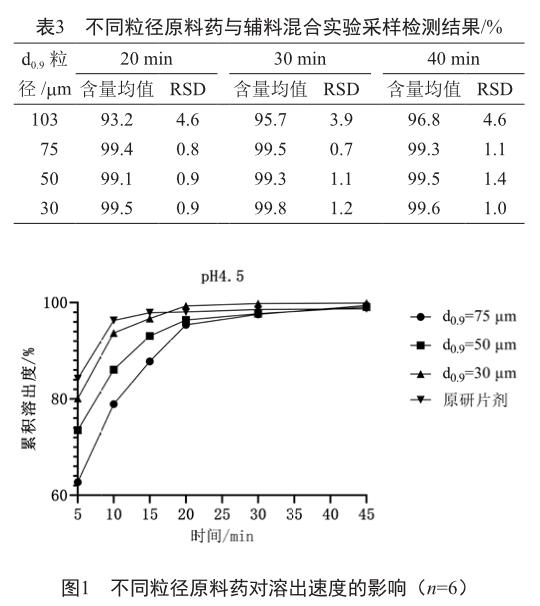
原料药粒径影响产品的溶出速度[6-7]。为确定原料药粒径分布,使用机械粉碎方式获得粒径d0.9=103 mm,d0.9=75 mm,d0.9=50 mm及d0.9=30 mm的原料药,并与其他辅料混合20、30、40 min,于不同时间点取样10份检测含量,并计算含量均值和RSD值。
1.3.4 原辅料相容性研究
按照1∶5的比例将原料药分别与淀粉、乳糖、微晶纤维素、聚维酮K30混合,按照20∶1的比例将原料药与硬脂酸镁混合。混合粉放置于60 ℃、相对湿度(RH)75%或92.5%及LX 4500±500条件下进行稳定性考察。
1.3.5 处方研究
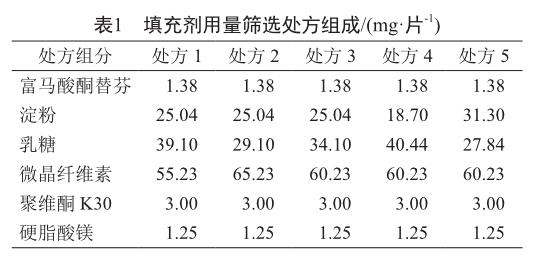
1)含不同量填充剂 确保片重为125 mg/片和其他辅料用量相同,调整处方中乳糖、微晶纤维素和淀粉的用量组成不同的处方,将不同处方组成的物料经混合、制粒、干燥,总混,压片得成品,考察溶出。填充剂用量筛选实验处方组成见表1。
2)含不同量聚维酮K30 设定处方中聚维酮K30量分别为3、4和5 mg/片,通过调整处方中淀粉用量保持片重相同。物料经混合、制粒、干燥、总混、压片得样品。
3)含不同量硬脂酸镁 其加入量过少易出现压片粘冲的现象;而加入量过高则将影响产品的溶出速度[8-9]。取若干份富马酸酮替芬颗粒,分别加入硬脂酸镁0.625、1.25、1.875和2.50 mg/片,再經混合、压片得样品。
1.3.6 工艺研究
1)原辅料混合方式研究 为保证原辅料混合均匀,选择“等量递增”和“一锅法”两种混合方法进行原辅料混合(表2),并于混合15、20、30、40 min后取样10份检测含量,并计算含量均值和RSD值。
2)制粒时间研究 湿法制粒时间对制粒效果具有较大的影响[10-11],本研究在相同的搅拌刀转速和制粒刀转速均为1速的条件下,对湿法制粒时间(3、5、7 min)进行了考察。
1.3.7 生物等效性实验
采用双周期交叉试验设计法进行空腹给药实验和餐后给药实验,48名受试者随机分别为两组,每组24人,其中男性和女性健康志愿者兼备。
1)空腹给药实验 志愿者在试验前1天20时后禁食,实验当天早上8时空腹用温开水240 ml送服给药,A组服用参比制剂1片,B组服用受试制剂1片,服药3 h和6 h后统一进食。分别在服药前和服药后0.33、0.67、1、1.33、1.67、2、2.33、2.67、3、3.33、3.67、4、4.33、4.67、5、5.5、6、8、10、12、16、24、36、48、72 h采血,置于肝素化试管中抗凝、离心后将上层血浆于-20 ℃保存,采用HPLC-MS进行检测。间隔1周后进行交叉实验。
2)餐后给药实验 志愿者试验前1天20时后禁食,试验当天统一进食高脂餐,进食结束后0.5 h,A组服用受试制剂1片,B组服用参比制剂1片,同上取0~72 h时间段血样;间隔1周后进行交叉实验。
2 结果
2.1 原料药粒径
以不同粒径分布的原料药进行混合实验, d0.9≤75 mm的原料药与辅料混合20 min后含量均接近100%且 RSD值较小,说明原辅料混合均匀(表3)。
2.2 原辅料相容性
结果表明,淀粉、乳糖、微晶纤维素、聚维酮K30及硬脂酸镁与原料药相容性良好(表4),上述物料可用于本品处方开发。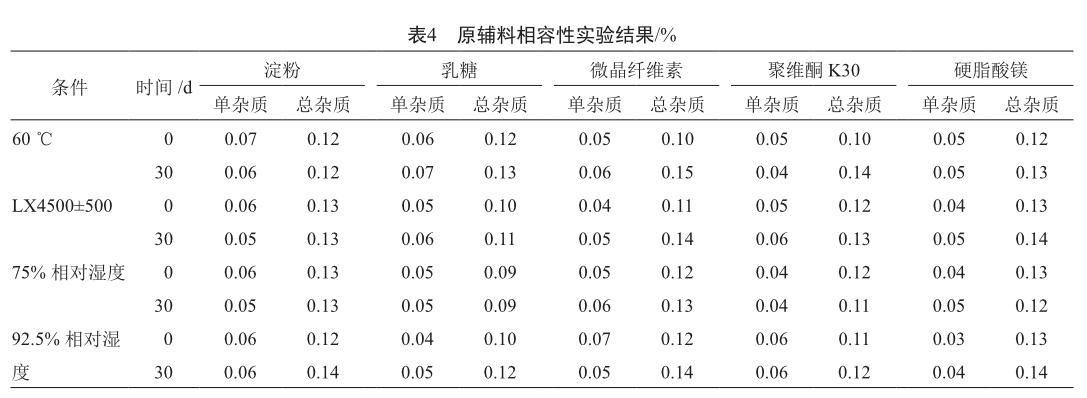
2.3 填充剂用量
使用不同用量淀粉、乳糖和微晶纤维素制备的样品溶出有所差异(图2)。从溶出曲线可知,处方3溶出曲线与参比制剂溶出曲线最相近,由此说明处方3的处方组成与参比制剂最为相似,故认为处方3为最优处方,并由此确定本品每片含淀粉25.04 mg,乳糖34.10 mg,微晶纤维素60.23 mg。
2.4 粘合剂用量
处方中聚维酮K30的用量增加对颗粒的压缩度无明显差异(表5),但样品的溶出却随着聚维酮用量的增加而减慢(图3)。当聚维酮K30用量为3 mg/片时,样品溶出速度与参比制剂最为相近,故最终确定本品处方中聚维酮K30用量为3 mg/片。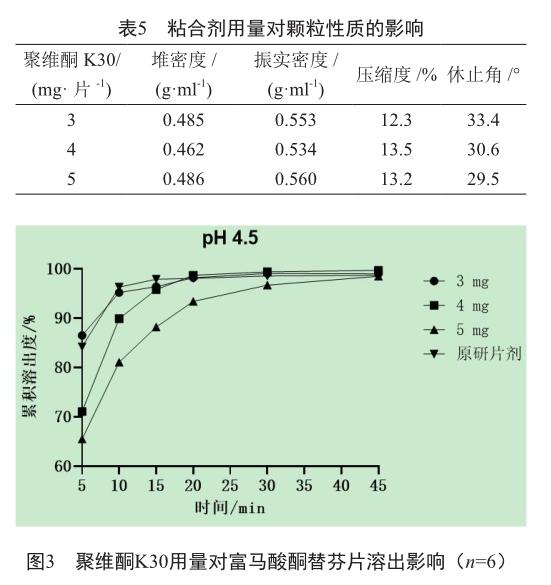
2.5 硬脂酸镁用量
从溶出实验可知,处方中硬脂酸镁用量为0.625 mg/片时样品的溶出速度较参比制剂快,用量为1.875及2.50 mg/片时样品的溶出速度较参比制剂慢,用量为1.25 mg/片时产品的溶出速度与参比最相似。因此确定本品中硬脂酸镁用量为1.25 mg/片。
综上,确定每片富马酸酮替芬片中含酮替芬1 mg,淀粉25.04 mg,乳糖34.10 mg,微晶纤维素60.23 mg,聚维酮K30 3 mg,硬脂酸镁1.25 mg。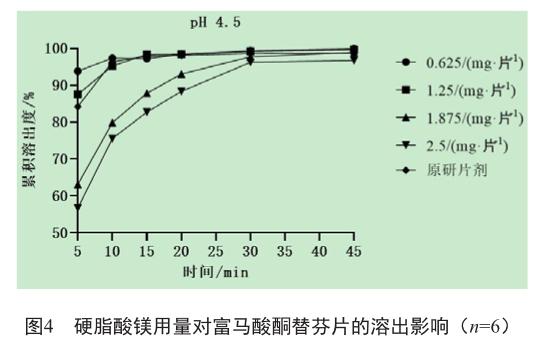
2.6 原辅料混合方式
使用“等量递增法”和“一锅法”这两种混合方式混合,混合粉平均含量在可接受的范围内且RSD值≤5%(表6),由此说明 “等量递增”和“一锅法”均能保证原辅料混合均匀。但是“等量递增”操作步骤复杂,故选用“一锅法”进行原辅料混合,混合时间20 min。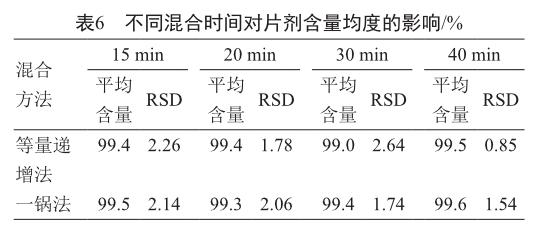
2.7 湿法制粒时间
不同的制粒时间对颗粒的粒径分布影响如图5所示。制粒时间3 min,物料中大颗粒较多细粉较少;制粒时间7 min,物料中大颗粒较少且细粉明显增加。三组实验中,制粒时间5 min制备的物料颗粒分布较均匀,因此确定本品生产过程制粒时间为5 min。
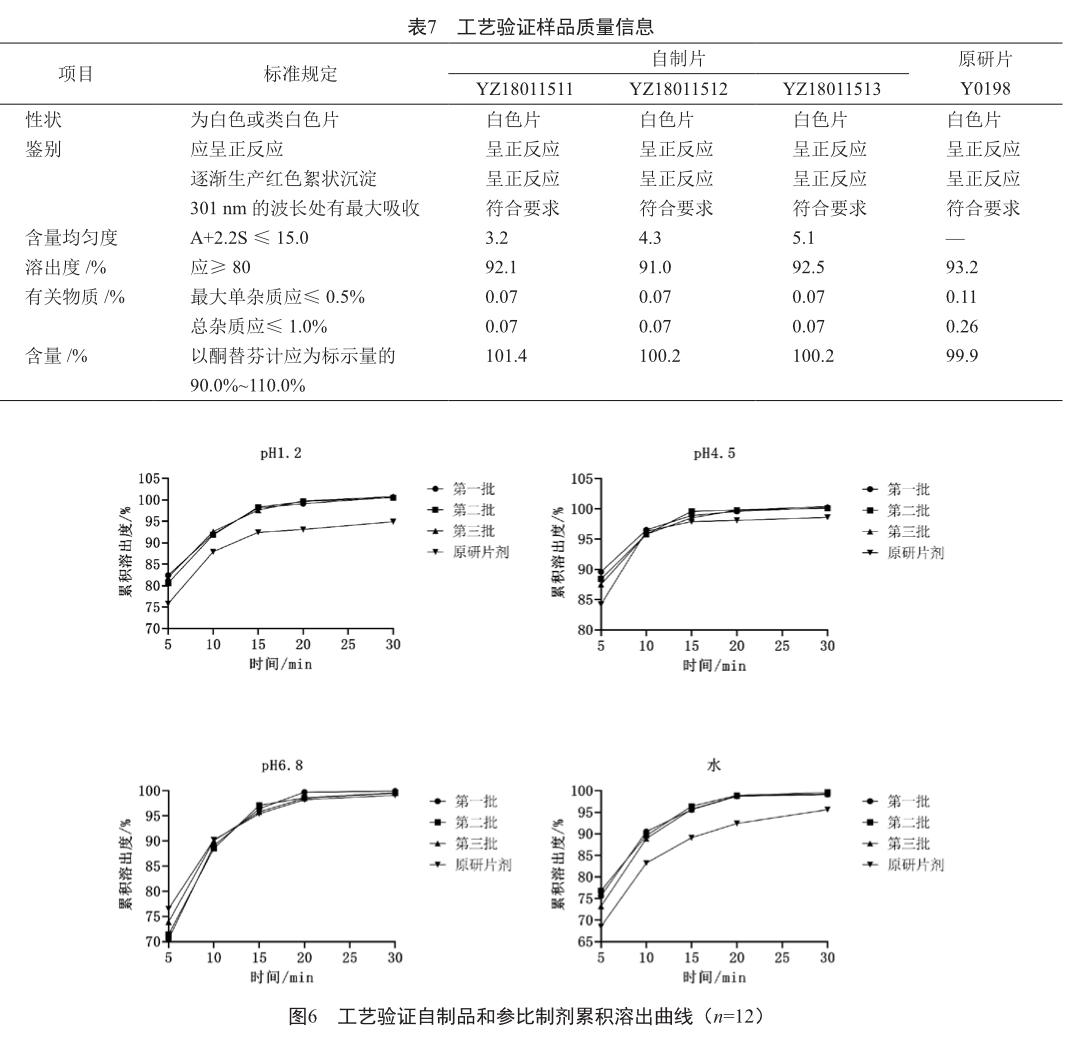
2.8 工艺验证
按照制定的处方组合和生产工艺,进行了三批富马酸酮替芬片(145万片/批)工艺验证,工艺验证结果符合质量标准。三批工艺验证产品检测结果及溶出曲线见表7和图6。
2.9 人体生物等效性
受试制剂YZ18011511和参比制剂Y0198的Cmax,AUC0→t和AUC0→∞的几何均值比值及其90%置信区间均在80%~125%范围内。因此,本试验受试制剂和参比制剂在空腹和餐后条件下均为生物等效。
3 讨论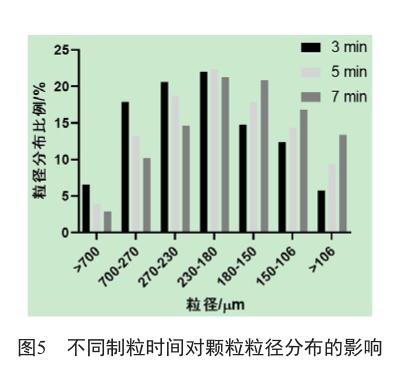
溶出曲线研究最根本的目的就是观察仿制制剂与参比制剂之间是否存在差异,并以此为监测手段,尽量优化处方,确保受试制剂与参比制剂的溶出行为一致。具有区分力的溶出曲线,能够预测药物在体内的吸收情况,找出药物体内体外测试结果的相关性,从而提高仿制药临床实验成功的几率。
本研究以参比制剂的溶出曲线作为评判标准,对影响产品质量性质的原料药粒径、辅料种类及用量等进行研究,通过处方筛选和工艺参数研究,开发了一种与原研制剂具有相同人体生物利用度的富马酸酮替芬片。本研究用实例证明了溶出曲线对片剂仿制药开发的重要性。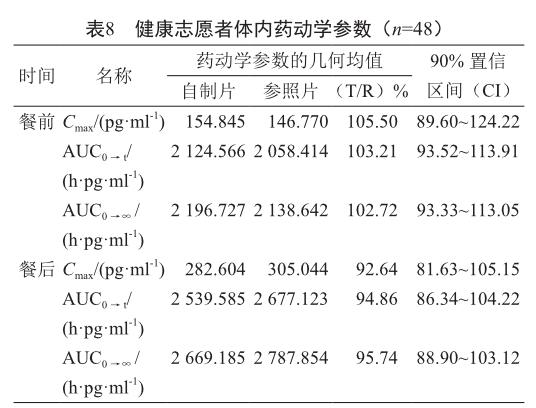
按本研究建立的較优生产工艺制备的三批自制片的溶出速度较参比制剂稍快,可能是由于在本品处方中加入了微晶纤维素、淀粉这两种具崩解性能的填充剂,使得自制品能迅速崩解从而溶出速度稍快于参比制剂。
本研究虽对生产工艺进行了研究,但尚未对可能影响产品质量的工艺如干燥温度、干燥时间、压片压力等参数进行研究,后续可考虑从事这些参数的研究,以便进一步提高本品的质量。
参考文献
[1] 方江. 苏黄-止咳胶囊联合富马酸酮替芬片治疗变应性咳嗽的疗效观察[J]. 临床合理用药杂志, 2016, 9(14): 1-2; 20.
[2] 袁苏平. 富马酸酮替芬联合孟鲁司特对咳嗽变异性哮喘患儿免疫功能的影响观察[J]. 实用中西医结合临床, 2019, 19(7): 85-87.
[3] 邬美俊. 枸地氯雷他定联合富马酸酮替芬治疗慢性荨麻疹的效果观察[J]. 中西医结合心血管病杂志, 2018, 6(9): 10-12.
[4] 国家药品监督管理局药品审评中心. 日本医疗用医药用品品质情报集[EB/OL]. [2019-08-01]. http://www.cde.org.cn/ recommend.do?method=view&id=430.
[5] 国家药典委员会. 中华人民共和国药典2015年版二部[M]. 北京: 中国医药科技出版社, 2015: 121-124.
[6] 王燕, 牟聪, 刘金凤, 等. 替格瑞洛原料药粒径对其片剂体外溶出行为的影响[J]. 中国药房, 2017, 20(1): 119-121.
[7] 刘为中, 李志云, 查晓雁. 原料药粒径对头孢地尼颗粒体外溶出行为的影响[J]. 安徽医药, 2015, 19(8): 1462-1465.
[8] 黄淑萍, 何华, 吴青青. 硬脂酸镁对盐酸特拉唑嗪胶囊溶出的影响[J]. 中国医院药学杂志, 2018, 38(3): 254-257.
[9] 龙海燕, 刘雁鸣, 粟贵, 等. 硬脂酸镁功能性参数对尼群地平片溶出行为影响的研究[J]. 中南药学, 2016, 14(12): 1298-1302.
[10] 彭龙, 陶敏, 王琦, 等. 高剪切湿法制粒工艺参数对格列齐特颗粒性质的影响[J]. 国际药学研究杂志, 2019, 46(2): 150-157.
[11] 陈吼. 高速剪切湿法制粒工艺制备氯沙坦钾片[J]. 沈阳药科大学学报, 2017, 34(6): 461-466; 502.

