大肠杆菌发酵产L-色氨酸培养基及补料优化
,*
(1.华东理工大学,生物反应器工程国家重点实验室,国家生化工程技术研究中心,上海 200237; 2.浙江工业大学生物工程学院,浙江杭州 310014)
色氨酸是一种重要的芳香族氨基酸,具有独特的吲哚侧链[1],含有三种异构体,分别是L-型、D-型、DL-型,较常见且研究最多的是L-色氨酸。L-色氨酸对人类和动物而言属于八大必需氨基酸中的第二必需氨基酸,在神经系统活动中起着重要的调节作用,广泛应用于医药、食品和动物饲料添加剂的制作加工业[2],主要用于食品添加剂。此外,因其与金属离子可以发生鳌合作用,具有抗氧化活性,可作为食品防腐剂和保鲜剂[3]。所以对于提升色氨酸产能水平的探索意义重大。
L-色氨酸可通过生物转化、酶法和微生物发酵等途径得到[4],利用大肠杆菌或谷氨酸棒状杆菌发酵生产是目前使用最多的、综合效益较高的方法[5]。日本协和发酵利用基因工程重组菌生产放大后L-色氨酸最高产量达到66 g/L,为目前行业报道的最高发酵水平,国内企业的L-色氨酸发酵产酸水平为25 g/L左右[6]。据近十年的数据统计,全球色氨酸的年需求量达到5万吨,产量只有1万吨左右,色氨酸的产量基本是供不应求的状态[7]。色氨酸发酵生产的理论得率为0.227 g/g Glu[8],这一最大产量表明,理论上葡萄糖中不超过36.7%的碳可以转化为L-色氨酸,其余的碳则被生物量增长和细胞呼吸等其他活动所消耗,因此,利用发酵工艺生产L-色氨酸,底物利用效率较低,这直接降低了潜在的工艺盈利能力[9]。除了菌株的选择,培养基的成分对发酵法生产而言至关重要,培养基的成分及配比合适与否,对微生物的生长,发酵产品的生物合成、提取,甚至最后对成品的产量、质量都会产生相当大的影响。
本文对重组大肠杆菌发酵产L-色氨酸初始发酵培养基开展了基础研究,在单因素优化筛选的基础上,采用一系列统计学实验设计方法找到影响发酵的关键培养基组分,得到了该菌株优化后的初始发酵培养基组合,提升了单位菌体L-色氨酸的比合成速率。为进一步优化色氨酸的合成效率、转化率提供了数据基础。
1 材料与方法
1.1 材料与仪器
大肠杆菌 浙江工业大学微生物菌种保藏室提供;葡萄糖、硫酸铵、磷酸二氢钾、磷酸氢二钾、一水柠檬酸、七水硫酸镁、酵母粉、氯化钠、蛋白胨、琼脂粉、乙酸铵、玉米浆、氢氧化钠等 均为分析纯,凌峰化学试剂有限公司;L-色氨酸 优级纯,国药集团化学试剂有限公司。
UV-2012PC型紫外可见分光光度计 美国Unico公司;TDL-80-2B离心机 上海安亭科学仪器厂;BSA224S-CW电子天平 北京赛多利斯仪器系统有限公司;DHP-9012电热恒温培养箱 上海一恒科技有限公司;ZHWY-3212摇床 上海志诚仪器仪表有限公司;5 L发酵罐 上海国强生化工程装备有限公司;SBA-40E生物传感分析仪 山东省科学院生物研究所;DHG-9123A电热恒温鼓风干燥箱 上海华连医疗器械有限公司;DK-S22型电热恒温水浴锅 上海精宏实验设备有限公司;YXQ-LS-SII立式压力蒸汽灭菌锅 上海博讯实业有限公司医疗设备厂;AGILENT 1100 series高效液相色谱仪 美国Agilent公司。
1.2 实验方法
1.2.1 培养基配方 种子平板活化培养基:1%蛋白胨,0.5%酵母提取物,1%氯化钠,2%琼脂粉,pH7.0。
种子摇瓶培养基:3%葡萄糖,0.5%硫酸铵,2.4%磷酸氢二钾,0.96%磷酸二氢钾,1.52%酵母提取物,0.1%七水硫酸镁,pH7.0。
初始发酵培养基:0.5%葡萄糖,0.22%硫酸铵,1.05%磷酸二氢钾,0.28%一水柠檬酸,0.28%七水硫酸镁,0.2%酵母提取物,pH6.5。
微量元素:1%七水合硫酸亚铁,0.28%无水亚硫酸钠,0.063%一水合硫酸锰,0.074%七水合硫酸锌,0.008%五水硫酸铜,0.04%六水氯化钴,用于发酵培养。
1.2.2 菌种培养方法
1.2.2.1 菌种活化 在无菌条件下,将甘油保种管内菌接至四环素(40 mg/L)抗性的LB固体培养基,37 ℃,培养16 h。
1.2.2.2 种子培养 用接种环刮取一环新鲜的菌落接至500 mL圆底三角瓶中,装液量100 mL,四环素工作浓度为40 mg/L,8层纱布封口,置巡回式摇床上,220 r/min,35 ℃振荡培养12 h。
1.2.2.3 摇瓶发酵 500 mL圆底三角瓶中装液量50 mL,发酵摇瓶在灭菌前需额外加入碳酸钙0.5 g/L用于短暂维持pH的稳定。接种量8%(V/V),8层纱布封口,置巡回式摇床上,220 r/min,35 ℃振荡培养36 h。
1.2.2.4 5 L罐发酵 标定pH电极,用饱和亚硫酸钠溶液标定溶氧0%。5 L发酵罐装液量为 2.5 L,接种前温度降至35 ℃,搅拌500 r/min,通气量为3 L/min,定溶氧100%。接种量为8%(V/V),整个过程中流加25%氨水控制pH(6.5),流加泡敌消泡,调整转速控制溶氧20%以上。当初始发酵培养基中的葡萄糖耗尽,开始流加质量浓度为65%的葡萄糖,起始流加速度1 g/L,溶氧持续回升,则增加补糖量,控制残糖浓度0.01 g/L左右。
1.2.3 培养基成分单因素实验
1.2.3.1 碳源 在前述初始发酵培养基基础上,只改变碳源种类,考察四种不同的常见碳源(葡萄糖、麦芽糖、蔗糖和乳糖)对重组大肠杆菌代谢的影响。以加入等碳元素含量(葡萄糖0.5%)的原则进行摇瓶试验,分析不同碳源对菌体生物量、残糖含量、pH及L-色氨酸产量的影响。
1.2.3.2 无机氮源 在前述初始发酵培养基基础上,只改变无机氮源种类,考察四种不同无机氮源(硫酸铵、硝酸铵、氯化铵和乙酸铵)对重组大肠杆菌代谢的影响。以加入等氮元素含量(硫酸铵0.22%)的原则进行摇瓶试验,分析不同的无机氮源对单位菌体L-色氨酸产量、菌体生物量及L-色氨酸合成产量的影响。
1.2.3.3 有机氮源 在前述初始发酵培养基基础上,只改变有机氮源种类,考察八种不同有机氮源(玉米浆、混合蛋白、酵母粉0810、牛肉膏、酵母粉0835、蛋白胨、酵母粉0815、酵母粉0805)对重组大肠杆菌代谢的影响。以加入等干物质含量0.2%为原则配制,分析其对单位菌体L-色氨酸产量、菌体生物量及L-色氨酸发酵产量的影响。
1.2.4 Plackett-Burman(PB)实验设计 通过采用PB实验设计,以单位菌体L-色氨酸产量和L-色氨酸产量为响应指标,筛选L-色氨酸合成过程中培养基中关键影响成分,选择培养基成分中的八种重要组分进行系统筛选评估。组分包括:硫酸铵、乙酸铵、玉米浆、酵母粉、一水柠檬酸、七水硫酸镁、磷酸二氢钾、微量元素,每个因素分高低两个水平,因素水平设计见表1。
1.2.5 响应面试验设计 采用Central-Composite Design(CCD)试验设计,以L-色氨酸产量为响应指标,对PB实验筛选出来的三个相对重要影响因素进行响应面试验分析,CCD试验设计因素水平参见表2。

表2 Central-Composite Design试验因素与水平Table 2 Factors and levels based on central-composite design

表1 Plackett-Burman设计的因子和水平Table 1 Factors and levels designed in Plackett-Burman
1.2.6 种龄对发酵的影响 考察不同种龄对应的种子对优化前后培养基发酵的影响,选择种龄10、12、14 h时接入发酵摇瓶进行发酵培养,找到最优的移种状态。
1.2.7 乙酸铵和玉米浆间歇流加培养工艺设计 实验分成四组:原始培养基组、优化培养基组、流加乙酸铵组、流加乙酸铵和玉米浆组。其中流加乙酸铵组:将培养基中的成分“乙酸铵”单独配制,9.75 g乙酸铵定容至200 mL,采用补料间歇流加的方式于36 h补入发酵罐,乙酸铵液补率8 g/L·h;流加乙酸铵和玉米浆组:将培养基中的成分“玉米浆”和“乙酸铵”分别单独配制,7.5 g玉米浆液定容至50 mL,9.75 g乙酸铵定容至150 mL,分别于24、36 h间歇流加补入发酵液中,玉米浆液补率2 g/L·h,乙酸铵液补率6 g/L·h。
1.2.8 指标测定方法
1.2.8.1 菌体生物量测定 发酵液稀释至适当倍数于分光光度计上测定OD600。
1.2.8.2 残糖浓度测定 对于非还原性的双糖采用酸水解法使其降解成还原性单糖后,采用DNS法[10]和SBA-40E生物传感分析仪测定。得到标准曲线y=1.3613x+0.0461,R2=0.9984。
1.2.8.3 L-色氨酸含量测定 采用对二甲胺基苯甲醛比色测定法[11]。其中标准曲线为y=207.97x+5.8789,R2=0.9994。
1.2.8.4 乙酸测定 采用HPLC法测定[12]。
1.2.8.5 单位菌体L-色氨酸产量计算 单位菌体L-色氨酸产量=单位体积培养液中L-色氨酸含量/菌体浓度OD600
1.3 数据处理
所有实验均重复三次。利用Origin 2016软件进行数据作图分析。使用软件Design Expert 7.0进行因素显著性分析。
2 结果与分析
2.1 单因素实验结果
2.1.1 不同碳源对重组菌株发酵的影响 不同碳源对重组大肠杆菌发酵色氨酸的结果见图1。发酵结束时,葡萄糖为碳源的情况下菌体浓度最高,OD600是其他组的1.5~2倍。L-色氨酸的合成量也最大,是其他组的2~4倍。根据图1的残糖及pH对比,蔗糖和乳糖组残糖和pH较高,说明该菌株对蔗糖和乳糖的利用度较差,这可能与该菌种分解蔗糖和乳糖的酶系活力低有关[13]。所以选择葡萄糖作为后续实验使用的碳源。

图1 不同碳源对L-色氨酸发酵的影响Fig.1 Effects of different carbon sources on L-tryptophan fermentation
2.1.2 不同无机氮源对重组菌株发酵的影响 不同无机氮源对重组大肠杆菌发酵色氨酸的结果见图2。如图2a,氯化铵为氮源的条件下,菌体OD600值略高于其它氮源,L-色氨酸的产量也同比高于硫酸铵和硝酸铵为氮源的发酵组,硫酸铵组单位菌体产量略高于氯化铵和硝酸铵组。乙酸铵为氮源时,菌体的浓度比硫酸铵和硝酸铵为氮源的发酵组低,但L-色氨酸的生成量达到了1118 mg/L,与其它三种无机氮源相比,提升了21%以上。尤其是以乙酸铵为氮源时单位菌体的L-色氨酸合成量最高达到了175 mg/OD,与其它三种无机氮源相比整体提升了30%以上(图2b)。可见乙酸铵虽然对菌的生长有一定抑制作用,但是对单位菌体的产量提升有很大的效用。可能是乙酸铵中除含有与硫酸铵等量的氮元素外,其还含有两个碳原子,在葡萄糖耗尽缺乏碳源时,乙醛酸通路被激活,菌体会利用乙酸进行合成代谢,替代TCA循环的部分代谢途径,使菌体更高效地利用碳源,而导致乙酸铵组效果比硫酸铵组效果好,但是在其他文献中乙酸对菌体生长和色氨酸合成均不利[14-15]。鉴于乙酸铵这种物质成分的特殊性,选择硫酸铵和乙酸铵进行后续的显著因素筛选试验。
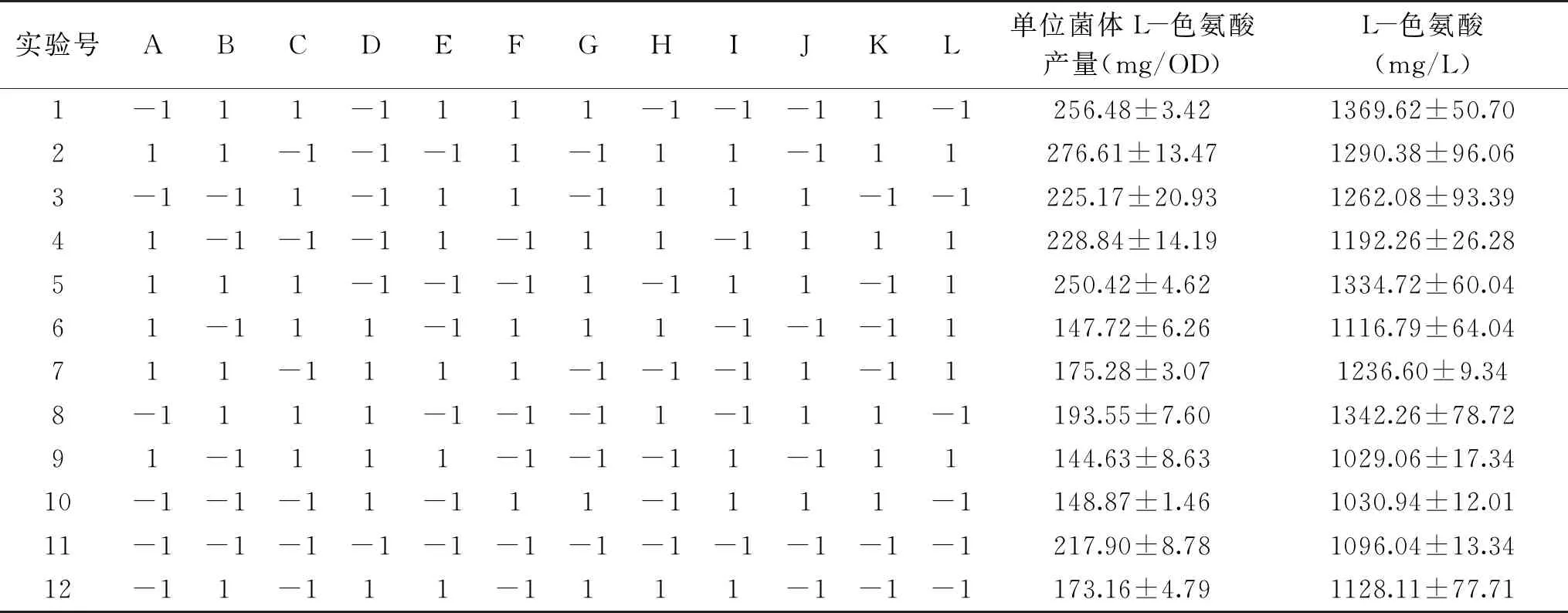
表3 Plackett-Burman试验设计及结果Table 3 Design and results of Plackett-Burman experiments

图2 不同无机氮源对L-色氨酸发酵的影响Fig.2 Effects of different inorganic nitrogen sources on L-tryptophan fermentation
2.1.3 不同有机氮源对重组菌株发酵的影响 不同有机氮源对重组菌株发酵的影响见图3。如图3a,酵母粉0810最有利于菌的生长,玉米浆组菌浓度最低,低于最高组的30%左右,且有文献报道称玉米浆一般含10%左右的乳酸,且玉米浆的利用会促进大肠杆菌对乙酸的积累[16],可能都会对菌的生长有一定抑制作用。但是由L-色氨酸的合成来看,图3a中玉米浆氮源组的L-色氨酸产量最高达到了1223 mg/L,其次是混合蛋白、酵母粉0810。根据单位菌体产量的统计结果可知,玉米浆组的单位菌体产量最高达到了292 mg/OD,远高于混合蛋白组的260 mg/OD,比其他氮源组(131~166 mg/OD)相比提升了76%以上。后续选择玉米浆和酵母粉0810进行显著性因素分析试验。

图3 不同有机氮源对L-色氨酸发酵的影响Fig.3 Effects of different organic nitrogen sources on L-tryptophan fermentation
2.2 PB实验结果与分析

表4 单位菌体L-色氨酸产量的Plackett-Burman设计方差分析Table 4 Results of Plackett-Burman design ANOVA analysis of the production of L-tryptophan in per unit cell
注:*表示显著(P<0.05);**表示极显著(P<0.01);表5、表7同。

表5 L-色氨酸产量的Plackett-Burman设计方差分析Table 5 Results of Plackett-Burman design ANOVA analysis of the production of L-tryptophan
以单位菌体L-色氨酸产量和L-色氨酸产量为评价指标,12组矩阵因素水平组合结果见表3。以单位菌体L-色氨酸产量(表4)和L-色氨酸产量(表5)为响应值的方差分析结果显示,乙酸铵和酵母粉对单位菌体L-色氨酸生物合成影响极显著(P<0.01),而对于L-色氨酸产量的影响,表5 的模型不显著,但在一定程度上可反映出,相对于PB中的其他因素而言,除乙酸铵外,酵母粉0810是影响最大的一个因子,其次是玉米浆,且由以上单因素实验中不同有机氮源对L-色氨酸合成影响可知,玉米浆对L-色氨酸产量的提升也有一定正向调节作用,试验选择乙酸铵、酵母粉0810、玉米浆进行后续CCD考察。本实验中最高发酵单位达到了1369 mg/L,最高单位菌体L-色氨酸产量达到了276 mg/OD,可见这些组分的交互搭配对于提升L-色氨酸产量和产率是至关重要的。
2.3 响应面实验结果与分析


表6 Central-Composite Design试验设计及结果Table 6 Design and results of central-composite design experiments


表7 Central-Composite Design设计方差分析Table 7 Results of Central-Composite Design ANOVA analysis

表8 优化前后培养基摇瓶发酵参数Table 8 Fermentation parameters of original and optimized medium in shake flasks

表9 不同培养时间种子液培养结果参数对比Table 9 Comparison of parameters for different culture time of seeds
2.4 摇瓶发酵验证
各成分最优配比为酵母粉0810 0.5 g/L、乙酸铵3.9 g/L、玉米浆3 g/L时,对应的响应值最大,L-色氨酸预测值可达1432 mg/L。
为了验证模型的准确性,在预测最佳培养基配方条件下进行大肠杆菌发酵产L-色氨酸重复实验3次,优化后的培养基摇瓶发酵验证结果见表8,优化培养基发酵L-色氨酸产量达到了1451.30 mg/L,与模型预测的值非常接近。与优化前的培养基发酵色氨酸产量(746.23 mg/L)相比提高了94.5%。但是优化后的培养基发酵菌体浓度OD600较低,说明此培养基中的某些成分对菌的生长有一定抑制作用,但是单位菌体L-色氨酸产量提高了140%,说明优化培养基是有利于产物合成的。综合PB和CCD实验结果,优化后培养基组合:0.12%硫酸铵、0.7%磷酸二氢钾、0.15%一水柠檬酸、0.28%七水硫酸镁、0.05%酵母粉0810、0.39%乙酸铵、0.3%玉米浆。
2.5 不同种龄对发酵的影响
不同种龄种子的培养结果见表9,随着培养时间的延长,菌体浓度OD600逐渐上升。10 h后种子进入快速生长期,培养14 h的种子液酸味较重,乙酸含量检测结果显示种子液已经开始积累代谢副产物乙酸,这可能是菌体浓度高的情况下氧限制引起的[18]。
不同种龄的种子接种发酵摇瓶培养结果见图4。如图4b原始培养基中,随着种龄增长,单位菌体L-色氨酸产量略有提高,菌体浓度略有上升(图4a),所以L-色氨酸产量也逐步上升(图4c)。优化培养基中12 h种龄的种子对应的发酵液菌体浓度最高(图4a),L-色氨酸的产量也高于10和14 h种龄的种子对应的发酵产量,达到了1293 mg/L(图4c),对应的单位菌体L-色氨酸产量达到了238 mg/OD(图4b)。14 h种龄的种子对应的发酵无论是菌体浓度,还是L-色氨酸产量都明显低于其他种龄对应的状态。发酵摇瓶的菌体浓度比12 h种龄的对应的发酵少了35%以上,OD600只有3.3左右,这可能与种子培养时间过长菌体活力下降有关,同时接入发酵瓶后乙酸等副产物可能会抑制了菌的生长[19]。
相对于原始培养基,优化后培养基L-色氨酸产量有较大提升,但是菌浓略有下降。不同种龄对优化培养基发酵结果影响很大,种龄12 h发酵L-色氨酸产量最高,菌体生长代谢较旺盛,综合考量选择12 h种龄接入发酵更有利于菌体合成。

图4 种龄对发酵的影响Fig.4 Effects of seed age on fermentation
2.6 5 L发酵罐补料分批培养
将优化培养基与原始培养基在5 L罐上进行补料分批培养的放大对比验证,结果见图5。各发酵参数对比见表10。
由图5a可知,使用优化后培养基在5 L罐上发酵菌体的延滞期较长,其整体生长进度延滞了24 h左右。优化后培养基菌体的延滞期较长主要与培养基成分乙酸铵有关,乙酸对菌体的生长有抑制作用[14],由于前期高浓度乙酸的存在使得延滞期较长。菌体在缓慢利用完基础培养基中葡萄糖后,会启动乙醛酸支路[20],开始消耗发酵液中的乙酸,且大肠杆菌在外源乙酸的存在下会倾向于避免自身乙酸的生成,对发酵后期的产物合成速率较高有一定帮助[21-22]。
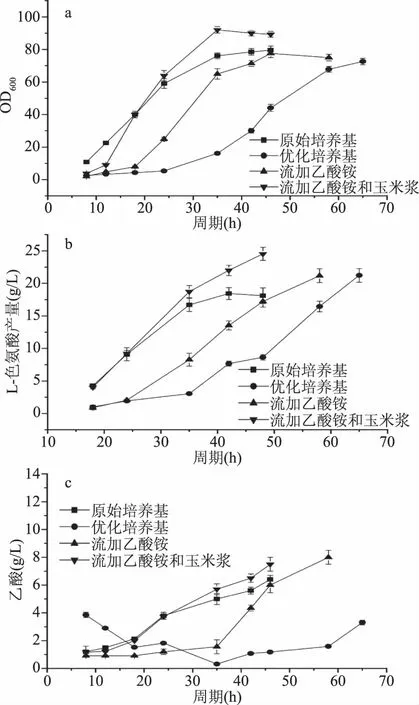
图5 初始培养基与优化培养基5 L罐发酵参数对比Fig.5 Comparison of fermentation parameters between initial medium and optimized medium in 5 L tank
将成分“乙酸铵”改成中后期流加控制,待菌体浓度增长到一定程度,采用间歇流加方式将乙酸铵补入发酵液,由图示5c可知,流加乙酸铵组发酵液中乙酸含量在36 h后逐渐上升,菌体的生长速率开始减缓(图5a),与优化培养基组相比,采用流加的方式使菌的生长延滞期缩短,L-色氨酸产量随着菌体浓度的快速升高有较大提高(图5b),发酵结束时,流加乙酸铵组L-色氨酸产量比原始培养基组提高了17%左右,且在发酵后期L-色氨酸合成速率和单位菌体L-色氨酸产量明显高于原始培养基组,单位菌体的L-色氨酸产量达到了282 mg/OD。说明乙酸铵的合理补加是有利于L-色氨酸的合成的,且采用乙酸铵流加的方式大大改善了高浓度乙酸铵造成的菌体延滞期长的问题。
菌的延滞期相对于对照(原始培养基组)较长,除了与原始培养基中乙酸含量高有关,与有机氮源玉米浆的量也有很大的关系,单因素实验结果显示玉米浆添加组菌体生长量最低,说明玉米浆对前期菌体的生长的确是有抑制作用的,因此实施乙酸铵和玉米浆单独流加工艺,发酵培养24 h后开始流加玉米浆,发酵36 h时开始流加乙酸铵。表10结果表明,这种方法能够大大缩短菌体生长的延滞期。

表10 初始培养基与优化培养基5 L罐发酵参数Table 10 Fermentation parameters of initial medium and optimized medium in 5 L tank
在发酵中后期,流加乙酸铵和玉米浆组依然能够维持菌体浓度较高的比生长速率,由色氨酸产量曲线变化斜率可知,L-色氨酸合成速率也明显提升,玉米浆和乙酸铵相结合的氮源补加方式使得发酵L-色氨酸产量提高了35%,糖酸转化率最高达到了14.25%,比原始培养基组(11.26%)提高了27%。说明采用这种分批补料的方式可以进一步优化发酵过程,提升了发酵效能。
3 结论
本实验利用一系列统计学实验设计方法优化了大肠杆菌产L-色氨酸原初始发酵培养基组合成分,以及对移种时间进行选择,从而提高了L-色氨酸的合成量,并最终在5 L发酵罐上进行验证,针对在罐上放大出现的延滞期长的问题,本文提出了一种新型的补料优化模式,实施了乙酸铵和玉米浆流加控制工艺。这种方法能够大大缩短菌体生长的延滞期,在发酵中后期,依然能够维持较高的比生长速率,色氨酸合成速率也明显提升,玉米浆和乙酸铵相结合的氮源补加方式能促使L-色氨酸产量提高35%,糖酸转化率最高达到14.25%,比原始培养基组提高了27%,优化效果显著,为菌体合成L-色氨酸培养基开发、补料工艺研究提供一定参考。本文使用低成本的有机氮源玉米浆部分代替酵母粉,以及发现乙酸铵对大肠杆菌发酵产L-色氨酸产量提升的特殊作用,目前这只在利用微生物转化法生产L-色氨酸中简单提及,这对进一步提升L-色氨酸产量的探索具有一定研究意义,未来可以从基因分子层面、胞内代谢流变化角度进一步研究以解释这种调控作用,后续应进一步探索补氮条件,对精准流加稀释后的有机氮源如玉米浆等采取进一步优化,可能会有新的成效,为实现更精确的补氮控制模式奠定基础。

