甲基麦冬黄烷酮A 降低缺氧复氧诱导PC12 细胞凋亡及氧化损伤
赵 晶,李彦杰*,周厚勤,任 锟,邢若星
(1.河南省中医院康复科,河南 郑州 450002; 2.郑州大学第三附属医院康复科,河南 郑州 450052)
缺血性脑血管疾病是一种全球范围内严重威胁人类生命的重大疾病,当血流量减少或受阻时,大脑的氧气和营养物质不足,导致缺血性中风[1]。目前随着溶栓治疗的开展和应用,阻塞的血管能够再通,使脑组织恢复足够的血流,挽救了一些患者的生命,但是在血流增加时可能导致部分患者脑组织结构和功能发生异常,进而加重病情。大脑缺血再灌注可能诱发神经元损伤,其涉及到的机制主要有钙超载、氧化应激和神经细胞凋亡等[2]。
麦冬Ophiopogon japonicus(L.f)Ker-GawL 是百合科沿阶草属多年生常绿草本植物,其块根有生津解渴、润肺止咳之效。麦冬的有效成分主要有甾体皂苷、高异黄酮、氨基酸和多糖等。其中甾体皂苷和高异黄酮是麦冬的主要活性成分,具有抗疲劳、清除自由基、抗炎、抗血栓形成、抗肿瘤等作用[3-4]。本研究以PC12 细胞株为研究对象,建立缺氧复氧(hypoxia/reoxygenation,H/R)损伤模型,给予甲基麦冬黄烷酮A(methylophiopogonanone A,MO-A)处理,通过评价细胞活性、细胞凋亡及氧化损伤考察MOA 对PC12 细胞缺氧复氧损伤的作用,为MO-A 在脑血管疾病中的应用奠定理论基础。
1 材料与方法
1.1 材料 PC12 细胞株购自中国科学院上海细胞库;RPMI1640 细胞培养液和胎牛血清(fetal bovine serum,FBS)购自美国Gibco 公司;MO-A 购自上海融禾科技有限公司;CCK-8 细胞活性检测试剂盒、LDH 细胞毒性检测试剂盒、BrdU 细胞增殖检测试剂盒购自上海碧云天生物科技有限公司;caspase-3 活性试剂盒购自美国Biovision 公司;超氧化物歧化酶(superoxide dismutase,SOD)、丙二醛(malondialdehydc,MDA)、过氧化氢酶(catalase,CAT)检测试剂盒购自南京建成生物工程研究所;细胞凋亡检测试剂盒购自瑞士Roche 公司;caspase-3 抗体和β-actin 抗体购自英国Abcam 公司;辣根过氧化酶二抗购自北京中杉金桥生物技术有限公司。
1.2 方法
1.2.1 细胞培养及分组 PC12 细胞接种于96 孔板中,培养于含有10% FBS 及1%青霉素/链霉素的RPMI1640 培养基中,放入37 ℃、5% CO2的培养箱中培养。待细胞融合度达到80%时,进行传代。此外,采用DMSO 配制浓度为50 mmol/L 的MO-A 母液,分装保存,使用时采用细胞培养液按照细胞分组稀释至实验浓度。
细胞分为5 组:(1)对照组,正常条件下培养PC12细胞;(2)模型组,PC12 培养在低糖RPMI 1640 培养基,置于5% CO2、95% N2、37 ℃的培养箱中培养4 h,更换为正常培养基后置于5% CO2、37 ℃的培养箱中培养24 h,建立H/R 损伤模型;(3)1 μmol/L MO-A+模型组,采用1 μmol/L MO-A 预处理 1 h,进行 H/R 处理;(4)10 μmol/L MO-A+模型组,采用10 μmol/L MO-A 预处理1 h,进行H/R 处理;(5)50 μmol/L MO-A+模型组,采用50 μmol/L MO-A 预处理1 h,进行H/R 处理。
1.2.2 CCK8 测定细胞活性 细胞接种于96 孔板中,每孔加入100 μL 培养基,各组给予相应的处理,实验结束时,每孔加入10 μL CCK8 溶液,于37 ℃反应2.5 h,以650 nm为参考波长,采用酶标仪在490 nm 处测定吸光度(A),细胞存活率按照以下公式计算:存活率=[(A实验-A空白)/(A对照-A空白)]×100%。
1.2.3 LDH 释放测定 细胞接种于96 孔板中,各组给予相应的处理,实验结束前1 h,弃培养基,加入110 μL(含10 μL LDH 释放试剂),于37 ℃孵育1 h,在多孔板离心机中400×g离心5 min,移取上清液至新培养板,按照说明书进行测定。
1.2.4 BrdU 掺入量测定 细胞接种于96 孔板中,各组给予相应的处理,按照BrdU 试剂盒说明书测定细胞中BrdU掺入量。
1.2.5 Cell Death Detectioin ELISA 测定细胞凋亡 细胞接种于24 孔板中,各组细胞给予相应的处理,实验结束后裂解细胞,提取细胞核,按照说明书进行检测。
1.2.6 caspase-3 活性测定 细胞接种于6 孔板中,各组给予相应的处理,实验结束后按照说明书测定caspase-3活性。
1.2.7 SOD、CAT 活性测定 各组细胞给予相应的处理,实验结束后收集细胞,按照说明书对SOD、CAT 活性进行测定。
1.2.8 MDA 水平测定 实验结束后,弃培养基,用PBS洗3 次,加入裂解液裂解细胞。12 000×g离心15 min,用BCA 蛋白测定试剂盒测定总蛋白量。根据该检测试剂盒的方向测定MDA 水平,结果以nmol/mg 蛋白表示。
1.2.9 蛋白印迹法 实验结束后,收集细胞总蛋白,采用BCA 法测定各组样品的蛋白浓度,每孔上样量50 μg,在SDS-PAGE 上进行电泳,目的蛋白分开后,200 mA 转膜1.5 h,以5% 脱脂牛奶室温封闭1 h,4 ℃过夜孵育抗caspase3、β-actin 蛋白,室温孵育二抗1 h,加入发光液,进行显色。
1.3 统计学分析 通过SPSS 11.0 软件进行分析,数据以(±s)表示,多组间比较采用单因素方差分析。P<0.05 表示差异具有统计学意义。
2 结果
2.1 MO-A 对细胞活性的影响 PC12 细胞给予不同浓度(1、10、50 μmol/L)MO-A 处理24 h 后,考察MO-A 对细胞活性是否有影响。如图1A 所示,不同浓度MO-A 对细胞活性无明显作用,与对照组比较无统计学差异(P>0.05)。BrdU 测定细胞增殖结果如图1B 所示,与对照组比较,MO-A 处理组细胞增殖率无变化(P>0.05)。由此表明,MO-A 对PC12 细胞活性及增殖无明显作用。

图1 MO-A 对细胞活性及增殖的影响
2.2 MO-A 降低缺氧复氧诱导的细胞活性损伤 细胞给予不同浓度(1、10、50 μmol/L)MO-A 预处理1 h 后,进行缺氧复氧损伤,通过测定细胞活性、细胞增殖及LDH 释放评价MO-A 对缺氧复氧损伤的作用。如图2A 所示,与对照组相比,模型组细胞活性降低(P<0.05),MO-A 处理组细胞活性较模型组升高(P<0.05),且呈现剂量依赖性。与模型组比较,1、10、50 μmol/L MO-A 处理均可促进细胞增殖(图2B,P<0.05),且50 μmol/L+模型组细胞增殖率最高。上清液中LDH 释放能够反映细胞损伤程度,如图2C所示,模型组LDH 释放率较对照组升高(P<0.05),MO-A预处理LDH 释放减少(P<0.05),呈一定剂量依赖性。
2.3 MO-A 降低缺氧复氧诱导的细胞凋亡 通过检测细胞凋亡率、caspase-3 活性及c-caspase-3 蛋白表达水平评价MO-A 对细胞凋亡的作用。如图3A 所示,与对照组比较,模型组细胞凋亡率升高(P<0.05),给予MO-A 处理后,细胞凋亡率降低(P<0.05),且50 μmol/L 处理组最低。MO-A 处理后,PC12 细胞caspase3 活性较模型组降低(图3B,P<0.05),且呈现剂量依赖性。此外,与模型组比较,MO-A 处理组c-caspase3 蛋白表达降低(图3C,P<0.05),呈剂量依赖性。由此表明,MO-A 能够抑制缺氧复氧诱导的细胞凋亡。

图2 MO-A 抑制缺氧复氧诱导的细胞损伤
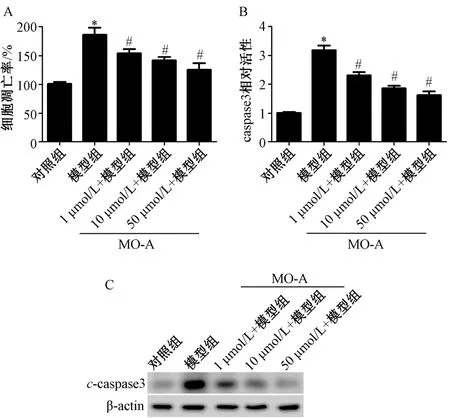
图3 MO-A 降低缺氧复氧诱导细胞凋亡
2.4 MO-A 降低缺氧复氧诱导氧化损伤 通过检测SOD、CAT 活性及MDA 水平评价PC12 细胞的氧化损伤。如图4所示,与对照组比较,模型组SOD、CAT 活性降低,给予MO-A 处理后升高(P<0.05),有一定剂量依赖性。此外,缺氧复氧损伤导致MDA 水平增加(P<0.05),而MO-A预处理组降低(P<0.05)。由此表明,MO-A 能够降低缺氧复氧诱导PC12 细胞的氧化损伤。
3 讨论
近年来,有多种天然产物在脑缺血相关疾病中发挥保护作用,如三七皂苷Rg1[5]、白藜芦醇[6]和芍药苷[7]等。麦冬作为一种常用的中药材之一,在多种疾病中具有保护作用,其有效成分麦冬多糖具有抗急性心肌缺血[8]及减轻脑缺血损伤[9]的作用。MO-A 作为麦冬中另一有效成分,能够减少心肌缺血再灌注损伤[10]。但是MO-A 对PC12 细胞缺氧复氧损伤的作用尚未报道,本研究中,考察MO-A对缺氧复氧诱导的细胞活性、凋亡及氧化损伤的作用。
首先,单独给予MO-A 处理PC12 细胞考察MO-A 对细胞活性是否有损伤作用,结果显示,MO-A 对细胞活性及增殖无明显作用。在H/R 损伤模型中,MO-A 预处理降低细胞损伤,表明MO-A 对PC12 细胞缺氧复氧损伤具有保护作用。有报道显示,MO-A 抑制心肌细胞系H9C2 细胞活性降低[10]。
许多研究表明,脑缺血再灌注导致神经细胞细胞凋亡,进而影响大脑正常的功能,引起不可逆的损伤,因此,减小或阻碍神经细胞凋亡对脑缺血再灌注损伤具有重要的意义。在心肌缺血再灌注损伤模型中,MO-A 显著降低心肌细胞凋亡,且MO-A 通过降低血脑屏障通透性保护脑组织缺血再灌注损伤[11]。本研究发现MO-A 预处理降低细胞凋亡率和caspase3 活性、并抑制c-caspase3 蛋白表达,且呈现剂量依赖性,表明MO-A 能够抑制PC12 细胞凋亡,减少缺氧复氧损伤。

图4 MO-A 降低缺氧复氧诱导氧化损伤
氧化应激广泛参与了许多病理生理过程,如衰老、炎症及肿瘤发生[12]。大量证据表明,ROS 过度生成引起的氧化应激是脑缺血再灌注发生发展的重要机制。因此,降低氧化应激被认为是治疗缺血性脑卒中的关键机制[12]。MOA 已被证实能够降低ROS 的产生[11]。本实验发现,MO-A预处理可抑制PC12 细胞SOD 和CAT 活性的降低、并对抗MDA 水平的升高,提示MO-A能减轻缺氧复氧损伤后神经细胞的氧化应激。
综上所述,MO-A 对缺氧复氧诱导PC12 细胞损伤具有保护作用,这与其抗凋亡及抗氧化的活性有关,本研究为该成分在缺血性脑病防治中的应用提供了新的思路和方法。

