龙胆泻肝汤对阴道加德纳菌的体外抑制作用
吴 汉,敖梅英,陈雪丽,陈 来,左爱仁,谢燕飞,邓可众
(江西中医药大学中医学院转化医学中心,江西 南昌 330004)
细菌性阴道病(bacterial vaginosis,BV)是阴道内正常菌群失调所致的一种混合感染,具有发病率高[1]、易复发[2]、危害大[3]等特点。阴道微生态正常情况下以各种乳酸杆菌为主,它们可以大量产酸、产过氧化氢气体,维持阴道酸性环境,抑制有害细菌的生长。BV 患者体内以阴道加德纳菌(Gardnerella vaginalis,GV)为首的厌氧致病菌通过黏附阴道上皮细胞、产生致密生物膜,分泌细胞毒素等作用使乳酸杆菌不能正常生长而大量死亡,最终造成阴道微生态菌群环境紊乱[4]。临床上常用药物为甲硝唑、替硝唑、克林霉素等,虽然治愈率理想,但复发率高,易耐药[5],不适合孕妇等特殊人群[6]。大量文献报道,传统中药复方,如龙胆泻肝汤[7-12]、完带汤[13-14]、治带方[15]等在BV治疗及预防复发中具有确切疗效,但相关作用机制并不明确。龙胆泻肝汤是中医治疗湿热带下的经典方,上可泻肝胆之火,下可清利湿热,除口服外还可用药渣作用于局部,以起到燥湿杀虫之功效。本实验旨在研究龙胆泻肝汤对GV 的体外抑制作用,为该方临床应用提供理论依据和指导。
1 材料
1.1 试剂与药物 按照《医方集解》原方比例从北京同仁堂药店购买龙胆泻肝汤方剂原料药;哥伦比亚血琼脂平板(北京陆桥技术股份有限公司,批号171108);BHI 肉汤培养基(英国Oxoid 公司,批号12276545);革兰氏染色试剂盒(北京索莱宝科技有限公司,批号20150414);DMEM 培养基(美国HyClone 公司,批号AC10206284);胎牛血清(美国Gibco 公司,批号1743263);胰蛋白酶(北京索莱宝科技有限公司,批号20170315);MTT(上海铺镇生物有限公司,批号298-93-1);TRIzol(美国Ambion 公司,批号3596026);qRTPCR 反转录试剂盒[宝日医生物技术(北京)有限公司,批号AK4901];SYBRII 荧光定量试剂[宝日医生物技术(北京)有限公司,批号AHX1020N]。
1.2 细菌与细胞 GV 为标准株ATCC14018,购于上海北诺生物有限公司。阴道卷曲乳杆菌(Lactobacillus crispatus,LC)由南昌大学魏华教授馈赠,分离于健康女性阴道分泌物,经API 细菌学鉴定;Hela 细胞为本实验室保存。
1.3 仪器 MarkII 厌氧工作站(荷兰Mark 公司);DM2500 普通光学倒置显微镜(德国徕卡公司);Thermo 3001 多功能全波长酶标仪(美国Thermo Scientific);Thermo 3110 二氧化碳培养箱(美国Thermo Scientific);Light Cycler96 荧光定量PCR 仪(瑞士Roche 公司);RE601 旋转蒸发仪(上海雅马拓科技贸易有限公司);SW-CJ-2D 超净工作台(苏州净化设备有限公司)。
2 方法
2.1 龙胆泻肝汤各部位的制备 龙胆泻肝汤水提物:按方称取组成药材,6 倍量水浸泡6 h,大火煮沸0.5 h 后小火煎0.5 h,滤过,重复2 次,合并滤液,离心后收集上清液,减压干燥至恒重。龙胆泻肝汤70%(95%)醇提物:按方称取组成药材,6 倍量70%(95%)乙醇浸泡6 h,70%(95%)乙醇回流提取3 次,滤过,合并滤液,离心后收集上清液,减压干燥至恒重。
2.2 稀释法测定龙胆泻肝汤各部位对GV 的最低抑菌浓度 按2 倍稀释法,用BHIs 培养基(称取BHI 固体培养基3.7 g,加入100 mL 去离子水,120 ℃高压灭菌,临用前加入10% 胎牛血清、1 mg/L两性霉素B)配制龙胆泻肝汤各部位提取物,初始浓度为500 mg/mL(生药),药物质量浓度从高到低(500、250、125、62.5、31.25、15.625、7.813、3.907、0 mg/mL)设置。每管加入BHIs 培养基、GV/LC(接种量约为1×104CFU/mL)和不同浓度药物。培养管在37 ℃、5% CO2下培养48 h后,各取200 μL 加入96 孔酶标板中,酶标仪测OD600,每组样品均设置2 个复管。为了去除培养基和药物颜色对菌体吸光值检测的干扰,给药组数值均减去了培养基和各浓度下药物的吸光值(药物浓度越高,其自身吸光值也越高)。
2.3 革兰氏染色法观察药物对GV 黏附人宫颈癌Hela 细胞的影响 将灭菌的细胞爬片放置于细胞培养的6 孔板中,按每孔8×105个数量接种Hela细胞,用DMEM 完全培养基(含10% 胎牛血清)培养过夜。根据抑菌实验的结果,选用的药物为龙胆泻肝汤70%乙醇提物。从冻存管中复苏GV,按1%的比例接种于5 mL 培养管中,设置3 组,分别为BHIs 组、BHIs +1.56 mg/mL 药物组、BHIs +15.6 mg/mL 药物组,37 ℃、5% CO2下培养48 h,8 000 r/min 离心5 min,用DMEM 完全培养基稀释各组GV,以MOI(菌/细胞)=10 的比例加到细胞培养孔中,37 ℃、5%CO2下培养4 h,PBS 洗涤3 次,将未黏附的菌体清洗干净,4% 多聚甲醛固定10 min,按照革兰氏染色试剂盒步骤进行染色,光学显微镜油镜下观察。细胞黏附于细胞表面的黏附率评分:未黏附,-;黏附1%~25%,+;黏附25%~50%,++;黏附>50%,+++。
2.4 MTT 法检测药物对GV 细胞毒性的影响 取GV 冻存管,以1% 接种量转接至2 只5 mL 培养管,37 ℃、5% CO2下分别用BHIs 培养基和含药(15.6 mg/mL 龙胆泻肝汤70%醇提物)BHIs 培养基培养48 h 后,8 000 r/min 离心5 min,用DMEM完全培养基将菌体混悬至相同浓度(1×106CFU/mL)备用。取细胞培养用96 孔板,按每孔1×104个数量接种Hela 细胞,培养过夜。将上述BHIs 培养基和含药BHIs 培养基培养的GV 分别按照MOI=1 和MOI=10 的比例加到Hela 细胞中,分别培养1、2、3、4 h 后PBS 洗涤2 次,吸去上清,每孔加入100 μL 1%MTT,37 ℃、5%CO2下放置4 h 后,每孔加入分析纯DMSO 100 μL,酶标仪测OD490,每个样品设置有5 个复孔。
2.5 96 孔微量板法检测药物对GV 生物膜形成能力的影响 96 孔微量板法检测细菌的生物膜形成能力是被广泛应用的一种方法[16-17],细菌形成生物膜以后,与含有明胶的培养板结合紧密,不易被冲洗掉,结晶紫染色后可呈现更深的着色。取细胞培养用96 孔板,每孔加入100 μL 0.1% 明胶,37 ℃放置4 h,小心吸去上清,备用。分别用BHIs 培养基、含药(1.56、15.6 mg/mL龙胆泻肝汤70%醇提物)BHIs 培养基配制GV 悬液,终浓度为1×107CFU/mL。将上述GV 按0.2 mL/孔接入明胶包被的96 孔板中,每个样品设置4 个复孔,37 ℃、5%CO2下培养60 h 后PBS 洗涤3 次,置于无菌超净台中吹干,每孔加入100 μL 甲醇固定30 min,弃去甲醇后每孔加入1%结晶紫,染色生物膜5 min,将96 孔板置于水龙头下均匀冲洗,晾干后每孔加入200 μL 33%冰醋酸,全波长酶标仪测定OD590。
2.6 荧光定量PCR 检测药物对GV 中生物膜相关蛋白(biofilm associated protein,BAP)和唾液酸酶(sialidase)基因表达的影响 BAP 是一种巨大的细胞壁锚定黏附素,可同时介导与宿主细胞的黏附及细胞间黏附,对生物膜的形成起着重要作用[18]。sialidase 是GV 分泌的细胞毒性物质之一,能降解阴道粘液,直接损伤阴道上皮细胞。
设置对照组(GV +BHIs 培养基)、BHIs +1.56 mg/mL药物组(GV+BHIs 培养基+1.56 mg/mL 龙胆泻肝 汤70% 醇提物)、BHIs +1.56 mg/mL 药物组(GV + BHIs 培养基+15.6 mg/mL龙胆泻肝汤70%醇提物)。将过夜生长的GV 按1∶20 比例接种于5 mL 上述培养液中,厌氧环境下37 ℃静置培养24 h 后,用PBS 洗涤2次,转移到500 μL TRIzol 裂解液中。按照TRIzol裂解液说明书提取纯化各组菌体总RNA,并溶于含30 μL RNase-free 的水中,用Nanodrop one 对RNA溶液进行定量分析。吸取1 μg RNA,逆转录试剂盒将其逆转录为cDNA,按1∶100 比例稀释后取2 μL cDNA 溶液作为模板,利用试剂盒(SYBR®Premix Ex TaqTM)进行荧光定量PCR。内参为菌体16sDNA 片段,对应的上下游引物分别为Gv16sc正向5′-AGGTACACTCACCCGAAAGC-3′,反向5′-CACATTGGGACTGAGATACGG-3′;BAP正向5′-GTGTCATTGAGCACACTTGC-3′,反向5′-GTTGTTAAAGAACACATCGAAG-3′;sialidase正向 5′-AGTCGCACTCCGCGCAAGTC-3′,反向5′-GACGACGGCGAATGGCACGA-3′,反应在Lightcycle96 仪上进行。采用2-ΔΔCt法进行数据处理。
3 结果
3.1 龙胆泻肝汤各部位对GV 的抑制作用 龙胆泻肝汤水提物、70%醇提物、95%醇提物对GV 的最低抑菌质量浓度分别为(62.5±3.6)、(15.6±1.5)、(125.0±2.8)mg/mL,而龙胆泻肝汤70%醇提物对阴道内LC 最低抑菌质量浓度为(62.5±1.6)mg/mL,远高于GV,见图1,说明它对GV的抑菌作用具有选择性。因此,后续实验选择龙胆泻肝汤70%醇提物、GV 进行实验。
3.2 龙胆泻肝汤70%醇提物对GV 黏附人宫颈癌Hela 细胞的影响 经龙胆泻肝汤70% 醇提物(1.56、15.6 mg/mL)共培养的GV 对Hela 细胞的黏附减少,见图2、表1,说明它能抑制GV 的细胞黏附能力,从而对细菌性阴道病起到积极的治疗作用。
3.3 龙胆泻肝汤70%醇提物对GV 细胞毒性的影响 GV 对Hela 细胞有较强的细胞毒性,与作用时间和MOI 值相关。随着GV 浓度增加,作用于Hela 细胞的时间延长,细胞毒性也增强。15.6 mg/mL龙胆泻肝汤70%醇提物共培养GV 后,Hela 细胞毒性减弱;MOI=10 时与BHIs 组比较,15.6 mg/mL 龙胆泻肝汤70%醇提物作用4 h 后细胞存活率增加(P<0.05)。见图3。
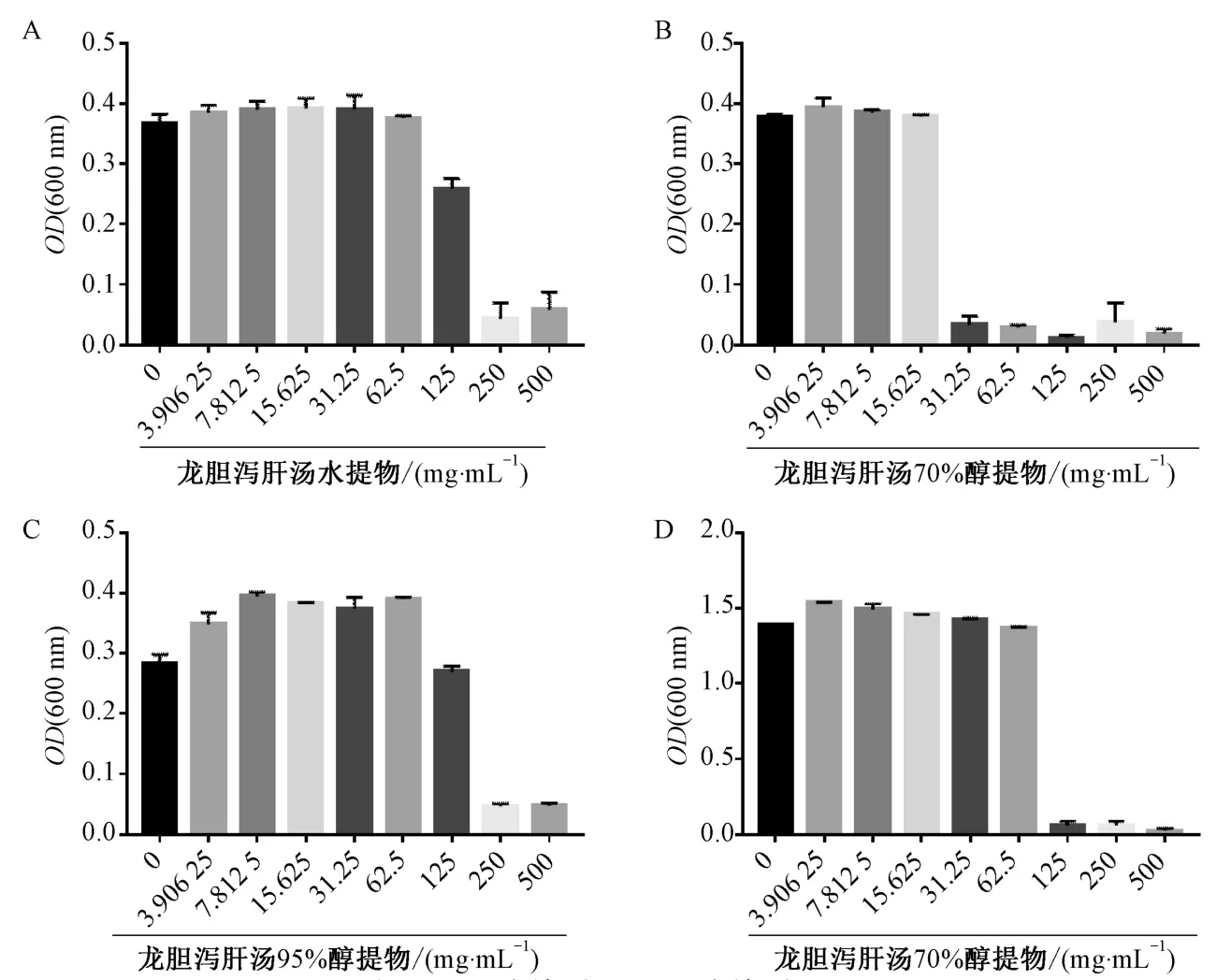
图1 龙胆泻肝汤不同提取部位对GV 和LC 的抑菌作用Fig.1 Bacteriostatic effects of different extractions of LXD on GV and LC
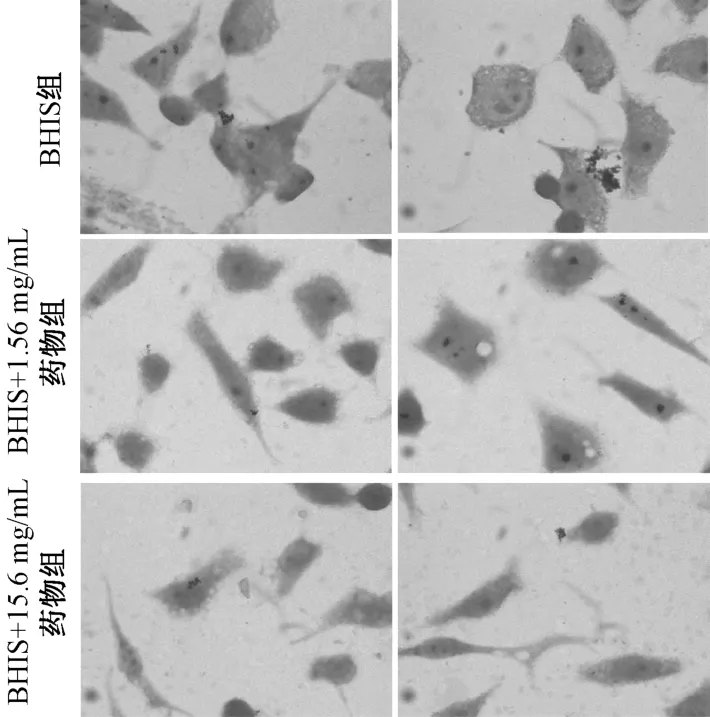
图2 龙胆泻肝汤70%醇提物对GV 黏附Hela 细胞的影响(×100)Fig.2 Effects of 70% ethanol extract of LXD on adhesion of GV bacteria on Hela cells(×100)
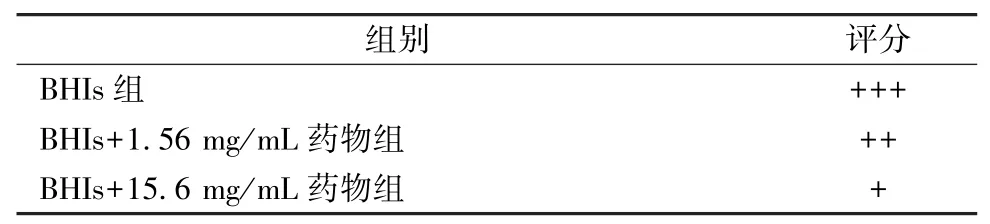
表1 龙胆泻肝汤70%醇提物处理后GV 对Hela 细胞黏附的评分Tab.1 Score for adhesion of GV treated with 70% ethanol extract of LXD on Hela cells
3.4 龙胆泻肝汤70%醇提物对GV 生物膜形成的影响 与BHIs 组比较,龙胆泻肝汤70% 醇提物(1.56、15.6 mg/mL)能抑制GV 生物膜形成(P<0.01)。见图4。
3.5 龙胆泻肝汤70%醇提物对GVBAP、sialidasemRNA 的影响 与BHIs 组比较,龙胆泻肝汤70%醇提物(1.56、15.6 mg/mL)能降低GVBAP、sialidasemRNA 表达(P<0.05,P<0.01)。见图5。
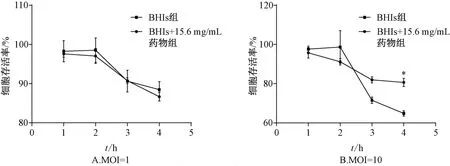
图3 龙胆泻肝汤70%醇提物对GV 细胞毒性的影响Fig.3 Effects of 70% ethanol extract of LXD on cytotoxicity of GV
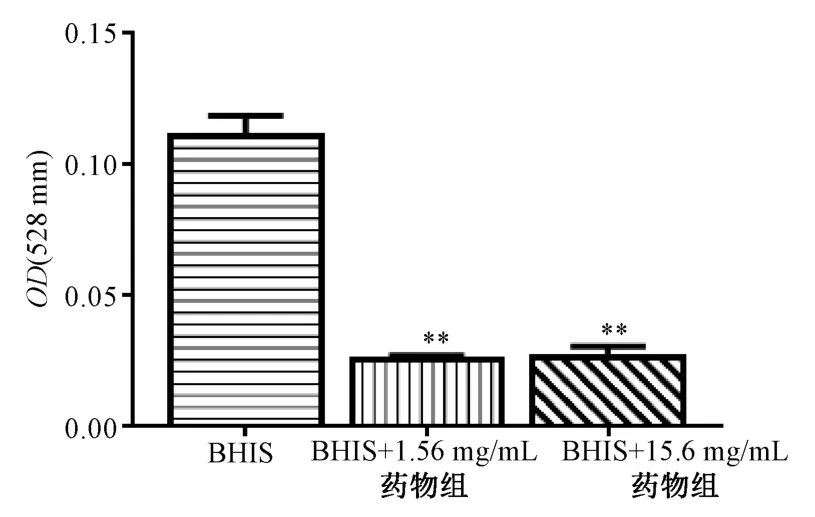
图4 龙胆泻肝汤70%醇提物对GV 生物膜形成的影响Fig.4 Effects of 70% alcohol extract of LXD on biofilm formation of GV bacteria
4 讨论
龙胆泻肝汤是中医治疗湿热带下的经典方,本方以清上逆之实火、除下注之湿热的龙胆草为主,横冲直撞,荡邪外出;以清泄并举的黄芩、栀子为辅,清热以解百毒,泄火而利三焦;佐以泽泻、木通、午前子三味引火从小便而出,乃宗《内经》“在下者引而竭之”之意;当归、地黄养血柔肝,以防苦寒伤肝;柴胡为肝胆疏利之要药,甘草调和诸药。全方配伍臻妙,虽苦寒而不伤胃,祛邪兼收扶正固本,诸药合用,共奏清热利湿、扶正祛邪之功效。此方为临床治疗BV 的经典有效方剂,得到广泛应用[7-12],兼有口服和局部熏洗,均有确切的疗效,但其有效部位和作用机制尚不清楚。
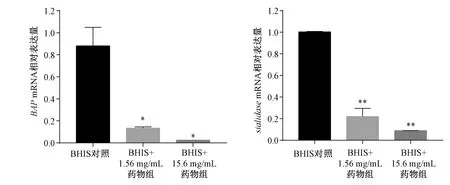
图5 龙胆泻肝汤70%醇提物对GV BAP、 sialidase mRNA 表达的影响Fig.5 Effects of 70% ethanol extract of LXD on the expression of BAP and sialidase mRNA in GV
GV 是兼性厌氧、革兰氏染色阴性、非运动、不定形态的小棒状菌,虽然在阴道pH 4~5 之间不生长,但它可以在此环境下黏附在阴道上皮细胞表面,形成致密的生物膜。生物膜在细菌性阴道病的发病过程中起着重要的作用,它既能够保护致病菌在不利环境下存活[19],也能够抑制药物的渗入,使致病菌逃脱宿主的免疫攻击[20],抗生素和宿主免疫都不能完全消除生物膜,这也是导致细菌性阴道病复发的主要因素[21]。此外,GV 还能释放一些细胞毒性物质,如细菌素、vaginolysins、唾液酸酶、蛋白酶等[22],直接损伤阴道上皮细胞,并引起相关的病理反应。
鉴于临床上龙胆泻肝汤局部熏洗对细菌性阴道病有确切疗效,本研究考察了龙胆泻肝汤在体外如何影响GV 的增殖、黏附、生物膜形成、细胞毒性,这也是构成其致病性的主要四大因素。
结果表明,龙胆泻肝汤70%醇提物对GV 具有较好的体外抑菌作用,最低抑菌质量浓度为(15.6±1.5)mg/mL,而对阴道卷曲乳杆菌的为(62.5±1.6)mg/mL,说明龙胆泻肝汤70%醇提物对GV 具有选择性抑制作用,阐释了中药复方在治疗细菌性阴道病中“扶正祛邪”的作用机制。此外,龙胆泻肝汤70% 醇提物能抑制GV 黏附Hela细胞,从而减少它对阴道上皮细胞的“占位”,有利于阴道微环境中乳酸杆菌的定位与繁殖。细胞毒性实验表明,当MOI=10 时,GV 能在4 h 内使Hela 细胞死亡率达到35.2%,而用15.6 mg/mL 龙胆泻肝汤70% 醇提物共培养后的GV 在同等条件下,Hela 细胞死亡率降低到19.4%,说明龙胆泻肝汤70%醇提物能够有效抑制GV 的细胞毒性。此外,1.56 mg/mL 龙胆泻肝汤70%醇提物能抑制GV生物膜的形成,可能是其治疗细菌性阴道病的主要机制之一。
然后,通过qRT-PCR 法测定了龙胆泻肝汤70%醇提物对GV 中BAP、salldasemRNA 表达的影响,其中前者能促进GV 生物膜形成,后者可增强GV 细胞毒性;1.56 mg/mL 龙胆泻肝汤70% 醇提物能显著抑制这2 个蛋白的转录,提示两者可能是药物作用的重要靶点。
本研究通过一系列体外实验阐述了龙胆泻肝汤70%醇提物抑制GV 的作用效果,为该方治疗细菌性阴道病提供了理论依据,并寻得了更有效的部位,同时对其作用机制进行了初步探讨。今后,将建立适当的动物模型,在体内进一步探讨龙胆泻肝汤作用机制及其对机体免疫系统的影响,并与体外实验相互佐证。

