胸腺肽α1联合血必净对脓毒症患者免疫功能和炎症水平的影响*
詹燕春, 徐玫, 徐娅, 刘一诚
(彭州市中医医院 重症医学科, 四川 成都 611930)
脓毒症是指感染所致的全身炎性反应综合征,是感染、大手术、严重创伤、烧伤等常见且严重并发症,严重时可发展为脓毒性休克,引起全身多器官功能衰竭,致使患者死亡[1]。据相关报道显示,全球每年新增脓毒症患者达数百万,导致25%以上患者死亡[2]。免疫功能异常、炎症失衡是脓毒症患者死亡的重要原因,因此免疫调节已成为脓毒症的一大治疗方向[3]。胸腺肽α1是一种提取自小牛胸腺的多肽,可通过促进外周T细胞成熟,刺激干扰素和白细胞介素分泌的免疫调节药物,目前在肿瘤、肝病、感染等疾病中均有应用[4]。近年来,中药方剂或中药制剂治疗脓毒症在临床受到重视,并取得了较好疗效[5]。血必净是基于“菌、毒、炎并治”理论研制的一种中药静脉制剂,有拮抗内毒素、调节免疫功能、控制炎性反应等多种作用,在感染、外伤、烧伤、器官功能受损时均有应用[6],然而将胸腺肽α1与血必净联合用于脓毒症辅助治疗的研究较少。因此,本研究将二者联合用于脓毒症患者治疗中,旨在观察其对患者免疫功能和炎症水平的影响,报道如下。
1 资料与方法
1.1 一般资料
选取2016年7月-2018年6月重症加强护理病房(intensive care unit,ICU)收治的脓毒症患者,符合《2012国际严重脓毒症及脓毒性休克诊疗指南》[7]的脓毒症诊断标准且临床资料完整;排除合并恶性肿瘤、免疫系统疾病、发病前已存在肝肾等器官功能不全者,排除入组前3个月内有激素、免疫抑制剂使用者、对本研究药物过敏者、入院后短时间内(<72 h)死亡者及临床资料不全者。纳入脓毒症患者96例,分为研究组52例(给予胸腺肽α1联合血必净治疗)与对照组44例(给予胸腺肽α1治疗)。研究组患者男29例、女23例,年龄38~74岁、平均(59.42±8.13)岁,肺部感染24例、腹腔感染17例、外伤感染5例及其他感染6例;对照组患者男26例、女18例,年龄36~73岁、平均(58.15±9.42)岁,肺部感染19例、腹腔感染16例、外伤感染6例及其他感染3例。2组患者以上资料比较差异无统计学意义(P>0.05),提示有可比性。
1.2 治疗方法
对照组患者在常规治疗(抗生素控制感染,液体复苏、维持血流动力学及内环境稳定、营养支持、控制血糖、纠正酸碱平衡紊乱等)基础上,给予胸腺肽α1(美国赛生药品香港股份国际有限公司,批号H20080079,规格1.6 mg/支),皮下注射,1 次/d,1.6 mg/次;研究组患者在对照组治疗方式基础上,合并给予血必净(天津红日药业股份有限公司,国药准字Z20040033,规格10 mL/支),将50 mL血必净注射液溶于100 mL生理盐水,静脉滴注,30~40 min内滴完,2次/d。
1.3 观察指标
1.3.1免疫功能 分别于治疗前和治疗后第7天时采集所有患者外周静脉血4 mL,制备白细胞悬液,行荧光标记,采用流式细胞仪检测CD3+、CD4+T细胞,自然杀伤细胞(natural killer cell,NK细胞)计数及CD4+/CD8+比值。
1.3.2炎性指标 分别于治疗前和治疗后第7天时采集所有患者外周静脉血4 mL,离心后分离血清,采用化学发光法检测血清降钙素原(procalcitonin,PCT),采用酶联免疫吸附法检测C反应蛋白(C-reactive protein,CRP)、白细胞介素-6(interleukin 6,IL-6)水平。
1.3.3临床评分 治疗前和治疗后第7天时对所有患者进行急性生理与慢性健康评分(acute physiology and chronic health evaluation,APACHEⅡ)和全身感染相关性器官功能衰竭评分(sepsis-related organ failure assessment,SOFA)。APACHEⅡ评分包括A、B、C、D四项内容,A项含腋温、平均动脉压、心率、呼吸频率、氧合指数、动脉血pH、血清钠、血清钾、血清肌酐、血细胞比容、白细胞计数、碳酸氢根离子等12项生理学指标,各项指标根据其临床值大小,评分范围在0~4分;B项为年龄,规定<44岁、45~54岁、55~64岁、65~74岁及≥75岁分别计0、2、3、5及6分;C项为格拉斯哥昏迷评分,规定运动反应、语言反应和睁眼反应评分范围分别为1~6分、1~5分和1~4分;D项为慢性健康评分,规定无器官损害计0分,常规手术前存在免疫或器官损害计2分,急诊手术或无手术且存在免疫或器官损害计5分,总分越高病情越重[8]。SOFA评分包括呼吸(氧合指数)、凝血(血小板)、肝脏(胆红素)、循环(平均动脉压或相关血管活性药物使用剂量)、神经(格拉斯哥评分)、肾脏(肌酐或24 h尿量)不同系统,根据相应数值,对应0~4分评分,总分越高病情越重[9]。
1.3.4住院情况 收集2组患者ICU住院时间、住院期间多器官功能障碍综合征(multiple organ dysfunction syndrome,MODS)发生情况及住院28 d内病死情况。符合下述2个及以上条件者即视为发生MODS[10]:(1)心血管功能障碍诊断条件为收缩压<90 mmHg、平均动脉压<70 mmHg,或发生室速、室颤、休克等;(2)呼吸功能障碍诊断条件为氧合指数<300 mmHg;(3)中枢神经系统障碍诊断条件为意识出现淡漠、躁动、嗜睡、浅昏迷、深昏迷,或格拉斯哥昏迷评分≤14分;(4)凝血系统功能障碍诊断条件为血小板计数<100×109/L,凝血时间、凝血酶时间、活化部分凝血活酶原时间延长或缩短,且3P试验阳性;(5)肝脏功能障碍诊断条件为总胆红素>20.5 μmol/L或血白蛋白<28 g/L;(6)肾功能障碍诊断条件为血肌酐>123.76 μmol/L或24 h尿量<500 mL;(7)胃肠系统功能障碍诊断条件为肠鸣音减弱或消失,或胃引流液、便潜血阳性,或见呕血、黑便,或腹内压≥11 cm H2O。
1.4 统计学分析
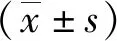
2 结果
2.1 免疫功能
2组患者外周血CD3+、CD4+T细胞,NK细胞计数及CD4+/CD8+比值治疗后均较治疗前升高,差异有统计学意义(P<0.05);治疗后研究组患者外周血CD3+、CD4+T细胞,NK细胞计数及CD4+/CD8+比值均高于对照组(P<0.05)。见表1。

表1 两组患者治疗前后CD3+、CD4+T细胞,NK细胞计数及CD4+/CD8+比值比较Tab.1 Comparison of CD3+, CD4+, NK count and CD4+/CD8+ before and after treatment between the two
注:与治疗前同组比较,(1)P<0.05;与对照组同时点比较,(2)P<0.05。
2.2 炎性相关指标
治疗前,2组患者血清PCT、CRP及IL-6水平比较,差异无统计学意义(P>0.05);治疗后,2组患者血清PCT、CRP及IL-6水平均较治疗前降低,差异有统计学意义(P<0.05),研究组低于对照组,差异有统计学意义(P<0.05)。见表2。

表2 两组患者治疗前后血清PCT、CRP及IL-6水平比较Tab.2 Comparison of levels of serum PCT, CRP and IL-6 before and after treatment between the two
注:(1)与同组治疗前比较,P<0.05;(2)与对照组同时点比较,P<0.05。
2.3 APACHEⅡ、SOFA评分
治疗前,2组患者APACHEⅡ、SOFA评分比较,差异无统计学意义(P>0.05);治疗后,2组患者APACHEⅡ、SOFA评分均低于治疗前(P<0.05),观察组低于对照组,差异有统计学意义(P<0.05)。见表3。

表3 两组患者治疗前后APACHEⅡ和SOFA评分Tab.3 Comparison of scores of APACHEII and SOFA before and after treatment between the two
注:(1)与同组治疗前比较,P<0.05;(2)与对照组同时点比较,P<0.05。
2.4 CD3+、CD4+、NK、CD4+/CD8+水平与APACHEⅡ、SOFA评分的相关分析
Pearson相关分析显示,所有患者治疗前、后外周血CD3+、CD4+、NK细胞计数及CD4+/CD8+比值分别均与APACHEⅡ评分、SOFA评分呈负相关(P<0.05)。见表4。

表4 CD3+、CD4+、NK、CD4+/CD8+水平与APACHEⅡ、SOFA评分的相关分析(r)Tab.4 Correlation between levels of CD3+, CD4+, NK and CD4+/CD8+ and scores of APACHEII and SOFA(r)
注:(1)为P<0.05。
2.5 预后
研究组患者ICU住院时间、MODS发生率及住院28 d内病死率均低于对照组,差异有统计学意义(P<0.05)。见表5。

表5 两组患者ICU治疗28 d内的结局Tab.5 Comparison of hospitalization situation between the two groups
注:(1)与对照组比较,P<0.05。
3 讨论
脓毒症是一个持续炎症-免疫抑制-分解代谢相结合的复杂危重病,其本质是机体对细菌感染做出的过度反应,一方面机体可因内毒素血症及大量炎性介质释放诱发全身性炎症反应和MODS,另一方面患者体内天然免疫亢奋与获得性免疫抑制同时存在,使机体免疫平衡紊乱,导致患者不良预后[11]。现代医学治疗脓毒症涉及抗感染治疗、液体复苏、维持血流动力学稳定、器官功能支持、免疫调节等多个环节,但几乎没有药物能同时涵盖多个靶点、环节治疗[12]。中医药可对机体进行综合调理、参与多靶点治疗,与脓毒症病理生理特征相符,近年来在脓毒症治疗中已显示独特优势[13]。胸腺肽α1是当前临床应用最广泛的免疫调节剂,其本身是由28种氨基酸组成的小分子肽,多提取自牛胸腺,有着很强的免疫刺激及免疫调节作用,其主要作用在于能促进T细胞分化、成熟,增强其功能[14];还能增加T细胞表面淋巴因子受体,并促进T细胞分泌干扰素α、干扰素γ以及IL-2、淋巴因子[15];也可通过对CD4细胞的激活恢复胸腺中CD4、CD8双阳性T细胞比例[16];此外,干扰素可使胸腺肽α1细胞毒性增强,胸腺肽α1则可增加NK细胞的聚集,并通过降低谷胱甘肽消耗、延迟自由基产生等过程减少淋巴细胞成熟过程中的凋亡,抑制特异性免疫细胞凋亡[17]。血必净是经现代工艺由血府逐瘀汤中提取制成的中药静脉制剂,原材料主要由当归、丹参、红花、赤芍川芎等中药组成,有疏经通络、溃散毒邪、活血化瘀及清热解毒功效,经现代药理分析其有效成分包括原儿茶醛、阿魏酸、红花黄色素、芍药苷、川芎嗪,可综合发挥拮抗内毒素、调节免疫功能、抑制炎性反应、改善微循环及克服凝血功能障碍等多种作用,从多靶点治疗脓毒症,但具体机制不详[18]。既往有报道指出,血必净可通过拮抗脂多糖,抑制其结合蛋白复合物形成,从而阻断脓毒症炎性反应信号通路[19];还有研究认为,血必净能通过介导脓毒症Treg凋亡和抑制调节性树突细胞活性来改善机体免疫紊乱状态[20];也有研究显示,血必净可以下调单核细胞组织因子分泌,改善外周血中性粒细胞趋化、吞噬功能,从而改善单核细胞介导的炎症反应及凝血功能紊乱,最终抑制了脓毒症病理中炎症反应与凝血紊乱的“交汇作用”,有效遏制病情进展[21]。
有研究表明,随着脓毒症发展,机体出现免疫抑制状态,可表现为淋巴细胞凋亡、T淋巴细胞有丝分裂活性减弱、NK细胞活力下降、单核细胞人类白细胞分化抗原减少等状态[22]。CD3+表示总T细胞,反映机体免疫功能[23];CD4淋巴细胞表达的表面分子及分泌的细胞因子对免疫系统其他细胞生物活性有调节作用,在脓毒症患者抗微生物过程中起重要作用[24];CD8+T细胞可抑制CD4+细胞核B细胞,有免疫抑制作用,CD4+/CD8+降低与免疫功能下降有关[25];NK细胞见于外周血颗粒细胞中,其数量及活性也可反映免疫功能[26]。本研究结果显示,2组患者外周血CD3+T细胞、CD4+T细胞、CD4+/CD8+、NK水平治疗后均较治疗前升高(P<0.05),且治疗后研究组患者高于对照组(P<0.05),提示胸腺肽α1联合血必净治疗对脓毒症患者免疫功能改善效果更好,与韦茵等[27]研究结果一致。PCT、CRP、IL-6是临床常见且重要的炎性指标,PCT水平对细菌感染敏感性高,CRP是一种急性时相反映蛋白,主要由IL-6诱导肝脏合成产生,IL-6参与炎性级联反应[28]。本研究结果显示,2组患者血清PCT、CRP及IL-6水平治疗后均较治疗前降低(P<0.05),且治疗后研究组患者低于对照组(P<0.05),提示血必净的应用对脓毒症患者炎性反应控制更好,与康福新等[29]研究结果一致。APACHEⅡ、SOFA是ICU评价患者预后的重要评分系统[30],本研究结果显示治疗后研究组患者APACHEⅡ、SOFA评分均低于对照组(P<0.05),提示胸腺肽α1联合血必净治疗脓毒症可以改善患者预后。此外,本研究结果还表明,研究组患者的ICU住院时间、MODS发生率及住院28 d内病死率均低于对照组(P<0.05),进一步表明胸腺肽α1联合血必净在缩短脓毒症患者住院时间、降低MODS发生率及病死率方面有着积极意义。
综上所述,与单纯给予胸腺肽α1辅助治疗相比,胸腺肽α1联合血必净治疗可以更好地调节患者免疫功能、减轻炎性水平、保护器官功能及改善预后,效果明显,值得临床推广。

