胶原诱导性关节炎大鼠血清TNF-α、IL-6、IFN-γ及IL-10水平变化*
谭艳, 宁丽常, 蹇孝丽, 蒋红梅**
(1.贵州医科大学 医学检验学院 临床微生物免疫教研室, 贵州 贵阳 550025; 2.长沙医学院 医学检验学院 临床微生物免疫教研室, 湖南 长沙 410219; 3.贵州中医学院第一附属医院 检验科, 贵州 贵阳 550025)
类风湿性关节炎(rheumatoid arthritis,RA)是一种常见的自身免疫性疾病,主要累及患者多个关节,引起关节炎症及关节畸形,从而影响患者生活质量[1]。RA患者约占世界人口的0.5%[2],目前国内外对RA进行了大量研究,但其发病机制仍不完全清楚[3]。胶原诱导性关节炎(collagen-induced arthritis,CIA)大鼠是一种理想的、常用的RA动物模型,具有与临床RA患者相似的关节炎症状和病理改变[4]。肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、白细胞介素-6(interleukin-6,IL-6)、干扰素-γ(interferon-gamma,IFN-γ)和IL-10是常见的炎症细胞因子[5-6],本研究通过检测CIA大鼠血清TNF-α、IL-6、IFN-γ和IL-10探讨RA的发病机制,报道如下。
1 材料与方法
1.1 动物和试剂
购自贵州医科大学动物实验中心清洁级雌性Sprague Dawley(SD)大鼠16只,体质量250~320 g,恒温恒湿环境中适应性饲养1周后进行实验。牛Ⅱ型胶原(Bovine Type Ⅱ Collagen,BⅡC,批号C7806)和福氏完全佐剂(F5881)购自美国sigma公司,乙二胺四乙酸二钠(ethylenediaminetetraacetic acid disodium salt,EDTA-Na2,批号E8030)购自北京索莱宝公司,TNF-α酶联免疫吸附试验(enzyme linked immunosorbent assay,ELISA)检测试剂盒96T(批号ERC102a)购自欣博盛生物科技有限公司,IL-6 ELISA检测试剂盒96T(批号JER-04)购自安徽巧伊生物科技有限公司,IL-10 ELISA检测试剂盒96T(批号BMS629)购自美国eBioscience公司,IFN-γ ELISA检测试剂盒96T(批号EK380HS)购自杭州联科生物公司。
1.2 方法
1.2.1分组及处理 16只SD大鼠随机分为CIA组和对照组,每组8只。CIA组大鼠予左足跖部皮内注射乳化(冰上将BⅡC与CFA按 1 ∶1混匀达浓度为1 g/L,以乳剂滴于清水中不散开为完全乳化)的BⅡC乳剂200 μL(初次免疫),第14天尾根部皮内多点注射相同剂量乳化的胶原(加强免疫);对照组大鼠予以同剂量生理盐水同法注射。
1.2.2关节炎指数评分 分别在初次免疫后第7、14、21、28、35及42天观察2组大鼠的关节炎症状,并进行关节炎指数评分。关节炎指数评分是将无关节红肿、趾关节出现轻微的红肿、足趾关节以下部位出现肿胀、踝关节以下部位均出现肿胀和整个足爪均出现肿胀,依次评为0、1、2、3及4分,四肢得分累计为总分,总分0~16分[5]。
1.2.3苏木精-伊红染色法(hematoxylin-eosin staining,HE)染色 初次免疫后第42天处死2组大鼠,取后左足踝关节去除皮肤和肌肉,10%中性甲醛溶液固定24 h,12.5% EDTA-Na2室温中脱钙,每2天换1次脱钙液,30 d关节基本软化后切片、HE染色,干燥并封片,显微镜下观察脱钙后关节滑膜组织病理变化。
1.2.4血清TNF-α、IL-6、IFN-γ及IL-10检测 初次免疫后第42天时麻醉状态下大鼠股动脉取血,2 000 r/min,离心10 min分离血清,按ELISA试剂盒说明书,双抗体夹心法检测各组大鼠血清TNF-α、IL-6、IFN-γ及IL-10的含量。检测步骤为2倍倍比稀释标准品、加标准品、加样本和二抗、加酶温育30 min,配洗液并洗板,避光显色10 min,加终止液。所有检测因子在加入终止液的5~30 min内均在450 nm处检测OD值,最后根据标准曲线计算血清中细胞因子的含量。
1.3 统计学分析
2 结果
2.1 造模情况
对照组大鼠的关节在2次生理盐水处理后均无明显肿胀;CIA组大鼠在初次免疫后注射足第1天出现红肿,第7天注射足肿胀明显,第14天加强免疫后随着时间的延长关节炎症状加重、关节指数升高,第21天大鼠关节炎指数达到高峰、双足红肿现象越加明显、随着时间的延长关节肿胀减退不明显。见图1。

图1 两组大鼠足趾关节肉眼观Fig.1 swelling joints of rats from both groups
2.2 关节炎指数评分
与对照组相比,CIA组大鼠关节炎指数升高;CIA组大鼠随着时间的延长,关节炎指数升高,第21天达到高峰,第28、35及42天关节炎指数下降不明显,与对照组比较,差异有统计学意义(P<0.05)。见表1。
2.3 HE染色
实验第42天足趾组织切片结果显示,对照组大鼠踝关节滑膜组织可观察到由排列整齐的滑膜细胞和滑膜下组织构成,未看到破坏的关节面、炎症细胞浸润的关节腔和新生的毛细血管(箭头所示);CIA组大鼠踝关节滑膜组织出现典型的关节炎症状,即滑膜细胞明显增生,层数明显增多且排列紊乱,关节炎性细胞广泛浸润,新生血管和血管翳的明显形成,软骨表面有滑膜侵入,并破坏骨和软骨组织(箭头所示)。见图2。
表1 大鼠关节炎指数评分Tab.1 Arthritis index scores of each
注:(1)与对照组相比,P<0.05。
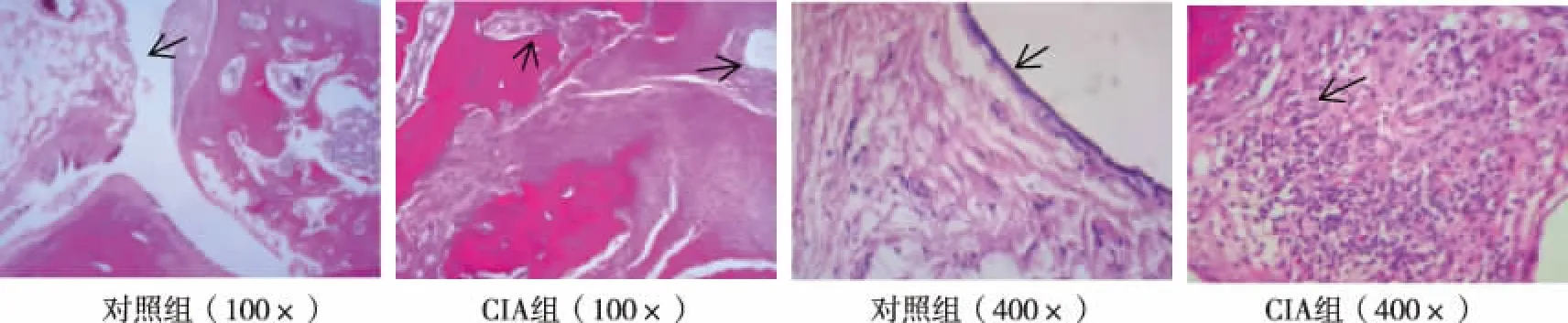
图2 两组大鼠踝关节滑膜组织学观察(42 d,HE)Fig.2 Histological characteristics of ankle joints of rats
2.4 血清TNF-α、IL-6、IFN-γ及IL-10水平
与对照组相比,CIA组大鼠血清TNF-α、IL-6及IFN-γ水平增高,IL-10水平降低,差异均有统计学意义(P<0.05)。见表2。
表2 造模第42天时2组大鼠血清TNF-α、IL-6、IFN-γ及IL-10水平Tab.2 Levels of TNF-α、IL-6、IFN-γ and IL-10 in rat
注:(1)与对照组相比,P<0.05。
3 讨论
因RA的发病机制仍不完全清楚,因此对其机制的探讨成为了国内外研究热点[7-8]。临床资料表明,RA患者绝大多数为女性[9],故本研究选择SD雌性大鼠做为实验动物。CIA大鼠无论症状、病理学变化、免疫学改变及发病机制等方面和人类RA患者的表现有许多相似的特征[10-12],因而在实验中常用来作为研究RA的动物模型[13]。RA是一种慢性全身性自身免疫性疾病,病变累及全身各个脏器,但以关节受累最为严重[14]。本研究在CIA组大鼠足跟注射胶原,并于第14天尾根部注射同样剂量的胶原后,第21天可见关节明显肿胀畸形,直到第42天关节症状仍然明显;对照组大鼠在2次生理盐水处理后均未见关节肿胀。因此可以提示CIA组大鼠关节的肿胀畸形是由胶原所诱导的,且踝关节HE出现明显的炎症症状,可见该胶原已经诱导了关节炎的产生,因此本研究成功复制了CIA模型。
TNF-α是由激活的单核巨噬细胞、淋巴细胞和中性粒细胞产生的一种炎症因子,它可引起组织损伤并调节免疫反应[15]。在免疫反应中,TNF-α可激活参与细胞生长、增殖和炎症反应的核转录因子kB,研究表明TNF-α在炎症患者机体的血清中含量明显升高[16]。IL-6是由巨噬细胞、T细胞、B细胞等细胞分泌的一种炎症因子,参与炎症反应、调节免疫应答和自身免疫病[17]。在本研究中,CIA组大鼠血清TNF-α和IL-6水平明显升高,可推测CIA大鼠关节的炎症变化可能与炎症细胞因子TNF-α和IL-6改变有关。在辅助性T细胞(Helper T cell,Th)中,Th1细胞分泌IFN-γ等细胞因子,主要介导机体细胞免疫应答[18-19];Th2细胞分泌IL-10等细胞因子,主要介导机体炎症并引起体液免疫应答,参与抗体生成[20-21]。Th1细胞分泌的细胞因子IFN-γ可以促进自身分化成熟,同时还抑制Th0向Th2分化,Th2细胞分泌的细胞因子IL-10可促进自身的分化成熟并增强Th2细胞而抑制Th1细胞的生成,同时与其他各种因素相互调节[22]。在正常机体中,Th1和Th2的细胞因子处于一种平衡状态,当机体存在炎症反应时,这种平衡将会被打破[23]。RA是一种常见的慢性自身免疫性疾病,分泌IFN-γ的促炎性Thl细胞和分泌IL-10的抗炎性Th2细胞在体内失衡,在RA的发病机制中具有重要作用[24]。研究发现,RA模型小鼠中出现Thl/Th2的比值明显升高的现象[25],提示该模型小鼠中Th1细胞及其分泌的细胞因子明显升高,从而引起炎症反应。同时有报道认为,Thl细胞可促进RA病情的发展,而Th2细胞起到抑制炎症的作用[26]。本研究结果显示,与Th1有关的细胞因子IFN-γ表达水平增高,但与Th2有关的细胞因子IL-10表达水平降低,大鼠体内Th1/Th2细胞因子比例失衡,Th1分泌的细胞因子占优势,也论证了CIA的发生与Th1/Th2比例失衡有关。
综上所述,CIA大鼠血清TNF-α、IL-6及IFN-γ水平的升高,IL-10水平的降低与RA的发生发展密切相关。

