口腔鳞状细胞癌组织CIRP和TLR4蛋白表达与患者临床病理特征及预后的关系*
张琳梅, 高岭, 李少明, 陈诚
(1.西安医学院 口腔医学院, 陕西 西安 710021; 2.青岛大学附属医院 口腔颌面外科, 山东 青岛 266555; 3.西安交通大学口腔医院口腔综合科, 陕西 西安 710004)
口腔鳞状细胞癌(oral squamous cell carcinoma,OSCC)是常见的头颈部恶性肿瘤,约占所有恶性肿瘤的5%[1]。近年来OSCC的检测和治疗取得了令人鼓舞的进展,但是患者的5年生存率仍然很低[2]。炎症被列为癌症的八大特征之一,非可控性炎症是肿瘤发生、发展的重要过程[3]。研究证实慢性炎症在肿瘤的生长、侵袭、血管再生、形成缺氧微环境等方面具有重要作用[4],因此,阐明炎症与癌症间的转化机制,对于有效遏制慢性口腔炎性病变向口腔癌的恶变有着极其重要的作用。Toll样受体4(toll-like receptor 4,TLR4)是一种跨膜蛋白,在宿主防御病原体、激活先天免疫和调节慢性炎症风险方面发挥着重要作用[5]。初步证据表明,肿瘤细胞中TLR4基因的过表达可诱发局部的慢性炎症,从而促进肿瘤生长[6]。冷诱导RNA结合蛋白(cold inducible RNA binding protein,CIRP)可通过TLR4诱导炎症反应,在多种组织和细胞中均有表达[7-8]。CIRP是一种位于细胞核内18 kDa的蛋白,氨基端具有共有RNA识别序列[9];羧基末端为甘氨酸富集的结构域,该结构域包含一些精氨酸-甘氨酸-甘氨酸序列,属于富含甘氨酸RNA结合蛋白家族亚群之一,又称为异源核糖核蛋白A18[9]。当受到外界诱导时,CIRP可从细胞核转移到细胞质,靶向特定的mRNA并促进其翻译,在G1期延长时介导对细胞生长的抑制[10],但其在OSCC中的具体机制仍未明确。因此,本研究通过检测OSCC患者癌组织标本中CIRP和TLR4蛋白的表达,分析其与患者临床组织病理和预后的关系,为慢性炎症向OSCC的恶变过程提供新的早期预测指标及合适的治疗靶点。
1 材料与方法
1.1 材料
1.1.1一般资料 选取40例2009-2014年确诊为OSCC患者的癌组织标本作为研究组,患者的瘤周正常组织作为对照组;要求患者未经过其他治疗、临床资料完整且获患者或其家属知情同意。纳入40例患者,男27例、女13例,年龄35~81岁,首次诊断为原发性OSCC的平均年龄为(58.25±12.04)岁;组织学高、中、低分化各有16、13及11例;肿瘤分期(tumor,lymph node and metastasis stage,TNM)为T1、T2、T3及T4期分别有9、14、10及7例;临床分期Ⅰ、Ⅱ、Ⅲ及Ⅳ期分别有11、13、7及9例;淋巴结转移阳性16例、阴性24例;患者术前均无化疗,术后均无复发。对所有患者或其家属做电话回访,术后随访1次/年,截止到2019年时死亡21例(52.5%),死亡者的生存时间范围6.00~56.00 月、平均生存时间(32.08±12.39)月。
1.1.2主要试剂和仪器 CIRP抗体、TLR4抗体和鼠单克隆抗体购自英国ABcam公司,磷酸盐缓冲液(phosphate buffer saline,PBS)、4%多聚甲醛、无水乙醇、95%乙醇、80%乙醇、二甲苯、石蜡、3%双氧水、Triton×100、山羊抗小鼠免疫组化试剂盒(histostain&re plus SP)和3,3,二氨基联苯胺(3,3′-diaminobenzidine DAB)显色剂均购自中国北京中杉公司,苏木素、中性树胶、孵育盒购自西安沃尔森生物技术公司,DHG-9000恒温烤箱购自深华生物科技有限公司,HS-S7220切片机购自恒松科技公司,DMIRBHC倒置显微镜购自美国Leica公司。
1.2 检测方法
1.2.1组织固定、包埋、切片 术中取得的组织标本浸泡于4%多聚甲醛,4 ℃过夜;80%乙醇浸泡24 h、95%乙醇浸泡14 h,无水乙醇浸泡2次、3 h/次,二甲苯浸泡2次、30 min/次,标记、石蜡浸泡和包埋;将制作好的组织蜡块进行切片(厚4 μm)、贴片,放入60 ℃恒温烤箱烤干2 h,备用。
1.2.2免疫组织化学染色及结果判断 样本切片覆盖3%过氧化氢,山羊血清室温封闭,加入一抗(稀释比例1 ∶150)于4 ℃孵育24 h;室温平衡30 min,PBS荡洗3次、5 min/次;加入鼠单克隆二抗于室温孵育30 min,PBS荡洗3次、5 min/次;辣根过氧化物酶标记液孵育15 min,PBS荡洗3次、5 min/次;DAB染色,苏木素复染,乙醇脱水,二甲苯固定,中性树胶封片。染色切片置于显微镜下,选取5个不同的观察区域检测CIRP和TLR4蛋白染色阳性细胞的数量(阳性染色的细胞在镜下可见细胞质呈弥漫性棕黄色信号),根据免疫反应评分评估染色强度和阳性细胞的比例,规定阳性细胞数≤20%、>20%分别计0、1分,染色强度无着色、淡黄色和棕黄色及以上分别计0、1及2分,合计2项得分后将0~1分定义为低表达,2~3分定义为高表达[11]。
1.3 统计学分析
所有数据使用SPSS 19.0软件进行处理。计数资料采用频数(n)、率(%)表示,组间比较采用χ2检验;采用Kaplan-Meier法对组间数据进行生存时间的比较,绘制生存曲线;采用时序检验(Log-ranktest)验证组间生存曲线的统计学差异,采用双变量相关分析进行CIRP与TLR4的相关关系分析。P<0.05为差异有统计学意义。
2 结果
2.1 CIRP及TLR4蛋白表达
免疫组织化学染色结果显示,对照组样本中没有CIRP及TLR4蛋白阳性表达的细胞,CIRP和TLR4蛋白在高分化的OSCC组织切片中阳性染色数量较少,中分化组织切片次之,低分化组织切片中阳性染色数量最多,CIRP、TLR4阳性表达细胞数量随OSCC分化程度降低而增多,见图1;研究组CIRP和TLR4蛋白阳性检出率均明显高于对照组,差异有高度统计学意义(P<0.01),见表1。
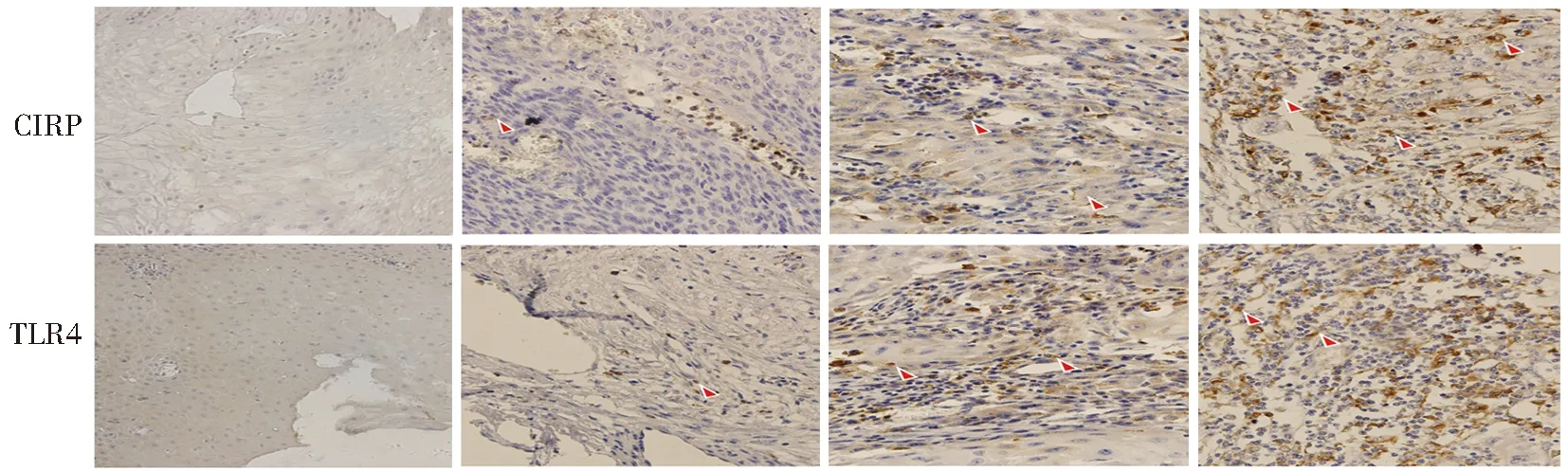
对照组 研究组高分化 研究组中分化 研究组低分化注:红色箭头处表示CIRP及TLR4蛋白染色阳性的细胞。图1 对照组和研究组口腔组织标本中CIRP及TLR4表达(免疫组织化学,×40)Fig.1 Immunohistochemical detection of CIRP and TLR4 in control group and experiment group(immunohistochemistry,×40)

表1 对照组和研究组样本中CIRP与TLR4的表达Tab.1 Expression of CIRP and TLR4 in control group and experiment group
注:(1)与对照组比较,P<0.01。
2.2 CIRP、TLR4蛋白表达与临床病理特征
OSCC组织样本中CIRP蛋白表达水平与患者的TNM分期、临床分期、组织病理学分期及淋巴结转移的差异均有统计学意义(P<0.05),但患者的性别和年龄比较差异无统计学意义(P>0.05);TLR4表达水平与患者性别、TMN分期、临床分期、组织病理学分级以及淋巴结转移的差异均有统计学意义(P<0.05),但年龄构成上差异无统计学意义(P>0.05)。见表2。
2.3 CIRP、TLR4表达与患者的预后
随访结果显示,癌组织CIRP高、低表达患者分别死亡13例和8例,癌组织TLR4高、低表达患者死亡16例和5例,Kaplan-Meier法绘制生存曲线,经Log-rankχ2检验结果显示,CIRP高表达患者术后的生存率明显低于癌组织CIRP低表达患者,差异有高度统计学意义(χ2=6.651,P=0.009),见图2A;癌组织TLR4高表达患者术后的生存率明显低于癌组织TLR4低表达患者,差异有高度统计学意义(χ2=8.473,P=0.004),见图2B。
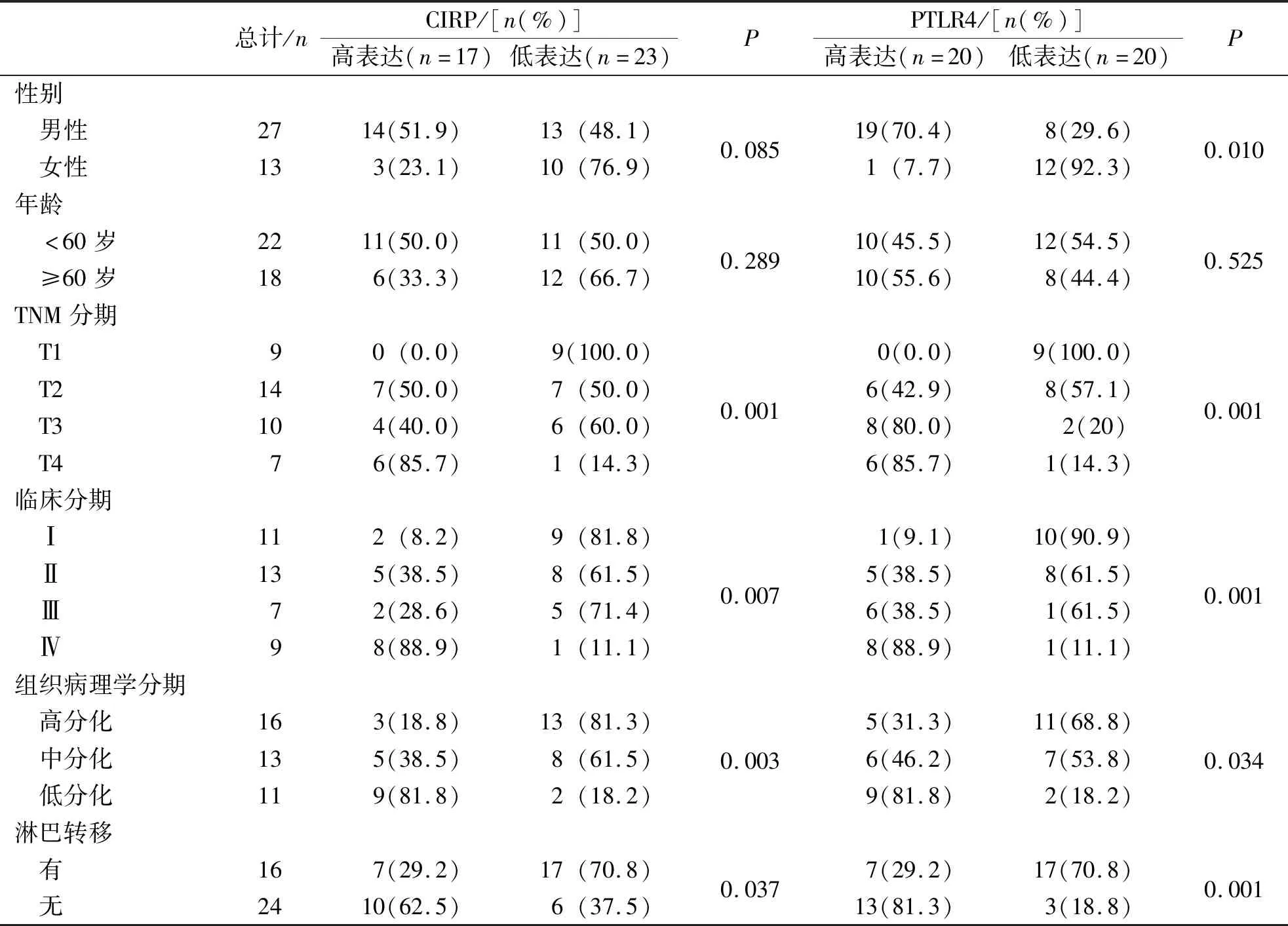
表2 CIRP和TLR4蛋白不同表达者的临床病理特征差异Tab.2 Differences in clinicopathological features of CIRP and TLR4 expression
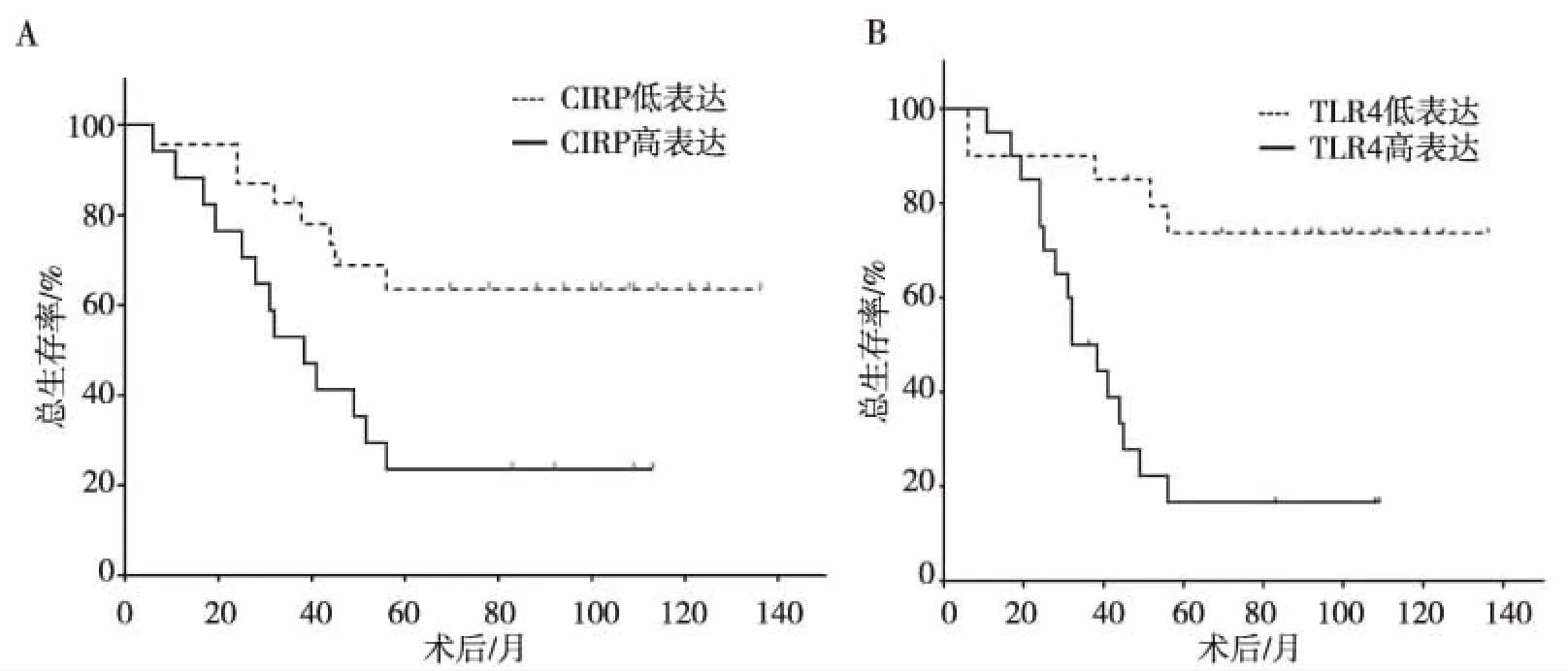
注:A为CIRP,B为TLR4。图2 CIRP和TLR4表达与患者预后的生存分析Fig.2 Survival analysis of patients prognosis
2.4 CIRP与TLR4表达的相关性
相关分析结果显示,OSCC组织中CIRP与TLR4表达之间呈正相关关系(r=0.356 8,P=0.023 8)。
3 讨论
肿瘤微环境是由成纤维细胞、内皮细胞、造血细胞和免疫细胞等一系列的间质细胞组成[12]。在很多炎症过程中产生的细胞因子可通过募集巨噬细胞(tumor-associated maerophages,TAMs),从而形成肿瘤发生的微环境[13-14]。鉴于微环境对肿瘤发生的影响往往涉及2种或多种细胞间的相互作用,其中又包含多种自分泌及旁分泌细胞因子及相关信号通路的调控,因此机制较为复杂[15-16]。有研究表明低氧状态可以刺激TAMs表达CIRP,采用免疫印迹和蛋白浓度检测发现CIRP从细胞核-胞浆-细胞外的转移过程,最终在血液中表达升高,从而诱发炎性反应[17]。也有研究表明,这些疾病发生的共同途径是通过TLR信号途径激活核转录因子-κB促进促炎因子的产生[18- 19],介导炎症反应的TLR4也普遍表达于肿瘤细胞[20]。本研究结果显示,与对照组相比,研究组中2种蛋白的阳性染色细胞数量较多,且随OSCC分化程度由高到低,2种蛋白的细胞染色数量逐渐增多。这些蛋白在不同组织中表达量的差异以及肿瘤组织中不同分化程度的表达差异支持了CIRP或TLR4基因在OSCC发生发展过程中具有一定生物学作用的假设。
TLR4在人类肺癌细胞、卵巢癌细胞和黑色素瘤细胞过表达,同时TLR4的表达水平与头颈鳞状细胞癌的分期相关[21-24]。本研究结果显示,OSCC组织样本中,CIRP或TLR4高、低表达组间TNM分期、临床分期、组织病理学分期及淋巴结转移的差异均有统计学意义(P<0.05);生存率分析结果表明CIRP或TLR4高表达组患者术后的生存率明显低于低表达组患者(P<0.01)。这些结果支持了CIRP或TLR4确实是促进OSCC肿瘤发生发展的这一假设。癌细胞的表型调控部分依赖于环境和基因组的变化,从而决定癌细胞的存活[2]。机制研究表明,CIRP的过度表达导致细胞生长速度降低和G1期延长[25];CIRP基因通过激活细胞外信号和调节激酶来保护肿瘤坏死因子A诱导的细胞凋亡[26],CIRP蛋白通过激活细胞外信号调节激酶1和2以避免经历原代细胞的衰老,其增殖率与致癌细胞相当[26];在肿瘤细胞中,TLR4基因与激活磷脂酰肌醇3-激酶/Akt途径、上调IRAK-4表达、增加血管内皮生长因子和粒细胞-巨噬细胞集落刺激因子密切关联,导致肿瘤形成[5];相比之下,TLR4基因可下调X连锁凋亡抑制蛋白和磷酸化蛋白激酶B的表达,从而消除紫杉醇对人卵巢腺癌细胞增殖和细胞周期进展的抑制作用[27]。然而,所有的研究对CIRP和TLR4调控肿瘤发生的功能之间是否相互关联的结论都不充分。本研究中患者OSSC组织CIRP与TLR4表达之间呈正相关关系(r=0.356 8,P=0.023 8),提示随鳞癌恶性程度的增高,CIRP与TLR4的表达均明显增高。提示CIRP有可能直接调节TLR4,通过多种癌症信号通路激活肿瘤,从而进一步促进肿瘤的发生发展,但有待进一步研究。
综上所述,本研究结果表明CIRP与TLR4在OSCC中呈高表达,且与患者TNM分期、临床分期、组织病理学分期、淋巴结转移以及较差的生存率有关联。

