自体脂肪基质细胞组织-脱细胞骨基质-壳聚糖支架对兔胫骨骨缺损修复作用*
杨鹏, 邵擎东**, 李宇飞, 严旭, 江峰, 吕峰霞, 韦苏
(1.中国人民解放军海军特色医学中心 骨科, 上海 200052; 2.中国人民解放军海军特色医学中心 整形外科, 上海 200052)
骨缺损是骨科的常见疾病,目前骨缺损修复的治疗方法有多种,其中骨组织工程移植修复是最新使用的修复方法,该方法是将骨髓间充质干细胞与骨架材料生物结合,将骨髓间充质干细胞转化为成骨细胞,完成骨缺损的修复[1-2]。然而骨髓间充质干细胞具有取材难、供量少、供区创伤大等缺点,这些缺点限制骨组织工程移植在骨缺损修复中的应用[3]。脂肪组织是一种具有多向分化潜能的功能细胞组织,因为脂肪组织中含有的自体脂肪基质细胞组织(SVF)[4-6],其中含有脂肪基质细胞(脂肪干细胞),其功能和骨髓间充质干细胞相似,可以分化为成骨细胞、软骨细胞等骨细胞,进而通过分泌大量骨基质因子、血管生长因子、抗凋亡因子及其他细胞因子,促进血管新生,吸引成骨前体细胞参与骨的形成,促进骨缺损部位血供恢复,最终促进骨缺损修复[7]。SVF还具有取材容易、供量丰富、供区创伤程度小等特点,推测可以将其作为骨组织工程中骨缺损移植修复治疗过程中的种子细胞。目前关于SVF用于骨缺损修复的研究报道较少,本研究以形状结构较为简单的胫骨作为骨缺损部位,复制兔胫骨骨缺损动物模型,以骨科研究应用较多的脱细胞骨基质-壳聚糖为材料制作缺损胫骨支架、将SVF种植于脱细胞骨基质-壳聚糖支架上、对缺损的兔胫骨进行修复,同时观察骨缺损部位骨膜中的血管内皮细胞生长因子(VEGF)和表皮生长因子(EGF)水平,为SVF应用于骨组织工程修复骨缺损提供实验依据。
1 材料与方法
1.1 材料
1.1.1实验动物及分组 选择21只健康的新西兰大白兔,兔龄为4个月,雌雄不限,体质量为2.0~2.5 kg,平均(2.17±0.61)kg,购买自上海斯莱克实验动物有限责任公司[SCXK(沪) 2017-0005]。动物适应性喂养1周,随机取1只用于SVF和脱细胞骨基质制备,剩余20只兔随机分为研究组和对照组,每组10只。
1.1.2主要试剂及仪器 DMEM培养基、胎牛血清、抗坏血酸、β-甘油磷酸钠、胰蛋白酶、血管内皮生长因子(VEGF)一抗、表皮生长因子(EGF)一抗(均购自美国Sigma公司),地塞米松、抗坏血酸、吲哚美辛、甲基黄嘌呤、牛胰岛素(均购自上海晶抗生物工程有限公司),倒置显微镜(日本奥林巴斯公司),生物力学实验机(上海衡翼精密仪器有限公司),低温低速离心机、石蜡切片机(德国Thermo公司)。
1.2 方法
1.2.1SVF的制备 随机取新西兰大白兔1只,耳缘静脉注射戊巴比妥钠麻醉,在兔的背部取10.0 g皮下脂肪,清除脂肪组织中的血管、结蹄组织后剪碎,于37 ℃、1 g/L的Ⅰ型胶原酶溶液中振荡60 min,待块状脂肪消化成液态,加入含有胎牛血清的培养液终止消化,200目滤网过滤,1 600 r/min离心5 min,PBS重悬;洗涤,离心弃去上清液,沉淀在红细胞裂解中振荡,离心弃去上清液;PBS清洗沉淀,加入2倍体积的且含有胎牛血清的培养液,混匀;取细胞液0.2 mL,行苔盼蓝染色,接种至培养瓶中,接种密度为1.5×104/cm2;常规条件下培养细胞,3 d更换1次培养液,当细胞融合超过90%时进行消化传代。
1.2.2脱细胞骨基质制备 将1.2.1项下兔的股骨干解剖下来,清除脂肪、血管、结蹄组织后将股骨碎裂为1.0 cm×1.0 cm×0.5 cm规格的碎骨,无菌去离子水高压冲洗碎骨。在甲醇和氯仿混合溶液(1 ∶1)中浸泡24 h,脱去骨碎块中的脂肪;将骨碎块在浓度为30%的过氧化氢溶液中浸泡48 h,脱去骨碎块中的蛋白质;将骨碎块在浓度为6.0 mol/L的盐酸溶液中浸泡5 min,脱去骨碎块中的钙质。上述步骤完成后用无菌去离子水冲洗,冷冻干燥机中干燥48 h,将骨碎块无菌粉碎,过钢筛,选取10~50 μm的骨碎块作为脱细胞骨基质。制备的脱细胞骨基质在-40 ℃条件下保存备用。
1.2.3SVF-脱细胞骨基质-壳聚糖支架制备 将脱细胞骨基质和5%壳聚糖溶液按照10 ∶1的比例混合,倒入胫骨磨具中,在-40 ℃下先冷冻2 h,然后在冷冻干燥机中干燥48 h,干燥好的脱细胞骨基质-壳聚糖支架在紫外线下照射8 h,在50 mmol/L碳化二亚胺和N羟基琥珀酰亚胺溶液中交联24 h,无菌去离子水清洗,冷冻干燥机中干燥,钴60照射灭菌,制备好的脱细胞骨基质-壳聚糖支架在-4 ℃条件下保存备用。取支架照射灭菌,完全培养液预湿处理,置入6孔板后,种植SVF细胞(种植密度为3×107个/cm2)于支架上,37.0 ℃、5.0% CO2条件下培养1.2 h后转移至含10.0%胎牛血清的DMEM培养液中,在6孔板中培养72 h,在-40.0 ℃环境中冷冻干燥,干燥后的支架复合物保存于-40.0 ℃冰箱中备用。
1.2.4兔胫骨缺损模型复制及骨缺损修复 将研究组和对照组新西兰大白兔耳缘静脉注射戊巴比妥钠麻醉,备皮,在兔一侧胫骨的中远处用消毒的电钻在暴露的胫骨平台位置钻一个9 mm×5 mm的孔洞,复制胫骨缺损动物模型。胫骨缺损模型复制完成后,研究组用制备好的SVF-脱细胞骨基质-壳聚糖支架进行修复,对照组用脱细胞骨基质-壳聚糖支架修复,缝合伤口,消毒,肌肉注射青霉素预防感染。
1.3 观察指标
取新西兰兔背部皮下脂肪制备获取SVF细胞、取股骨干制备获取脱细胞骨基质,将SVF细胞种植于脱细胞骨基质-壳聚糖支架上,于种植当日及种植第7天时,扫描电镜观察支架上SVF细胞生长情况,计算种植当日及种植第3天时的SVF细胞存活率;将20只兔胫骨缺损动物模型均分为研究组和对照组,研究组用SVF-脱细胞骨基质-壳聚糖支架修复,对照组用脱细胞骨基质-壳聚糖支架修复;于术后第6及12周时,检测2组胫骨缺损部位的骨密度、并进行X线拍照,于术后第12周时检测2组骨缺损部位最大弯曲度负荷、抗弯钢度及破坏扰度的力学特征,以内参照蛋白β-actin作为内对照,参考文献[7]检测并计算缺损骨骨膜中VEGF和EGF蛋白相对表达水平。
1.4 统计学处理
2 结果
2.1 SVF-脱细胞骨基质-壳聚糖支架的电镜扫描结果
电镜扫描显示, 脱细胞骨基质-壳聚糖支架材料呈现为疏松样多孔结构,有利于营养物质进入和各种细胞黏附,将SVF细胞接种于脱细胞骨基质-壳聚糖支架第7天时,支架上黏附大量的SVF细胞,并且SVF细胞在支架表面上生长、增殖。见图1。
2.2 SVF-脱细胞骨基质-壳聚糖支架中SVF细胞存活率
SVF种植当日的SVF细胞存活率为100.0%,种植第3天时,SVF细胞的存活率为(98.54±1.83)%,2者比较差异无统计学意义(P>0.05)。
2.3 术后胫骨缺损部位大体观察及X片结果
大体观可见研究组大白兔修复后第12周时见骨缺损区有血管孔生成,已经骨性愈合;对照组大白兔虽见骨缺损区有血管孔生成,但生成的血管孔数量少于研究组,骨缺损部位仍未完全骨性愈合。 胫骨缺损修复术后第6周及12周时,分别用X线进行拍摄缺损部位,结果显示研究组术后第6周时的骨缺损支架材料和周围骨组织之间的界限开始变的模糊,周围骨组织有骨茄形成,术后第12周时骨缺损处骨密度较第6周时显著增加,骨缺损的范围进一步缩小,凹面和周围骨床保持在同一平面上;对照组术后第6周及12周时骨缺损也有改善,但每个时间点骨缺损的改善程度均弱于研究组。见图2。

注:A为脱细胞骨基质-壳聚糖支架,B为SVF细胞种植在脱细胞骨基质-壳聚糖支架(箭头所示支架上黏附大量的SVF细胞,并且SVF细胞在支架表面上生长、增殖)。图1 SVF-脱细胞骨基质-壳聚糖支架电镜扫描结果Fig.1 SVF-acellular bone matrix-chitosan scaffold by Electron Scanning microscopy
注:A、B为对照组,C、D为研究组,A、C为修复术后第6周,B、D为修复术后第12周。图2 两组胫骨缺损修复后第6周及12周时的X片结果Fig.2 Tibial defect repair in both groups at 6th and 12th weeks by X-ray
2.4 术后胫骨缺损部位骨密度
结果显示,2组大白兔术后第12周骨缺损部位的骨密度均显著性高于术后第6周,研究组术后第6周及12周的骨缺损部位的骨密度均显著性高于同时点对照组,差异有统计学意义(P<0.05)。见表1。
表1 术后第6周及12周时2组胫骨缺损部位骨密度比较Tab.1 Comparison of bone mineral density in tibial defects in both groups at 6th and 12th
注:(1)与同组术后第6周比较,P<0.05;(2)与对照组同时点比较,P<0.05。
2.5 术后胫骨缺损部位的生物力学指标
结果显示,术后第12周时,研究组最大弯曲度负荷和抗弯钢度显著大于对照组,破坏扰度显著低于对照组,差异有统计学意义(P<0.05)。见表2。
表2 术后第12周时2组胫骨缺损部位的生物力学指标比较Tab.2 Comparison of biomechanical indexes of tibial defects at 6th and 12th
注:(1)与对照组比较,P<0.05。
2.6 术后胫骨缺损部位骨膜的VEGF和EGF蛋白表达
Western blot结果显示,术后第12周时,研究组胫骨缺损修复后骨缺损部位骨膜中的VEGF及EGF蛋白表达水平均显著高于对照组,P<0.05。见图3和表3。
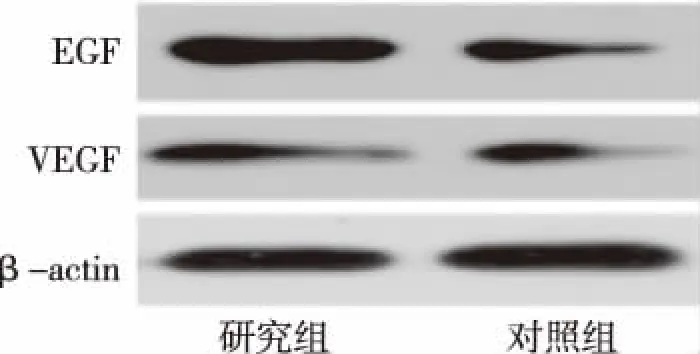
图3 术后第12周时2组新西兰兔胫骨缺损部位骨膜的VEGF和EGF蛋白表达Fig.3 Expression levels of VEGF and EGF in periosteum of tibia defect in New Zealand rabbits at 6th and 12th weeks
表3 术后第12周时2组胫骨缺损部位骨膜的VEGF和EGF蛋白相对表达水平Tab.3 Expression levels of VEGF and EGF in tibia defect in New Zealand rabbits
注:(1)与对照组比较,P<0.05。
3 讨论
骨缺损是骨科的常见疾病,如缺损骨得不到有效修复,轻者严重降低患者胫骨功能,重者将面临截肢。目前用于骨缺损修复的方法有多种,传统的修复方法有自体骨移植、异体骨移植、假体材料填充等,虽然上述方法的修复效果有效,但上述修复方法中所用到的修复材料没有细胞活性,将修复材料移植至骨缺损部位后,需要自身的成骨细胞缓慢的向骨缺损部位和修复材料上转化为新生骨[8-10]。上述骨缺损修复方法对于骨缺损小的情况,修复效果尚可以达到预期,但对于骨缺损大的情况,则很难收到预期的修复效果。近年来骨组织工程技术得到快速的发展。使用含有活细胞修复材料修复骨缺损的技术已经用于多种骨缺损的修复治疗,且修复效果十分理想[11-12]。利用骨组织工程技术修复骨缺损的一个重要环节是将具有分化为成骨细胞的干细胞接种至修复支架材料上,当修复支架材料移植至骨缺损部位后,修复支架材料上的干细胞可以快速的增殖分化为成骨细胞,修复速度和效果好于传统的修复方法[13-14]。目前接种至修复支架材料上的干细胞主要是骨髓间充质干细胞,然而这种来源的干细胞具有取材难、供量少、供区创伤大等缺点,限制了骨组织工程技术在修复骨缺损的应用。
脂肪组织是一种具有多向分化潜能的功能细胞组织,脂肪组织的这种功能主要是因为脂肪组织中含有SVF[15-16]。SVF具有很好的体外扩增和多克隆的能力,可以诱导分化为成骨细胞[17-18]。SVF的这一特性,使其具有干细胞的功能,推测其可以作为接种值修复支架材料上的细胞。另外SVF具有取材容易、供量丰富、供区创伤程度小等优点。可以替代骨髓间充质干细胞,可作为骨组织工程中骨缺损移植修复治疗过程中的种子细胞。在本研究中将从兔脂肪组织中制备而来的SVF接种至脱细胞骨基质-壳聚糖支架上,种植第7天时支架上黏附大量的SVF细胞,并且SVF细胞在支架表面上生长、增殖。说明SVF在脱细胞骨基质-壳聚糖支架材料上具有良好的生物相容性,脱细胞骨基质-壳聚糖支架具备的骨缺损修复材料的基础和特性。SVF-脱细胞骨基质-壳聚糖支架移植至兔胫骨缺损部位,术后骨缺损的支架材料和周围骨组织之间的界限开始变的模糊,周围骨组织有骨茄形成,骨缺损的范围进一步缩小,骨缺损部位的骨密度逐渐升高,生物力学检测指标逐渐改善,随着术后时间的延长,骨缺损修复的效果越来越好。说明使用应用SVF-脱细胞骨基质-壳聚糖支架修复兔胫骨缺损收到良好的修复效果。
骨膜在骨缺损修复的过程中起到重要作用,骨膜内含有丰富的血管,这些血管为骨的增生提供氧气、营养物质,使骨膜中的成骨细胞具有造骨细胞的功能[19-21]。VEGF和EGF是2种重要的具有促进血管新生的因子,参与血管内皮细胞的增殖分化以及新生血管的形成,机体中2者水平的高低与新生血管的生成速度呈正相关[22-23]。有研究表明SVF细胞具有促进血管新生的作用[24-25]。本研究检测了2组大白兔术后第12周时骨缺损部位的新生骨膜中的VEGF和EGF蛋白表达水平,结果显示使用SVF-脱细胞骨基质-壳聚糖之间修复的研究组新生骨膜中的VEGF和EGF蛋白表达水平显著高于仅使用脱细胞骨基质-壳聚糖支架修复的对照组,说明SVF-脱细胞骨基质-壳聚糖支架修复兔胫骨缺损时促进骨膜中的血管新生,为骨缺损的修复提供营养物质。
综上所述,使用SVF-脱细胞骨基质-壳聚糖支架修复兔胫骨骨缺损可以收到显著的效果,SVF不但可以分化为成骨细胞而且还可以促进骨膜内的血管新生。

