不同构型吉法酯对干眼症大鼠角膜的保护作用*
糜玲, 周波, 李永, 彭金刚, 汤磊, 黄家宇
(1.贵州医科大学 药学院 药物分析教研室, 贵州 贵阳 550004; 2.贵州省化学合成药物研发利用工程技术研究中心, 贵州 贵阳 550004)
干眼症又称干燥性角膜结膜炎,是多种因素所致的一种泪液和眼表疾病,包括眼表不适症状、视力变化和泪膜不稳定,并且伴有潜在的眼表损害,是眼科中发病率最高的眼表疾病之一[1-2]。目前干眼症的治疗多为人工泪液替代疗法,临床常用的人工泪液大多仅补充水液层,个别制剂中添加了脂质成分以降低泪液蒸发,改善黏蛋白功能的人工泪液国内尚无上市产品,目前国外进入临床研究的主要是P2Y2受体激动剂(如地夸磷索四钠滴眼液)和黏蛋白分泌激动剂(包括瑞巴派特和吉法酯)2大类[3-4]。吉法酯,商品名惠加强-G,是一种黏蛋白分泌激动剂,临床上用于胃黏膜保护剂,还可以在干眼症中发挥治疗作用[5-7]。市售吉法酯为4Z构型吉法酯和4E构型吉法酯2种异构体的混合物[8],但是哪一个构型的吉法酯在干眼症的治疗作用中起主要作用尚不明确。因此,本研究通过建立干眼症大鼠动物模型,使用Shirmer I方法测量大鼠泪液分泌体积、角膜荧光素钠染色评价角膜光滑度、苏木精-伊红(hematoxylin-eosin, HE)染色法观察角膜形态学及过碘酸雪夫氏(periodic acid-Schiff, PAS)染色法计数结膜杯状细胞数量,探讨4Z、4E吉法酯及混合型吉法酯对干眼症大鼠角膜的保护作用。
1 材料与方法
1.1 材料
1.1.1动物及分组 6周龄的雌性Wistar大鼠40只,体质量160~180 g,购自重庆腾鑫生物技术有限公司。在各12 h明暗周期、温度22 ℃、湿度40%~50%的饲养室饲养1周适应后,随机分为正常组、生理盐水对照组、4Z吉法酯治疗组(4Z组)、4E吉法酯治疗组(4E组)和混合吉法酯治疗组(混合组,4Z ∶4E=30 ∶70),每组8只。
1.1.2药物和试剂 4Z构型和4E构型吉法酯由贵州医科大学药物化学重点实验室汤磊教授课题组制备(纯度大于98%),东莨菪碱氢溴酸盐购自上海泰坦科技股份有限公司(批号P1231580),荧光素钠购自美国Sigma公司(批号46960-100G-F),泪液检查酚红棉线购自天津晶明新技术开发有限公司(批号20161201),HE染色试剂盒(批号G1120)和PAS糖原染色试剂盒(批号G1281)购自北京索莱宝科技有限公司。
1.1.3仪器 SLM-2ER型眼科裂隙灯显微镜检查仪购自重庆康华瑞明科技股份有限公司,NIKON TS100型倒置相差显微镜购自日本Nikon公司,RM2235型石蜡切片机购自德国Leica公司。
1.2 实验方法
1.2.1干眼症动物模型 除正常组外,其余各组大鼠皮下注射6 g/L东莨菪碱氢溴酸盐,4次/d(9时、12时、15时和18时)、0.5 mL/次,连续给药28 d[9-10];期间用风扇增强室内空气对流,除湿机控制空气相对湿度为30%~40%[11]。
1.2.2给药方案 各治疗组大鼠分别使用10 g/L相应构型吉法酯滴眼液治疗 ,5次/d(9时、11时、13时、15时及17时)、每只眼睛20 μL/次,连续治疗14 d;正常组和生理盐水组大鼠用同体积的生理盐水于相同时间点滴眼。
1.2.3Shirmer I试验 于治疗前、治疗第7及14天腹腔注射水合氯醛麻醉大鼠,待角膜反射消失后,将酚红棉线在距离外侧角约1/3处的下穹窿中放置30 s后拔出,记录棉线红色部分长度(mm)来代表大鼠泪液体积的分泌量[12]。
1.2.4角膜荧光素钠染色评分 每次Shirmer I试验结束后,每只眼睛滴入0.01%荧光素钠5 μL,3次人工眨眼后在裂隙灯下用钴蓝光观察荧光素钠着色情况并拍照。将眼表分为4个象限,每个象限根据染色情况评分,具体评分标准是无染色为0分,分散、点状染色为1分,成群点状染色为2分,成片状染色为3分;4个象限评分总和为该鼠的角膜染色评分[13-14]。
1.2.5HE染色 治疗第14天时,麻醉后冰上处死大鼠,立即摘除左右眼球,置固定液保存于4 ℃;常规石蜡脱水,进半苯半蜡前沿角巩膜缘剪开眼球并去除玻璃体,常规石蜡包埋,平行于眼轴作6 μm连续切片,烤片后石蜡切片脱蜡至水,放入苏木精染料10 min后蒸馏水清洗3次,伊红染料5 min后常规脱水封片,显微镜下观察角膜组织形态并拍照。
1.2.6PAS染色 石蜡切片常规脱蜡后蒸馏水浸泡10 min,按照PAS糖原染色试剂盒说明书步骤对切片进行染色后,梯度酒精脱水,二甲苯透明后树胶封片,每个切片在显微镜下取3个视野计数杯状细胞、取平均,并拍照。
1.3 统计学分析
2 结果
2.1 泪液体积
治疗前,各治疗组大鼠与生理盐水组之间泪液体积比较差异均无统计学意义(P>0.05);治疗第7天时,4E组和混合组大鼠的泪液体积大于生理盐水和4Z组大鼠,差异均有统计学意义(P<0.01或P<0.05);治疗第14天时,各组大鼠的泪液体积均略有所升高,各治疗组泪液体积明显高于生理盐水组大鼠(P<0.01),但同期各治疗组大鼠之间差异均无统计学意义(P>0.05)。见图1。
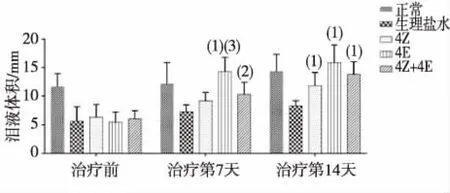
注:与同期生理盐水组比较,(1)P<0.01,(2)P<0.05;(3)与同期4Z组比较,P<0.01。图1 各组大鼠泪液体积的比较Fig.1 Tear volume of rats in each group after treatment
2.2 角膜荧光素钠染色评分
治疗前,各治疗组大鼠与生理盐水组之间角膜荧光素纳染色评分比较,差异均无统计学意义(P>0.05);治疗第7天时,4E组大鼠角膜荧光素纳染色评分低于与生理盐水组(P<0.05),其余治疗组与生理盐水组比较,差异无统计学意义(P>0.05);治疗第14天,各治疗组大鼠角膜荧光素纳染色评分明显低于生理盐水组(P<0.01),但各治疗组之间差异均无统计学意义(P>0.05)。见图2。

注:与生理盐水组相比,(1)P<0.05,(2)P<0.01。图2 各组大鼠角膜荧光素钠染色评分Fig.2 Difference of corneal fluorescein sodium staining score in each group of rats
2.3 HE染色
与正常组大鼠比较,生理盐水组大鼠角膜上皮细胞略有增厚,各层细胞分层不明显,细胞体积变大、排列不紧密、核间距较大,部分基底层细胞缺失出现空泡,且上表层细胞有脱落现象,越靠近角膜表面细胞逐渐变成鳞状上皮细胞;与生理盐水组大鼠相比,各治疗组大鼠角膜的病理变化有一定程度减轻,即细胞排列变得紧密,核间距减小,鳞状上皮细胞减少;4Z组大鼠的角膜表皮上层细胞变得光滑,基底层细胞还有部分空泡出现;4E组和混合组上层细胞细胞排列最为规则,且基底层排列紧密无空隙。见图3。

注:A为正常组,B为生理盐水组,C为4Z组,D为4E组,E为混合组。图3 治疗第14天时各组大鼠角膜形态学改变(HE,×200)Fig.3 Difference of HE staining in cornea of rats in each group(HE,×200)
2.4 PAS染色及杯状细胞计数
PAS梁色结果显示,杯状细胞分布于结膜的上皮细胞层,染色后呈玫红色(箭头所指出),可分泌黏蛋白润湿角膜和结膜、保护眼表,与正常组大鼠相比,生理盐水组大鼠结膜杯状细胞明显减少(见图4)。杯状细胞计数结果显示,各治疗组大鼠结膜杯状细胞数量分别高于生理盐水组大鼠,差异均有统计学意义(P<0.05或P<0.01);4E组和混合组大鼠杯状细胞数量均高于4Z组,差异均有统计学意义(P<0.05)。见图5。

注:A为正常组,B为生理盐水组,C为4Z组,D为4E组,E为混合组;箭头所示为杯状细胞。图4 治疗第14天时各组大鼠PAS染色(200×)Fig.4 The difference of PAS staining among different groups of rats(200×)

注:与生理盐水组比较,(1)P<0.05,(2)P<0.01;(3)与4Z组比较,P<0.05。图5 治疗第14天时各组大鼠杯状细胞计数Fig.5 Goblet cell counts in each group of rats
3 讨论
干眼症是一种眼表自身免疫性疾病,目前尚无特效治疗药物,影响超过35%的人群,其核心病变是因泪液长期质或量的改变引起泪膜不稳定而导致的眼表损伤[12]。泪膜是位于角膜前端的一层泪液薄膜,由具有润湿和清洁眼表作用的泪液组成,正常人眨眼时泪液就会均匀分布于眼表形成泪膜,任何原因引起泪膜的不稳定均会引起眼表疾病[13]。干眼症患者由于长时间的泪液缺失会引起眼表一系列的变化,角膜荧光素钠染色能直观反映眼表损伤情况,HE染色可以观察角膜上皮细胞的形态学改变。本次研究结果显示,与正常组大鼠相比,造模组大鼠由于药物和环境的影响,从第7天开始泪液明显减少,持续干扰第14天时能观察到角膜荧光素钠染色评分明显升高,同时通过HE染色可观察到角膜上皮细胞鳞状化生,严重时可见上皮细胞脱落。眼表给予不同构型吉法酯治疗后,角膜荧光素钠染色和HE染色结果都显示吉法酯能明显改善干眼症大鼠的眼表损伤情况,且4E吉法酯优于4Z吉法酯。这与泪液体积的结果相互印证,各构型吉法酯对干眼症大鼠都有保护作用,且4E构型吉法酯治疗后第7天疗效明显,4Z构型吉法酯治疗第14天时才能发挥比较好的治疗效果。
黏蛋白是一类大分子糖化蛋白分泌细胞,主要是参加角膜上皮细胞防御机制,固定泪膜水液层,防止泪液水分流失,使其形成凝胶,从而达到稳定泪膜的作用[14]。已有研究显示干眼症患者通常伴随着结膜杯状细胞内部总量和分布的变化,其缺失可以导致黏蛋白分泌减少,引起泪膜不稳定[15];眼表上皮细胞分泌产生膜结合型黏蛋白,与分泌性黏蛋白形成保护、润滑眼表的亲水性屏障,有助于泪液的稳定性以及保持泪膜的亲水性[16-17]。黏蛋白主要就是由结膜杯状细胞分泌,PAS染色结果显示,2种吉法酯在治疗第14天后都能增加干眼症大鼠的结膜杯状细胞数量(P<0.05),且4E治疗组的杯状细胞数量多于4Z治疗组及混合治疗组(P<0.05),与4Z吉法酯和混合吉法酯相比,4E构型吉法酯能更好地增强干眼症大鼠泪膜稳定性。这种构型差异带来的药效差异可能是因为药物分子的双键或刚性或半刚性结构导致分子内自由旋转受到限制而产生的,药物结构中的某些官能团在空间排列上出现差异,几何异构体空间结构上的差异均可影响药物分子的理化性质,导致药物分子在生物体中吸收、分布和代谢产生差异、最终导致药理药效的不同 。
综上所述,4Z、4E及混合式吉法酯都能对干眼症大鼠在增加泪液体积、降低眼表损伤和增加结膜杯状细胞数量等方面有不同程度的保护,且4E构型吉法酯在增加泪液体积和减少角膜荧光素钠染色评分方面明显优于4Z构型吉法酯,对吉法酯的使用具有指导意义。

