慢病毒载体对MDA-MB-231细胞中microRNA-18a-3P表达的影响*
王立斌,王丹妮,马荣,张旭,田进海,李晓菡,冯惠敏,马芳
(1.宁夏医科大学总医院 生物芯片工程研究中心,宁夏 银川 750004,2.宁夏医科大学临床医学院,宁夏 银川 750004)
MicroRNAs(miRNAs)是一类内源性非编码RNA,与mRNA 的3’-UTR 结合,调控mRNA 的表达,影响细胞的基因转录、翻译及表观遗传等环节,参与肿瘤细胞的发生、发展[1]。miR-18a 是一个新的肿瘤相关miRNA。有文献报道miR-18a 能通过调控多种靶基因影响肿瘤细胞的功能[2-4]。miR-18a 在形成过程中存在2 种形式,即miR-18a-3P 和miR-18a-5P,目前已有关于miR-18a-5P 在肿瘤发生中作用的研究报道,而miR-18a-3P 与肿瘤的关系很少报道[5]。本研究通过建立miR-18a-3P 慢病毒载体,鉴定其在人乳腺肿瘤细胞系MDA-MB-231 中的表达,为研究miR-18a-3P 对乳腺癌发生、发展的影响及探究机制奠定实验基础。
1 材料与方法
1.1 细胞株和主要试剂、仪器
人乳腺癌细胞系MDA-MB-231 购自美国典型培养物保藏中心,大肠杆菌菌株DH5α、慢病毒载体GV369 和GV280 及Polybrene 购自上海吉凯基因有限公司,DMEM 细胞培养液、标准胎牛血清(fetal bovine serum,FBS)购自美国Gibco 公司;PrimeScript®RT reagent Kit、SYBR®Premix Ex Taq ™ Ⅱ及Premix Ex Taq®Version2.0 等购自日本TaKaRa 公司,Trizol 试剂购自美国Invitrogen 公司,1 kP DNA Ladder Marker购自美国Fermentas 公司,限制性内切酶Age Ⅰ、Nhe Ⅰ及EcoR Ⅰ购自美国NEB 公司,质粒抽提试剂盒购自德国Qiagen 公司,U6、miR-18a-3P 引物合成及质粒测序由上海生工生物工程有限公司完成。二氧化碳CO2细胞培养箱购自美国Thermo 公司,超净工作台购自新加坡艺思高科技有限公司,台式细胞离心机购自德国Eppendorf 公司,倒置荧光显微镜购自德国LEICA 公司;Light Cycler480 Ⅱ型qRT-PCR 仪购自美国Roche 公司。以不转染病毒载体作为空白对照组,转染病毒空载体作为阴性对照组,将转染的miR-18a-3P 作为miR-18a-3P 转染组。
1.2 miR-18a-3P 干扰与过表达慢病毒载体的 构建
1.2.1 引物合成及目的基因片段获取 为构建miR-18a-3P 过表达慢病毒载体,首先通过miRbase 数据库查找miR-18a-3P 成熟引物序列,依据序列组成设计合成引物,其中包含交换配对碱基、酶切位点及用于PCR 扩增microRNA 的5'端部分序列。所采用的过表达载体为上海吉凯公司的慢病毒载体GV369,元件顺序为Ubi-MCS-SV40-EGFP-IRES-puromycin。构建miR-18a-3P 干扰表达慢病毒载体为GV280,载体的元件顺序为hU6-MCS-Ubiquitin-EGFP-IRESpuromycin。经查询和确认,所设计反向互补序列分别合成2 段寡聚核苷酸,其上游为5'-,其下游把合成的引物用ddH2O 在90℃水浴中溶解稀释,室温自然冷却。抽提人乳腺癌MDA-MB-231 细胞的基因组DNA,并以此为模板用上述引物,PCR 扩增miR-18a-3P,分别以限制性内切酶Age Ⅰ/Nhe Ⅰ和Age Ⅰ/EcoR Ⅰ酶切收集目的基因片段。
1.2.2 载体的构建与鉴定 分别用限制性内切酶Age Ⅰ/和Nhe Ⅰ在37℃条件下酶切载体GV369,在37℃条件下,用限制性内切酶Age Ⅰ/和EcoR Ⅰ酶切载体GV280,3 h 后获得酶切后的线性载体。然后将1.2.1 中获得的目的基因片段移入线性表达载体,以1 ∶2 的摩尔比将线性载体DNA 和纯化的PCR 产物混合,16℃条件下孵育6 h,使其充分反应。将上述连接产物转化入感受态细胞,在含有Amp 的LB 固体培养基平板上均匀涂布,37℃过夜孵育,挑取阳性的单克隆菌落,用PCR 进行菌落鉴定,并取菌液测序,选择PCR 鉴定阳性的克隆与测序结果,并进行对比 分析。
1.2.3 慢病毒包装与浓缩 采用三质粒共转染293T细胞的方法进行病毒包装,用质粒抽提试剂盒分别提取GV 载体质粒、pHelper1.0 载体质粒和pHelper 2.0载体质粒DNA,将提取的质粒DNA 溶于无菌TE 中,测定其浓度及纯度,确认质粒DNA 的纯度(A260/A280)在1.8~2.1。消化处于对数生长期的293T 细胞,接种于10 cm3细胞培养皿中培养,待细胞融合度达60%~70%时,更换为无血清培养基,继续培养2 h 后,缓慢滴加含GV 载体质粒20μg、pHelper 1.0载体质粒15μg、pHelper 2.0 载体质粒10μg 及一定体积转染试剂的混合液,继续在培养箱中培养6 h 后,弃去转染混和液后用PBS 液清洗1 遍,加入10%血清培养基继续培养,分别于48 和72 h 收集培养细胞上清液,4℃、12 000 r/min 离心10 min,除去细胞碎片;0.45μm 过滤后,4℃、25 000 r/min 离心2 h,弃上清,加病毒保存液,分装,-80℃保存。
1.2.4 病毒滴度测定 取3 个无菌Ep 管,依次编号1、2、3,每管均加入无血清培养基90μl,在1 号管内加入10μl 待测原液病毒,吹打混匀后取10μl 加入到2号管中;2 号管再吹打混匀后取10μl 加入到3 号管。1 号管内加入10μl 病毒原液,计为1E+1μl;2 号管中进行第1 次10 倍稀释,所得病毒原液为1 号管中的1/10,计为1E+0μl;3 号管中进行第2 次10 倍稀释,计为1E-1μl。将293T 细胞按1×105个/孔接种于96 孔板,细胞培养箱中培养12 h,待细胞融合度达60%时,弃培养基,加入90μl 上述稀释好的病毒,继续培养24 h,再添加完全培养基100μl,48 h 后荧光显微镜下观察荧光亮度并拍照。根据绿色荧光蛋白的表达量计算病毒滴度,病毒滴度=荧光细胞数/原液病毒数。
1.3 感染复数
MDA-MB-231 细胞按1×104个/孔接种至96 孔板中,共接种8孔。将慢病毒稀释后分别加入其中4孔,使其感染复数(multiplicity of infection,MOI)值分别为0、5、10 及20;另外4 孔在加入相应浓度病毒的同时,还添加1μg/ml Polybrene。转染12 h 后,将上层培养基吸除,添加新鲜培养基,继续培养48 h,荧光显微镜下观察并拍照。通过对细胞感染效果的评估,明确MDA-MB-231 细胞的感染条件并计算MOI。
1.4 稳定转染细胞株筛选
MDA-MB-231 细胞按1×105个/孔接种于6 孔板中,37℃、5%CO2培养箱中培养24 h,待细胞密度达50%时病毒转染。先将6 孔板中细胞上清液吸除,每孔中加入1 ml 无血清培养基配制的转染液,培养24 h,待病毒转染进细胞后吸除转染液,加入含1μg/m1 嘌呤霉素培养基继续培养,隔天更换1 次培养基,3 或4 d 后即可获得能稳定传代的转染细胞,经传代培养后,分别冻存同一批次的各组细胞5 支备用。
1.5 miR-18a-3P 在稳定转染细胞株中的表达
取稳定转染的MDA-MB-231 细胞,按照miR Neasy Mini Kit 试剂说明书提取细胞总RNA。使用microRNA cDNA Synthesis Kit 试剂盒将各细胞总RNA逆转录成cDNA,逆转录反应体系内共加入200 ng 总RNA,置于-80℃储存备用。取cDNA 行qRT-PCR:94℃预变性2 min,92℃变性20 s,56℃退火30 s,72℃延伸45 s,共30 个循环,72℃继续延伸7 min。用2-△△CT法计算各基因的相对表达量。见表1。
1.6 统计学方法
数据分析采用SPSS 23.0 和GraphPad Prism6 统计软件。计量资料以均数±标准差(±s)表示,比较用方差分析,进一步两两比较用LSD-t检验,P<0.05为差异有统计学意义。
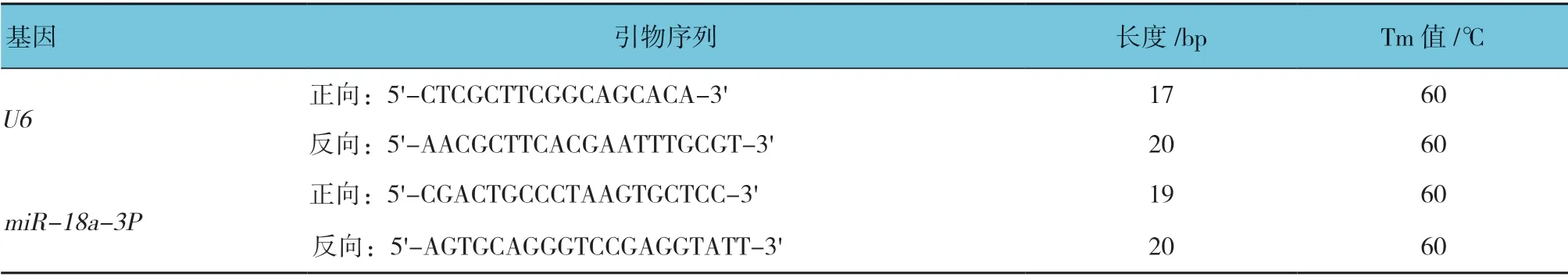
表1 qRT-PCR 的引物序列
2 结果
2.1 miR-18a-3P 慢病毒载体的构建及测序结果
将miR-18a-3P 过表达及干扰慢病毒载体GV369和GV280(见图1A、B)。将筛选出来的阳性重组克隆菌落挑于液体LB 培养基中扩增培养,提取质粒后进行测序分析,并与miR-18a-3P 反向互补序列比对,结果完全匹配,未见碱基缺失或突变等异常(见 图1C、D)。
2.2 慢病毒滴度测定
构建好的miR-18a-3P 过表达慢病毒滴度为2×109TU/ml,miR-18a-3P 干扰慢病毒滴度为1× 109TU/ml。见图2、3。
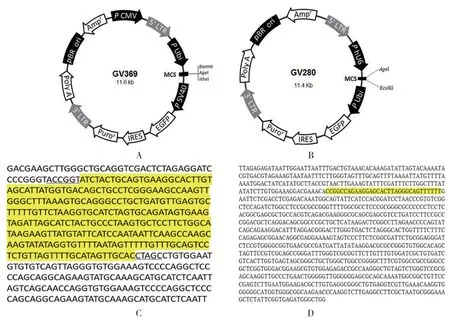
图1 GV369 和GV280 载体结构及测序
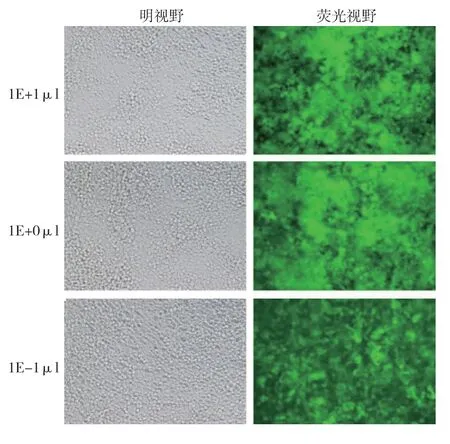
图2 过表达慢病毒荧光法滴度测定 (×100)
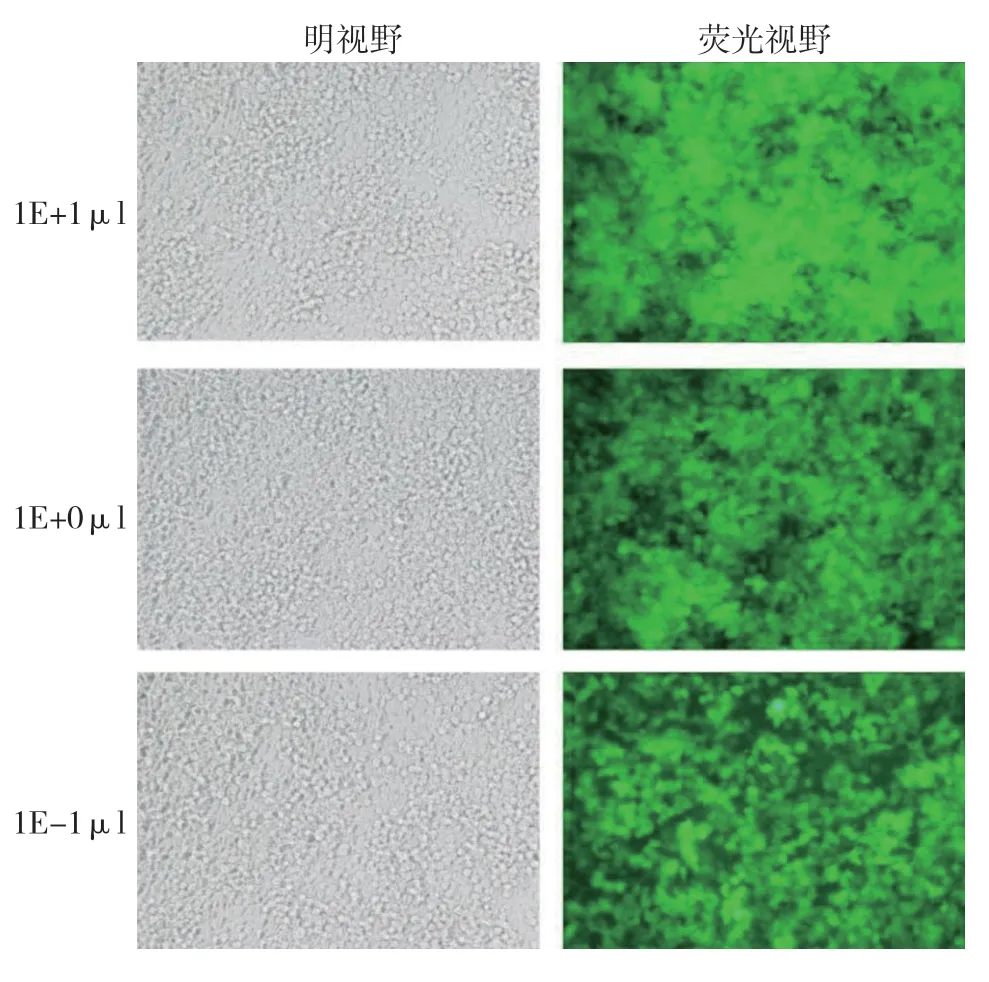
图3 干扰表达慢病毒荧光法滴度测定 (×100)
2.3 稳定过表达和干扰的MDA-MB-231 细胞系建立及载体MOI 值测定
miR-18a-3P 过表达及干扰慢病毒载体感染MDA-MB-231 细胞48 h 后,当MOI 值为10 TU/ml,Polybrene 浓度为1μg/ml 时,转染效率最高,且效 率>80%,筛选后得到满意的目的细胞。见图4~7。
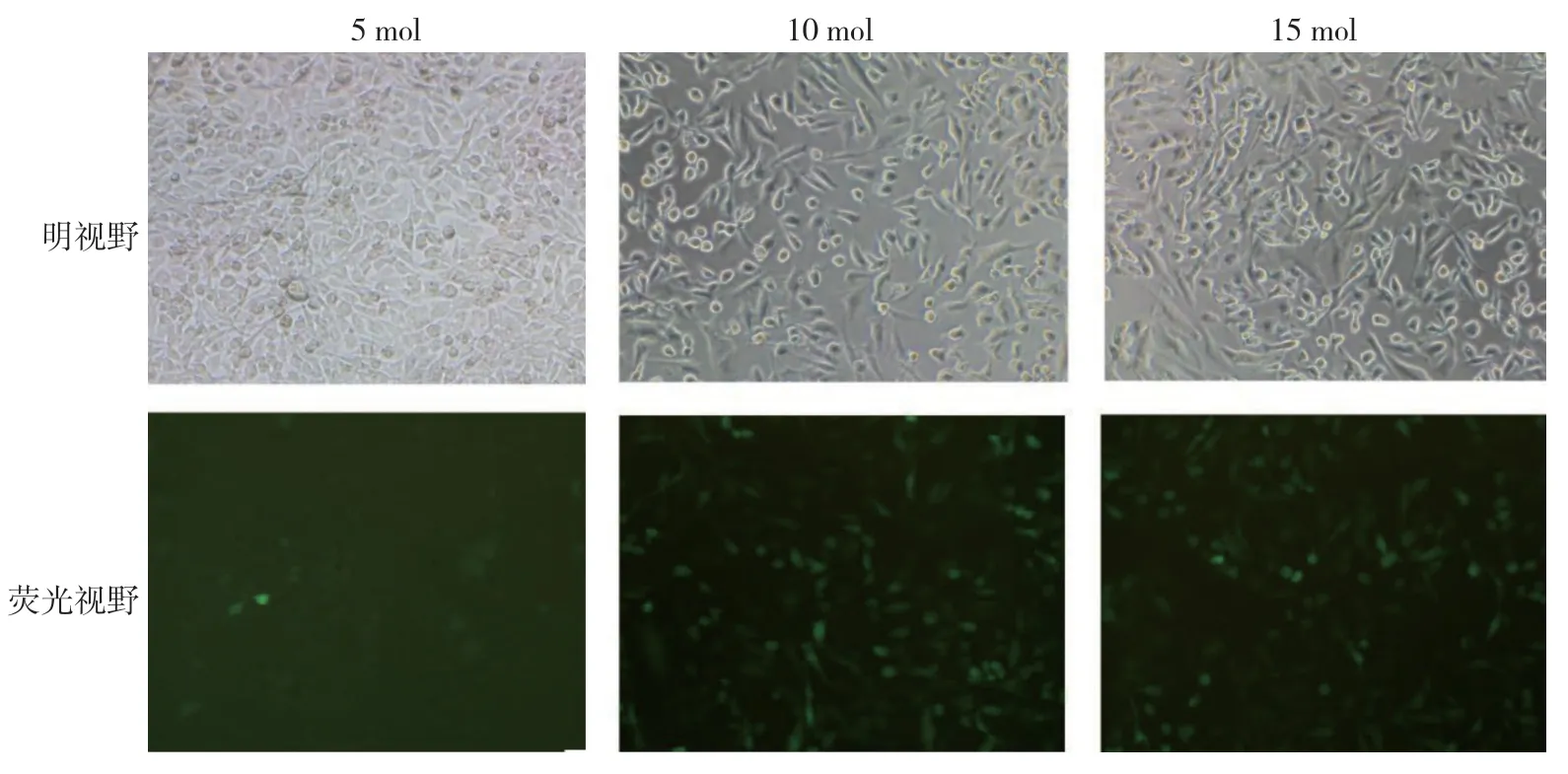
图4 MDA-MB-231 细胞未加Polybrene 时miR-18a-3P 过表达载体感染 (光镜×100)
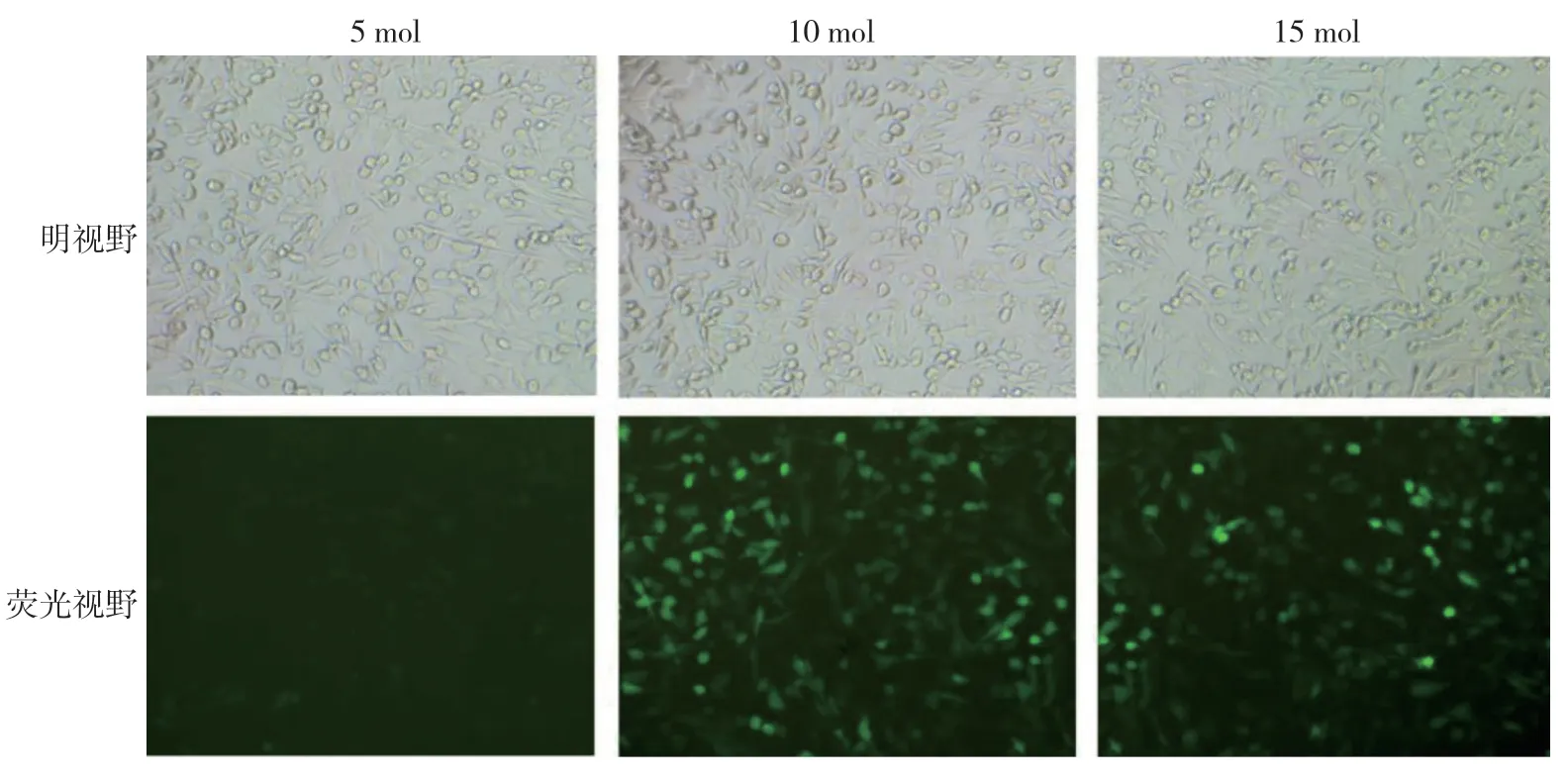
图5 MDA-MB-231 细胞加Polybrene 后miR-18a-3P 过表达载体感染 (光镜×100)
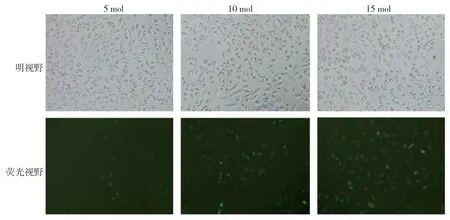
图6 MDA-MB-231 细胞未加Polybrene 时miR-18a-3P 干扰载体感染 (光镜×100)

图7 MDA-MB-231 细胞加Polybrene 后miR-18a-3P 干扰载体感染 (光镜×100)
2.4 各组miR-18a-3P 相对表达量比较
miR-18a-3P 过表达慢病毒载体转染后,各组miR-18a-3P 相对表达量比较,经方差分析,差异有统计学意义(P<0.05),miR-18a-3P 转染组较其他两组高(P<0.05)。miR-18a-3P 干扰表达慢病毒载体转染后,各组miR-18a-3P 相对表达量比较,经方差分析,差异有统计学意义(P<0.05),miR-18a-3P 转染组较其他两组低(P<0.05)。见表2和图8、9。
表2 各组miR-18a-3P 相对表达量比较 (±s)
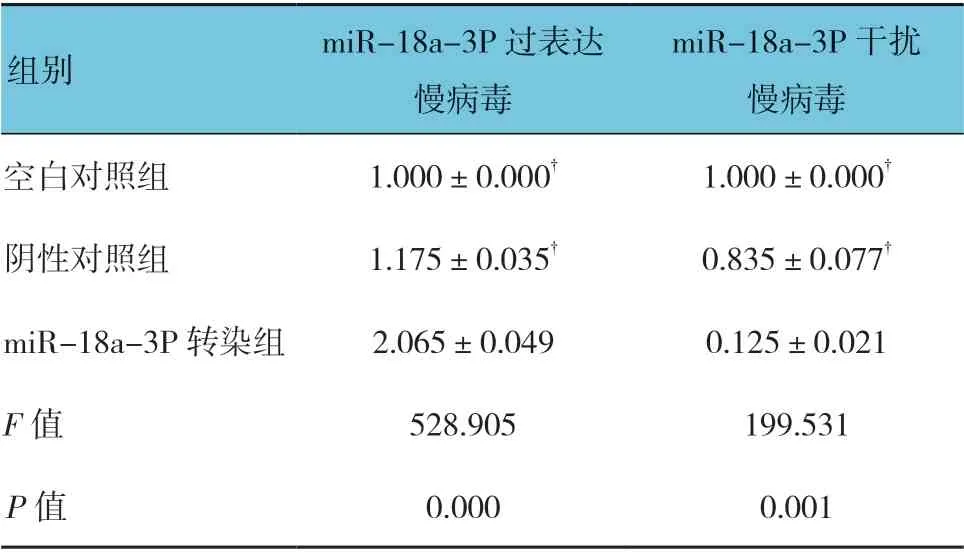
表2 各组miR-18a-3P 相对表达量比较 (±s)
注:†与miR-18a-3P 转染组比较,P <0.05。
miR-18a-3P 干扰 慢病毒空白对照组 1.000±0.000† 1.000±0.000†阴性对照组 1.175±0.035† 0.835±0.077†miR-18a-3P 转染组 2.065±0.049 0.125±0.021 F 值 528.905 199.531 P 值 0.000 0.001组别 miR-18a-3P 过表达慢病毒
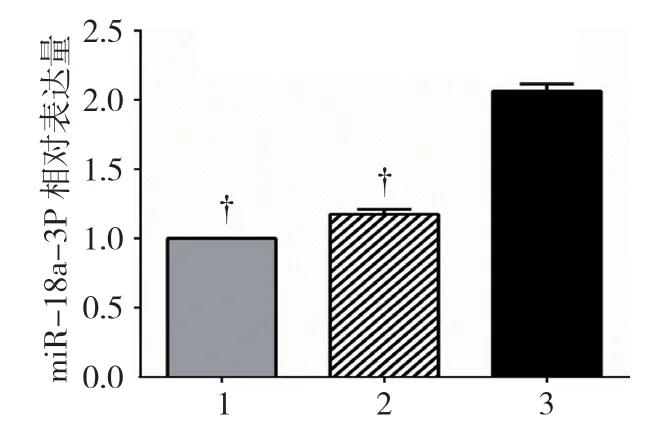
图8 各组过表达miR-18a-3P 慢病毒载体转染MDAMB-231 细胞后miR-18a-3P 的相对表达量比较 (±s)

图9 各组干扰表达miR-18a-3P 慢病毒载体转染MDAMB-231 细胞后miR-18a-3P 的相对表达量比较 (±s)
3 讨论
miRNA 是存在于多种真核细胞生物中的一类单链非编码RNA 分子,多数miRNA 由大约70 个碱基组成的发夹结构RNA 前体经过Dicer 酶酶切加工形成。miRNA 前体在酶切过程中可以产生2 条有功能的成熟miRNA,以miRNA-5p 和miRNA-3p 命名[6]。miRNA通过与其靶基因配对,诱导靶基因mRNA降解,抑制mRNA 的翻译。这种调控是多向发生的,一个miRNA 可以调控多个mRNA 的表达,多个miRNA 也可以分别与同一个mRNA 序列结合[7-8]。由于存在调控方式和结合位点的多样性,miRNA 在基因转录、翻译及表观遗传等环节调控基因组表达,参与肿瘤细胞增殖、转移等过程[9]。
miR-18a 属于miR-17-92 基因簇,通常与抑癌基因GUGC 序列结合发挥作用[10]。现已发现miR-18a与多种疾病相关,RAO 等[11]证实四氢大麻酚通过调节miR-17-92 簇和诱导T 细胞,减轻葡萄球菌肠毒素B 刺激的小鼠炎性肺损伤,并防止死亡。MAO 等[12]证实在2 型糖尿病引起的脑损伤患者血清中,S100 蛋白和内皮素-1 等生化指标的升高与miRNA-18a 表达下调有关。YAU 等[13]发现miR-18a 的表达与非侵袭性结直肠肿瘤的发展密切相关,认为miRNA-18a 可以成为诊断结直肠癌的一个潜在生物标志物。在乳腺肿瘤研究中,FAN[14]、KRUTILINA 等[15]和QI 等[16]发现,miR-18a 可通过干扰缺氧诱导因子1α 亚基和调控mTOR 信号通路的表达,增强乳腺癌细胞凋亡及自噬的比率。
2 种对miR-18a 存在形式的研究中,目前只有关于miR-18a-5p 与肿瘤关系的文献报道,LIANG 等[5]发现miR-18a-5p 在非小细胞肺癌组织中高表达,并通过抑制干扰素调节因子-2 的表达,抑制非小细胞性肺癌细胞自噬,并促进肿瘤细胞增殖和转移。LU 等[17]证实miR-18a-5p 通过抑制IRF2 的表达,促进骨肉瘤细胞的侵袭和迁移。玛依努尔·达吾提等[18]发现miR-18a-5p 通过调控其靶基因的表达,抑制SW480细胞增殖并促进其凋亡。而目前关于miR-18a-3P 与肿瘤关系的报道较少。
稳定转染和瞬时转染是目前在细胞中获得稳定表达载体的2 种主要方式。其中瞬时转染的结果定量更加容易和快速,但该法观察时间短,无法获得稳定传氏细胞。一般用于获得外源基因稳定转染的方式常用慢病毒载体,慢病毒载体包含病毒包装、转染和整合所需的所有遗传信息,其通过感染细胞,并随着宿主细胞的分裂而扩增,实现外源基因在宿主细胞内稳定的表达。与瞬时转染相比,慢病毒转染效果更稳定,结果定量更准确[19]。
本研究首先构建了miR-18a-3P 过表达慢病毒载体GV369 和miR-18a-3P 干扰慢病毒载体GV280,并对所构建的载体进行滴度测定。将构建成功的慢病毒载体转染人乳腺癌细胞株MDA-MB-231 中,qRTPCR 检测经转染载体后MDA-MB-231 细胞株中miR-18a-3P 的表达,发现慢病毒载体能显著改变MDAMB-231 细胞内miR-18a-3P 的表达。本研究成功构建了miR-18a-3P 慢病毒过表达载体GV369 和干扰载体GV280,并能在乳腺癌细胞株MDA-MB-231 内稳定表达,为后续开展miR-18a-3P 对乳腺癌发生、发展进程的研究及其分子机制奠定了实验基础。

