干旱及冻融胁迫对黑麦草抗氧化酶活性和脯氨酸质量比的影响
常艺馨, 包国章, 张梦瑜
(吉林大学 新能源与环境学院, 长春 130012)
黑麦(SecalecerealeL.)为越年生草本植物, 主要分布于我国北部地区, 叶片营养丰富、 产量较高, 是具有较高饲用价值的优质牧草[1].冬牧70黑麦草具有较强的抗寒能力, 在0.5~2.5 ℃也可出苗, 适合北方地区种植[2].我国东北地区冬季与春季交替时温度较低, 时常发生冻融现象, 温度大幅度波动影响植物生长, 持续低温胁迫导致植物组织损伤或死亡[3].干旱也是植物生长时面临的一种灾害, 干旱频发会影响植物的正常生长发育[4-5].目前人们对单一胁迫的研究较多, 但冻融和干旱两种胁迫常伴随发生, 其复合胁迫的研究结果文献报道较少, 因此了解冻融及干旱复合胁迫下植物的生理特性极为重要[6].本文研究干旱及冻融胁迫下冬牧70黑麦草体内抗氧化酶活性与脯氨酸变化及其因子间的相关性, 分析牧草在逆境中的抗旱和抗寒性.
1 材料与方法
1.1 实验材料与方法
选用冬牧70黑麦草种子为实验材料.先用质量分数为0.1%的KMnO4溶液浸泡消毒10 min, 再用去离子水冲洗, 平铺在含有湿滤纸的托盘中, 盖上保鲜膜培养, 加入适量Hoagland营养液, 在光照培养箱内(MGC-450BP型, 上海一恒科学仪器有限公司)培养.模拟室外生长环境, 设定为白天25 ℃, 夜晚20 ℃, 光照12 h, 光照强度(PPFD)约为280 μmol/(m2·s)(60%), 适当通风, 每天用Hoagland营养液补充水分, 培养7 d后进行模拟干旱及冻融处理.
1.1.1 干旱处理 用Hoagland营养液配制聚乙二醇(PEG)溶液, 选用PEG体积分数为5%(轻度干旱, D1)、 10%(中度干旱, D2)、 15%(重度干旱, D3)三种程度, CK组为对照组.选取长势相同的黑麦草幼苗, 分别进行轻度、 中度和重度干旱处理, 处理时间为2 d.
1.1.2 冻融处理 干旱处理2 d后, 将幼苗放入控温(交变)试验箱(BPHJ-120A型, 上海一恒科学仪器有限公司)中进行1次冻融胁迫处理, 冻融温度在程控下逐渐变温, 周期为14 h, 每2 h取样一次, 冻融取样时的温度分别为10,5,0,-5,0,5,10 ℃(分别记为T1~T7).实验分为4个处理组:F(冻融组);D1+F(轻度干旱冻融组);D2+F(中度干旱冻融组);D3+F(重度干旱冻融组).在每个温度下, 4个处理组均随机取样, 设置3个重复.实验处理方法列于表1.
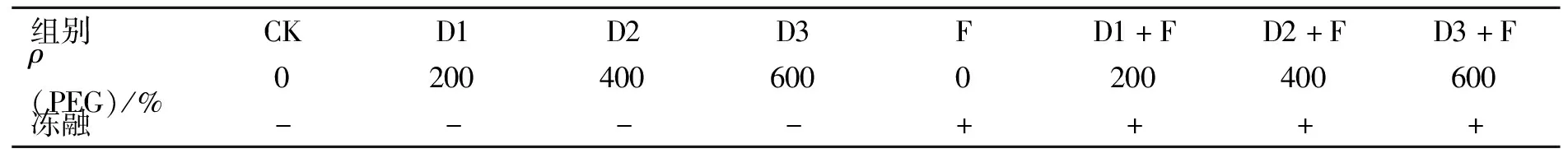
表1 实验处理方法
注:+加冻融; -不加冻融.
1.2 指标测定
用南京建成公司生产的SOD试剂盒和POD试剂盒测定超氧化物歧化酶(SOD)和过氧化物酶(POD)的活性[7], 用酸性茚三酮法测定脯氨酸的质量比[8].
1.3 数据处理
用Microsoft Excel 2007和SPSS19.0软件进行数据处理和单因素方差分析(ANOVA), 用最小显著差异法在P=0.05显著性水平上进行差异显著性检验, Pearson相关系数表示相关性, 用Origin8.0软件制图.所有结果用均值±标准误差(SE)表示.
2 结果与分析
2.1 干旱及冻融胁迫对酶活性的影响
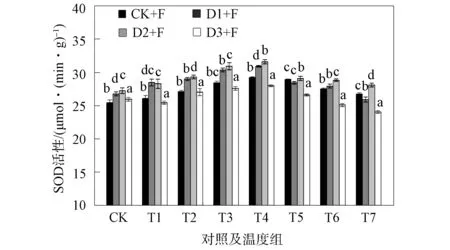
2.1.1 对SOD活性的影响 干旱及冻融胁迫对幼苗中SOD活性的影响如图1所示.由图1可见: 干旱胁迫下的各组幼苗叶片中SOD活性均有所增加, 与对照组相比分别上升了8.3%,12.6%,6.2%(P<0.05); 冻融处理下的叶片中SOD活性均呈先升高后缓慢下降趋势, 在T1~T4的温度下降阶段, 叶片中SOD活性呈上升趋势, 在-5 ℃出现最大值, SOD活性最高与其他温度组均存在显著性差异(P<0.05), 在T4~T7的温度上升阶段, SOD活性呈下降趋势; 当温度恢复到10 ℃时, F组与对照组相比其SOD活性上升了11.1%, 复合胁迫D1+F和D2+F组分别上升了2.3%,18.6%, D3+F组下降了11%.
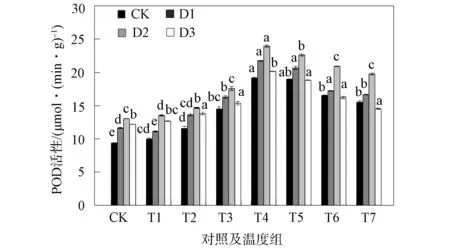
2.1.2 对POD活性的影响 图2为干旱及冻融胁迫对幼苗叶片中POD活性的影响.由图2可见:干旱胁迫下的叶片POD活性呈上升趋势, 与对照组相比分别增加了24.3%,36.1%,29.2%(P<0.05); 在冻融处理阶段, 单冻融与复合胁迫组叶片中POD活性呈先升高后缓慢下降趋势, 在T1~T4的温度下降阶段, 幼苗中的POD活性逐渐升高, 在-5 ℃时幼苗的POD活性最高, 在T4~T7的温度上升阶段, 幼苗中的POD活性缓慢下降; 当温度恢复到10 ℃时, 各组的POD活性顺序为: D2+F>D1+F>F>D3+F>CK, F与对照组相比上升了47.3%, 复合胁迫下D1+F,D2+F,D3+F组其活性分别升高了54.4%,76.8%,40.2%(P<0.05), D2+F组叶片中POD活性最显著.
a,b,c,d表示同一温度下不同处理组有显著性差异(P<0.05).数据用均值±标准误差表示(n=3).
a,b,c,d,e表示同一温度下不同处理组有显著性差异(P<0.05).数据用均值±标准误差表示(n=3).
SOD和POD是植物体内重要的细胞保护酶防御系统[9].逆境时植物体内会产生活性氧(ROS)且代谢发生紊乱, ROS引起氧化应激会导致生物膜过氧化等伤害[10-11].在单一干旱、 冻融胁迫及复合胁迫下, SOD和POD活性均显著增加并高于CK组, 且复合胁迫高于单一胁迫, 与文献[12]结果相符.这可能是由于干旱及冻融胁迫下的膜脂过氧化作用, 诱导SOD活性增强, 将超氧阴离子转化为H2O2, H2O2积累诱导POD活性增强, POD将H2O2分解, 防止H2O2与剩余超氧阴离子反应生成活性更强的OH-, 加剧氧化胁迫, 从而达到维护机体免受活性氧的损伤[13].干旱胁迫下, 随着干旱程度的增加, 叶片中酶活性不断增加, 与文献[14]对芒草的研究结果相同.冻融胁迫下, 在-5 ℃时幼苗叶片酶活性出现峰值.这可能是由于黑麦草细胞受低温刺激, 体内的酶活性提高, 降低细胞冰点以防止植物在低温损伤所致[15].复合胁迫下, 叶片由于受持续干旱及低温伤害, 当温度恢复时, SOD和POD活性略有恢复, 但与CK组相比仍较高, 虽然温度得到补偿, 但幼苗仍受严重胁迫, 抗逆性作用下诱导SOD和POD活性增强[16-17].其中D2+F组幼苗的SOD和POD活性恢复显著且小于单一冻融组.
2.2 干旱及冻融胁迫对脯氨酸质量比的影响
a,b,c,d,e表示同一温度下不同处理组有显著性差异(P<0.05).数据用均值±标准误差表示(n=3).
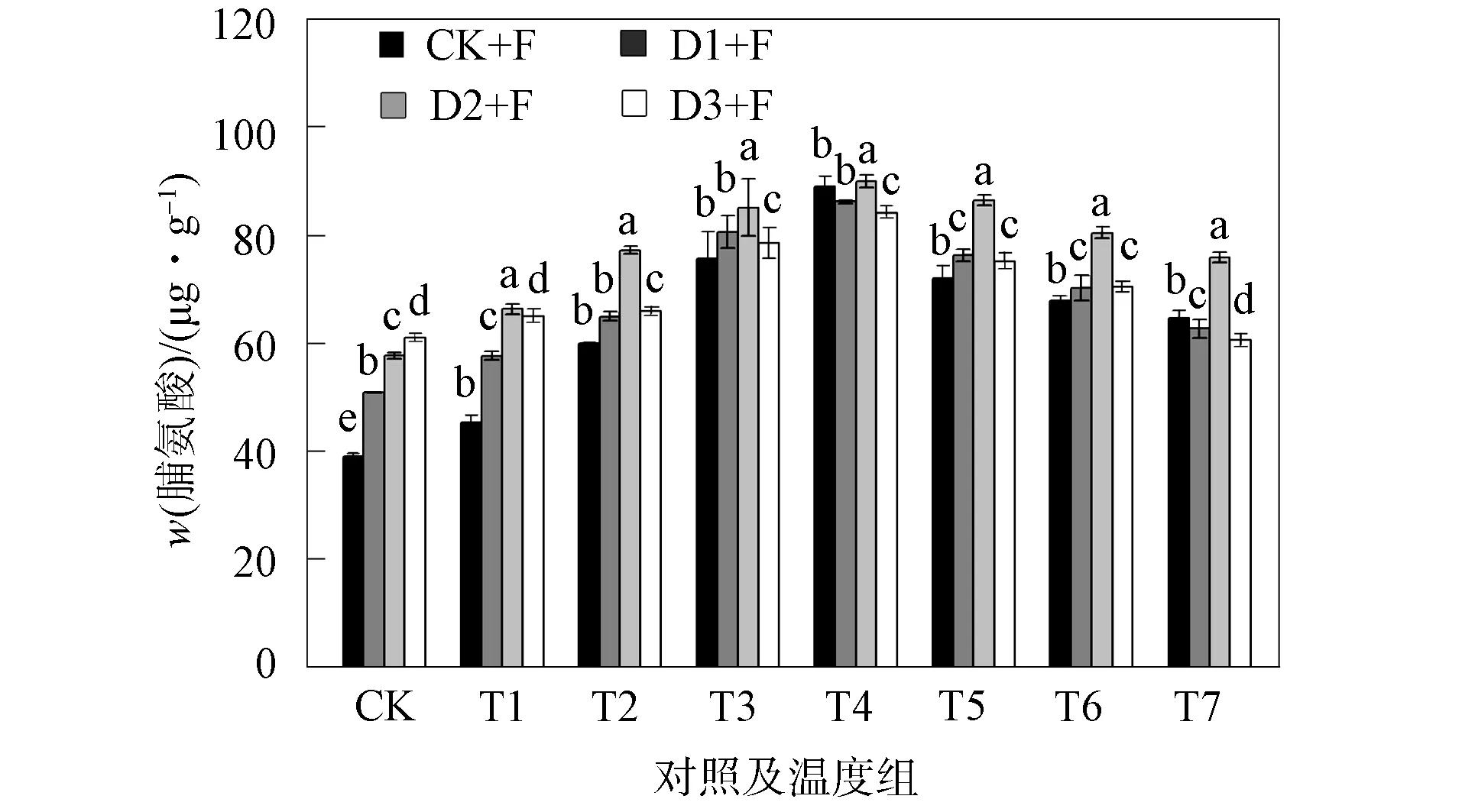
图3为不同程度干旱胁迫及冻融胁迫对幼苗叶片中脯氨酸质量比的影响.由图3可见: 在单一干旱胁迫下, D1,D2,D3组脯氨酸的质量比均显著增加, 与对照组相比分别增加了26.2%,48.2%,66.6%(P<0.05); 在冻融胁迫下, 各处理组脯氨酸的质量比呈先升高再缓慢下降趋势, 在T1~T4的温度下降阶段, 各处理组脯氨酸的质量比均逐渐升高, 在-5 ℃出现最大值, 具有显著性差异, 在T4~T7的温度上升阶段, 脯氨酸的质量比呈下降趋势, 当温度恢复到10 ℃时, F组与对照组相比上升了68.4%;复合胁迫下D1+F,D2+F,D3+F组的脯氨酸质量比分别升高了60.5%,95.8%,57.4%(P<0.05), 其中D2+F组幼苗中脯氨酸的质量比最高.
脯氨酸是植物细胞内重要的渗透调节物质之一, 植物通过增大其含量提高对渗透胁迫的适应能力[16].干旱胁迫导致脯氨酸质量比增大, 这可能是由于干旱导致幼苗叶片细胞脱水, 增加脯氨酸的质量比可降低细胞渗透势, 有助于细胞吸水, 与文献[17]对小麦的研究结果相同.冻融胁迫下, 幼苗的脯氨酸质量比随温度变化先升高后降低.因此脯氨酸在植物经历低温时可降低细胞冰点, 防止细胞过度脱水[18-19].复合胁迫中D2+F组脯氨酸质量比升高最明显, 表明中度干旱加强了黑麦草幼苗的自适应能力, 干旱及冻融胁迫出现联合效应, 在经历低温时可有效缓解冻伤, 与大叶冬青叶片的研究结果相似[20].
2.3 相关性分析
对干旱及冻融胁迫下黑麦草幼苗叶片的3个指标进行Pearson相关性分析, 结果表明:SOD活性与POD活性具有显著正相关性, 相关系数为0.970(P<0.05); 脯氨酸的质量比与SOD和POD活性变化间存在显著相关性, 相关系数分别为0.899,0.939(P<0.05).
综上所述, 本文研究了干旱及冻融对黑麦草的酶活性及脯氨酸质量比的影响.结果表明: 单一胁迫和复合胁迫均导致黑麦草中SOD和POD活性升高及脯氨酸质量比增加;复合胁迫大于单一胁迫对植物的影响;中度干旱+冻融胁迫对各指标的影响最小.因此, 适当进行干旱处理可有效提高黑麦草对冻融胁迫的适应能力, 降低冻融时低温造成的伤害, 而严重的干旱胁迫会导致不可逆损伤.因此在东北地区种植牧草, 在牧草经历冻融前可对牧草进行适度控水处理, 以提高其适应低温的能力, 从而减少低温导致的减产.

