不同培养方式对优质卵裂期胚胎发育潜能及临床结局的影响
姚志鸿,熊风,李观贵,孙青,万才云,陈培林,钟惠娴,曾勇
(深圳中山泌尿外科医院生殖中心,深圳市围着床期生殖免疫重点实验室,深圳中山生殖与遗传研究所,深圳 518045)
体外受精/卵胞浆内单精子注射-胚胎移植(IVF/ICSI-ET)是治疗不孕不育症的有效手段,胚胎培养是IVF/ICSI-ET中最主要的环节,提高胚胎体外发育潜能和质量至关重要。胚胎是一种具有分泌活性的生物体,研究表明,种植前的胚胎能够分泌产生各种不同的配体分子,包括生长因子、细胞因子、激素类分子等[1],并且这些分子可能影响相邻胚胎的生长发育,因此,基础研究理论认为胚胎集合培养可能优于单胚胎培养[2]。然而,目前相关的临床研究报道较少,结论也未达成一致[3]。考虑到优质胚胎是目前认为分泌“功能分子”促进胚胎共同发育的关键[4],因此,本研究选取IVF/ICSI治疗的患者优质胚胎为研究对象,分析不同培养方法对其囊胚培养结局及移植后临床结局的影响。
资料与方法
一、研究对象
本研究选取2018年3~10月在本中心接受IVF/ICSI治疗的患者作为研究对象。纳入标准:女方年龄<38岁;常规促排卵方案;第1个IVF或ICSI周期;第3天(Day 3)优质胚胎数≥4枚;第5天(Day 5)新鲜单囊胚移植。排除因OHSS风险、子宫内膜因素、孕酮高水平等因素取消新鲜周期移植的患者。根据上述标准,入选206位患者(206个周期),共计优质卵裂期胚胎1 281枚。
二、研究方法
1.分组:因工作流程变化,2018年7月1日起,本中心对卵裂期胚胎的囊胚培养方式由集合培养改变为单胚胎培养,以此为时间节点,将入选人群分为A、B两组:A组采用单胚胎培养法(后4个月,n=118),即1个微滴培养1枚胚胎;B组采用集合培养法(前4个月,n=88),即1个微滴培养2~3枚胚胎。
2.促排卵和受精:根据患者情况和本中心的标准采用常规方案促排卵,当18mm以上卵泡≥2个时,肌肉注射HCG(珠海丽珠制药),34~36h后经阴道B超穿刺取卵。男方精液采用不连续密度梯度离心法处理,取卵后4~6h进行IVF或ICSI受精。
3.卵裂期胚胎培养与质量评估:卵裂期胚胎培养两组均采用单胚胎培养法,培养液为Quinn’s 1026培养液(SAGE,美国),培养条件为37℃、5%CO2、5%O2。受精后第3天采用形态学评分标准对胚胎进行质量评估[5]:1级:卵裂球数目≥7个,碎片数量≤10%;2级:卵裂球数目≥7个,10%<碎片数量≤20%;3级:卵裂球数目≥7个,碎片数量>20%或5个≤卵裂球数目<7个,碎片数量≤10%;4级:5个≤卵裂球数目<7个,碎片数量>10%或卵裂球数目<5个。正常受精且Day 3为1级或2级的胚胎定义为优质卵裂期胚胎。
4.囊胚培养与质量评估:囊胚培养采用Quinn’s 1029培养液(SAGE,美国),培养条件为37℃、5%CO2、5%O2,培养方式为微滴培养,微滴体积为25~30μl。其中,A组患者每个微滴培养1枚优质卵裂期胚胎;B组患者每个微滴培养3枚或2枚优质卵裂期胚胎。胚胎培养第5天和第6天分别观察囊胚形成情况并采用Gardner评分标准[6]对囊胚质量进行评估。根据标准,将3期及3期以上扩张程度,内细胞团和滋养层评分均达到C级以上定义为优质囊胚;将3期及3期以上扩张程度,内细胞团和滋养层评分至少一个达到C级以上定义为可利用囊胚,即可用于移植及冷冻。
5.新鲜囊胚移植与黄体支持:胚胎培养第5天在B超介导下行新鲜单囊胚移植。黄体支持采用黄体酮凝胶(默克雪兰诺,瑞士),阴道给药90mg/d。直至移植后11d抽血检测HCG。
6.妊娠诊断:囊胚移植后第11天检测血HCG,HCG≥5U/L定义为HCG阳性。移植后30d经B超检查见宫腔内有妊娠囊及胎心搏动判断为临床妊娠。
三、统计学分析
采用SPSS 18.0进行数据的统计分析,计量资料用均数±标准差()表示,组间比较采用t检验,率的差异性分析采用χ2检验;P<0.05为差异有统计学意义。
结 果
一、两组患者的基本资料
A、B两组间女方年龄、体重指数(BMI)、获卵数以及受精率、和优质胚胎率均无显著性差异(P>0.05)(表1)。
二、两组患者的囊胚培养结局
A组患者培养优质卵裂期胚胎696枚,B组患者培养优质卵裂期胚胎585枚。两组患者囊胚形成率、优质囊胚形成率、可利用囊胚形成率、Day5囊胚形成率和Day6囊胚形成率均无显著性差异(P>0.05)(表2)。
三、两组患者移植后临床结局比较
统计分析A、B两组患者的临床妊娠情况显示,两组的HCG阳性率、临床妊娠率、继续妊娠率和早期流产率均无显著性差异(P>0.05)(表3)。
表1 两组患者基本资料比较[(),%]
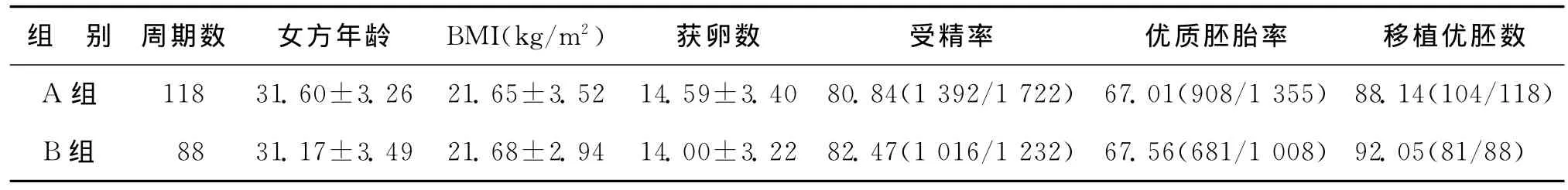
表1 两组患者基本资料比较[(),%]
组 别 周期数 女方年龄 BMI(kg/m2) 获卵数 受精率 优质胚胎率 移植优胚数A组 118 31.60±3.26 21.65±3.52 14.59±3.40 80.84(1 392/1 722) 67.01(908/1 355)88.14(104/118)B组 88 31.17±3.49 21.68±2.94 14.00±3.22 82.47(1 016/1 232) 67.56(681/1 008)92.05(81/88)
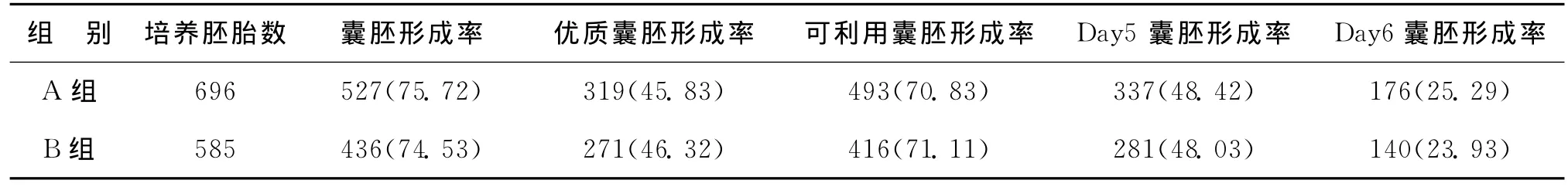
表2 两组患者的囊胚形成情况比较[n(%)]

表3 两组患者移植后临床妊娠情况比较(%)
讨 论
改善胚胎培养结局,提高临床妊娠率是每个生殖中心研究的方向与重点,建立一套正确的胚胎培养策略对于提高培养效果能起到一个举足轻重的作用。目前大多数生殖中心为了方便追踪胚胎的个体发育情况,囊胚培养一般采用单胚胎培养的方式[7],但许多研究表明胚胎在生长发育过程中可以分泌出许多促进胚胎内细胞团发育,加速囊胚形成的生长因子[8-9],而 同 时 国 外 许 多 报 道 中 对 小 鼠[10]、绵羊[11]、奶牛[12-14]等动物通过集合培养的方法进行囊胚培养,显著改善了动物囊胚培养结局,提示集合培养或许可以成为改善胚胎培养结局的方法之一。
近年,国外学者 Ebner等[15]和 Bo等[16]均以集合培养和单胚胎培养的方式培养胚胎,以30μl的培养液体积培养于培养液微滴中,集合培养组的培养密度为3~5个胚胎/ml和1~4个胚胎/30μl,发现集合培养相较单胚胎培养的确可获得较高囊胚形成率。究其原因很可能是由于胚胎之间通过自分泌或旁分泌的形式促进相邻胚胎的生长发育,而集合培养的胚胎相较于单胚胎培养不仅可以加强胚胎之间的交流作用,而且由于培养密度的增大可以提高胚胎分泌于培养液中的生长因子的浓度,从而改善胚胎的囊胚培养结局。而Tao等[17]将Day 3卵裂期胚胎以2~5个胚胎/50μl的胚胎密度分为A、B组进行集合培养,A组为随机分配胚胎集合培养,B组为Day 3优质胚胎集合培养和Day 3非优质胚胎分别集合培养。结果发现集合培养的胚胎中,B组较A组的囊胚形成率和优质囊胚形成率有显著性的提高,这提示优质胚胎可以更有效分泌有益因子或降低不良因子对邻近胚胎的影响,从而提高了整体囊胚形成水平。
本次研究的206例案例中,主要研究对象为Day3优质卵裂期胚胎,按1~3个胚胎/25μl的培养密度分组培养,发现集合培养组相较于单胚胎培养组的囊胚形成率、可利用囊胚率和优质囊胚率均无显著性差异(P>0.05),表明集合培养并不能有效地改善优质胚胎的囊胚培养结局。这与上述报道中提到的关于集合培养改善胚胎培养结局的结论不一致,经过对比发现各研究中均采用不同的胚胎培养密度,而 Minasi等[18]和 Munck等[19]则在研究中提到过胚胎培养密度的改变可能会影响囊胚形成率,这可能是导致上述研究结果不一致的原因之一。
至于两组间的新鲜单囊胚移植后的临床结局,我们通过对比后发现集合培养组相较单胚胎培养组的HCG阳性率、临床妊娠率和继续妊娠率均有所提高,但均无显著性差异(P>0.05)。这与过去报道基本一致[20-21],即与单胚胎培养法相比,集合培养法无法有效地改善胚胎临床结局。或许集合培养存在两面性:胚胎虽然通过旁分泌的方式产生生长因子促进邻近胚胎的生长发育[22],但同时集合培养可能会导致胚胎发育过程中分泌的胚胎废弃物如氨基酸、铵、活性氧等有毒物质大量聚集[23-26],从而影响胚胎发育潜能,无法改善胚胎的临床结局。
综上所述,虽然实验设计过程中采用先后时间段不同进行分组而未进行随机分组,但实验中使用的培养液质控正常,并且培养胚胎的天数和相关实验人员等实验条件并未改变,所以本实验误差对于实验结果而言影响相对较小。最终结果表明对于Day 3优质卵裂期胚胎,集合培养无法有效地改善胚胎囊胚发育潜能及临床结局,相较于单胚胎培养意义不大。采用单胚胎培养法培养胚胎时,不仅可以更好地追踪胚胎个体的发育,提高移植胚胎的准确性,同时可以观察到发育异常的胚胎从而筛选出发育良好的胚胎。所以培养Day 3优质卵裂期胚胎时,单胚胎培养法会是一个更好的选择。而对于非优质卵裂期胚胎,由于本研究只开展了Day3优质卵裂期胚胎,未对非优质卵裂期胚胎进行相关的实验验证,所以尚需更多的实验验证对于非优质卵裂期胚胎是否存在着同等效应。

