新建辅助生殖实验室的鼠胚培养质控及鼠卵显微注射分析
柳岚,吴兵平,李志敏,林华,李励军
(莆田学院附属医院,莆田 351100)
近年来,不孕不育患者呈逐年增加的趋势,大部分患者需要借助辅助生殖技术(ART)治疗实现成功受孕。人类辅助生殖实验室是精卵结合和胚胎发育的场所,培养室的环境、培养体系及技术人员操作水平直接关系到 ART技术的成功与否[1-2]。作为新建辅助生殖实验室,在开展人类ART技术之前,有必要对整个培养系统进行全面地分析评估。研究表明,小鼠体外受精法和体内受精法胚胎培养可以很好地检测新建辅助生殖实验室的质控情况[3-4]。并且通过鼠胚实验合理评估实验室培养系统的同时,可以提高技术人员的操作水平,为顺利开展人类IVF、ICSI技术提供可靠的实验依据和质量控制保证。鼠卵是比较理想的ICSI模型,然而采用人ICSI操作系统进行鼠卵ICSI时效果不佳,卵子存活率低下,且鼠精的特殊结构使得显微注射操作相对困难[5-7]。为此,本研究分析比较了常规人卵显微注射模式与鼠断尾精子显微注射模式的结局,探讨鼠卵ICSI操作对新建辅助生殖实验室显微注射技术质控的意义。
材料与方法
一、实验材料
1.实验动物:昆明小鼠购自北京华阜康生物科技有限公司,雌鼠6~10周龄,雄鼠10周龄以上。分10个批次进行鼠胚实验,每批次5只雌鼠,2只雄鼠。
2.药物与试剂:注射用血清促性腺激素(PMSG)购自宁波三生药业有限公司,HCG购自马鞍山丰原制药厂。主要试剂采用美国COOK商品化培养液,培养液使用前1d配制好,配子缓冲液置37℃培养箱中平衡过夜,受精培养液、卵裂胚培养液、囊胚培养液置37℃、6%CO2培养箱中平衡过夜。
3.主要耗材与设备:培养皿、四孔板、圆底管等均为美国Falcon公司产品;显微注射针(SIC-50W-30)、显微固定针(SHP-100-30)购自美国Sunlight Medical公司;以及德国Labotect培养箱、丹麦L-126MP工作站、日本Nikon显微操作系统等。
二、实验方法
1.实验分组:按照授精方式的不同,将小鼠分为体内受精组和体外受精组,每组每批次各促排2只雌鼠;并且按照ICSI操作的具体方法不同,将获得的卵母细胞分为常规人卵显微注射模式(C-ICSI组)和鼠断尾精子显微注射模式(D-ICSI组),每组每批次促排1只雌鼠,所获得的卵母细胞脱颗粒细胞后用于显微注射。
2.小鼠超排卵:健康雌鼠于下午17时腹腔内注射PMSG(10U/只),48h后腹腔内注射 HCG(10U/只)。
3.体内受精组:注射HCG后雌鼠与雄鼠1∶1合笼,次日8∶00am观察合笼雌鼠阴道栓情况,将有阴道栓的雌鼠颈椎脱臼法处死,打开腹腔取出卵巢及输卵管,洗涤去除血迹,体视镜下用1ml注射器轻轻划破输卵管壶腹部,收集合子团(即聚集成堆的受精卵)。将收集的合子团置于透明质酸酶中,去除卵丘颗粒细胞后计数受精卵和未受精卵子数量,进行微滴培养观察。
4.体外受精组:次日8∶00am颈椎脱臼法处死未合笼的健康雌鼠,打开腹腔取出卵巢及输卵管,洗涤去除血迹,体视镜下用1ml注射器轻轻划破输卵管壶腹部,收集卵子团。雄鼠处死,取出附睾及输精管,洗涤去除血迹,体视镜下用1ml注射器划破输精管,释放鼠精,上游法处理精子悬液。将精子悬液加入卵子团的受精四孔板中,调整精子浓度为1×106/ml,4~5h短时受精后收集受精卵进行微滴培养观察。
5.ICSI:卵子团置于透明质酸酶中去除卵丘颗粒细胞后,转入培养液,培养箱中孵育,待ICSI操作。安装显微注射针和固定针,准备ICSI操作皿,显微注射针吸取制动鼠精或鼠断尾精子头,固定针固定卵子(第一极体位于6点或12点),精子推至注射针尖处,3点处垂直穿过透明带并继续水平进针,至卵胞浆中心或越过中心位置,回吸注射针至可见卵膜回弹快速返流时,将精子注入卵胞质中,退针,收集存活卵子进行微滴培养观察。C-ICSI组:即注射针在鼠精尾部中段轻压,迅速回拉注射针划破精子尾部制动;D-ICSI组:即显微注射针压住鼠精颈部,朝精子头方向刮动使鼠精断尾。
6.胚胎观察:体内受精的合子团于透明质酸酶消化处理后,观察原核胚数;体外受精、ICSI的于受精4~6h后观察原核胚数。第1天(D1)观察2-细胞数,D2观察4-细胞,D3观察8-细胞/致密化8-细胞数,D5观察囊胚形成数。参照之前文献方法统计受精率、卵裂率和囊胚形成率[8]。
三、统计学方法
采用SPSS软件进行数据分析,计数资料以率(%)表示,组间比较采用χ2检验,P<0.05时表示差异有统计学意义。
结 果
一、小鼠胚胎的培养观察
小鼠卵子正常受精后,受精卵内可见雌、雄原核形成,为原核期胚胎(图1A);随后进入卵裂期,第1次卵裂可见2个大小均一、无碎片的卵裂球,为2-细胞胚胎(图1B);受精第2天可见4个大小均一、无碎片的卵裂球,为4-细胞胚胎(图1C);受精第3天可见8个大小均一的卵裂球或致密化后紧密联系在一起的8个卵裂球,为8-细胞/致密化8-细胞胚胎(图1D);受精第5天可见囊胚腔形成、透明带变薄,分化为内细胞团和滋养外细胞层,部分囊胚进入孵化阶段,为囊胚期胚胎(图1E)。
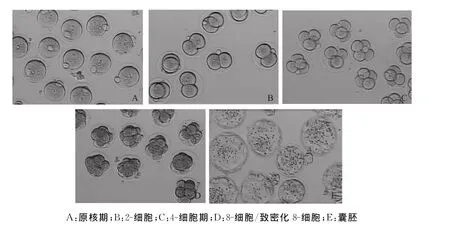
图1 不同发育阶段的小鼠胚胎(×200)
二、体内受精法和体外受精法胚胎培养的质控结果
共进行10个批次的鼠胚质控分析,体内受精法获卵642枚,受精590枚,卵裂556枚,囊胚478枚;体外受精法获卵630枚,受精514枚,卵裂480枚,囊胚392枚。体内受精组的受精率显著高于体外受精组(91.90%vs.81.59%,P<0.001)。两组的卵裂率(94.24%vs.93.39%)、囊胚形成率(85.97%vs.81.67%)比较差异无统计学意义(P>0.05)(表1)。
三、两种鼠卵显微注射方法结局比较
人卵显微注射系统应用于鼠ICSI时卵子存活率有降低的趋势,但C-ICSI组与D-ICSI组的卵子存活率比较尚没有显著性差异(29.49%vs.30.52%,P>0.05)。显微注射后的存活胚胎继续进行培养观察,相比于C-ICSI组,D-ICSI组的受精率(56.72%vs.42.53%)、卵 裂 率 (71.05%vs.43.24%)及囊胚形成率(61.11%vs.31.25%)显著升高,差异具有统计学意义(P<0.05)(表2)。
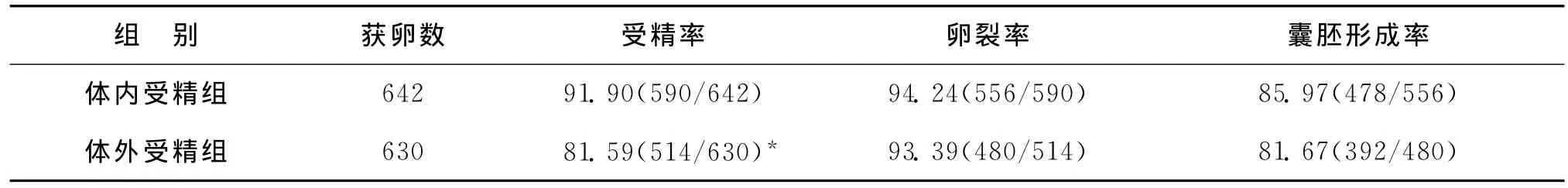
表1 体内受精法和体外受精法胚胎发育情况的比较 (%)

表2 两种显微注射方法存活率及存活胚胎发育情况的比较(%)
讨 论
由于小鼠胚胎与人胚胎有着几乎相同的发育经历,鼠胚培养成为检测人早期胚胎体外发育环境的最佳模式,是目前最常用的生殖实验室质量控制方法[1,9]。本实验结果显示体内受精法和体外受精法的囊胚形成率均达80%,符合辅助生殖实验室的质控标准。两种受精方法的效果略有不同,体内受精法的受精率高的原因可能是体内受精的卵母细胞处在稳定的母体环境中,无需面临温度、渗透压、PH等变化的应激反应[10-11]。
从体内受精、体外受精胚胎发育结局看,两种受精方法均保持了较高的卵裂率和囊胚形成率,二者均能够很好地检测辅助生殖实验室的稳定情况。以上结果表明,作为新建的辅助生殖胚胎实验室,我们的培养体系、实验室技术人员操作水平已达标,可以为顺利开展人类IVF技术提供可靠的实验依据和质量控制保证。
目前,对于新建辅助生殖实验室ICSI技术的质量控制尚无代表性的动物模型。传统观点认为鼠卵体积小且具有易脆性,完全按照常规人卵显微注射模式操作,鼠卵损伤严重,注射部位卵膜不易恢复,卵膜易崩解死亡[12]。1995 年,Kimura等[13]借助Piezo仪器产生的高频振动进行透明带、卵膜穿入进行鼠卵ICSI后,鼠卵的存活率得以显著提高,Wakayama等[14]将该技术成功应用于鼠核移植及其干细胞建系,小鼠存活率可达94%~100%,然而Piezo-ICSI技术与人卵ICSI技术差别极大,无法完全模拟人卵ICSI技术,不能代表人卵ICSI技术水平。非Piezo-ICSI技术的发展,尤其是两步法非Piezo-ICSI技术[7,15]采用改良的喇叭形固定针对鼠卵先浅吸持后浅穿刺,再进一步深吸持并深穿刺,控制卵膜凹陷变形、破膜及其修复过程中的关键因素,提高了鼠卵的存活率。上述两种鼠卵显微注射模式可以获得较好结局,但显然与常规人卵显微注射模式不同,且其安全性尚需进一步研究。
作为新建的辅助生殖实验室,为保证人类ICSI技术的顺利开展,不考虑改变常规人卵显微注射模式的操作练习。从胚胎发育的结局上分析,C-ICSI时的鼠卵子存活率仅30%左右,且受精率、卵裂率及囊胚形成率均较低。该组胚胎培养观察时,原核期仅小部分胚胎见雌、雄原核,另一小部分胚胎可见异常卵裂现象,推断此部分胚胎为孤雌激活现象,显微注射时引发的钙离子震荡导致鼠卵孤雌激活的概率增高,而并非精子进入卵子后的正常发育过程。为排除ICSI操作技术上的因素,我们考虑是否因为鼠精结构上的差异,采用人精制动、注射模式并不能有效激活鼠卵母细胞,鼠精与人精的明显区别在于鼠精头部呈勾形、尾部长且硬,为此引入D-ICSI组,直接显微注射入鼠精头。相比于C-ICSI组,D-ICSI组的受精率、卵裂率及囊胚形成率显著升高,鼠精断尾方式有效改善人卵ICSI操作系统应用于小鼠实验的结局,但并不提高鼠卵存活率。
综上所述,昆明小鼠配子体外受精法和体内受精法均有较高的囊胚形成率,达到辅助生殖胚胎实验室的质控标准。人卵显微注射系统应用于鼠卵ICSI时,由于鼠与人的卵子、精子结构上的差异,不应成为新建辅助生殖实验室ICSI技术的质控标准,而仅适用于卵子显微注射操作练习。通过鼠胚实验,验证了实验室培养体系的稳定性,为顺利开展人类IVF、ICSI技术提供了技术保障。

