新鲜胚胎D4与D5移植妊娠结局的比较
李国臻,耿亚松,杨志伟,陶林林,霍志欣
(邢台不孕不育专科医院,邢台生殖与遗传专科医院,邢台 054000)
随着辅助生殖技术的发展,已经解决了大量不育症夫妇的生育需求。多数研究报道,第3天(D3)移植卵裂胚可能遭遇胚胎基因组未激活和异常受精等风险[1-2]。相对于卵裂胚移植,囊胚移植在临床妊娠率和种植率上均具有明显的优势,且具有更低流产率[3]。然而胚胎在体外培养过程中不可避免地遇到培养微环境的波动,这些波动如pH、温度、渗透压的改变有可能对胚胎发育造成影响[2,4],导致第5天(D5)不能获得可移植囊胚,移植周期取消,或者种植后胚胎发育停滞等。有报道指出桑椹胚与囊胚具有相似的优势,因为它们具有激活的胚胎基因组,且与D3卵裂胚相比,与子宫内膜的同步性更好[5-6]。我们通过比较受精后D4移植与D5移植两种移植方案对IVF-ET临床妊娠结局的影响,探讨D4新鲜胚胎移植周期的优势,以期降低移植周期取消率和获得较好的临床结局。
一、资料与方法
1.研究对象:回顾性分析2018年1月至2019年4月在我院生殖中心行IVF-ET的357例患者的临床数据。纳入标准:年龄≤35岁,首次因女方因素、输卵管因素和卵巢高反应或男方因素接受辅助生殖助孕行常规长方案IVF或ICSI授精;排除标准:子宫内膜异位症、子宫肌瘤、宫腔粘连、子宫内膜炎等子宫内膜病史的患者。
2.控制性促排卵:采用常规长方案促排卵。黄体期肌肉注射促性腺激素释放激素激动剂(GnRH-a,达菲林,易普生,法国),达到降调节后,予重组促卵泡β素(普利康,Merck Sharp&Dohme,英国)或尿促性素(乐宝得,珠海丽珠制药)促排卵,定期通过阴道B超监测卵泡发育情况,当1/3卵泡直径≥1.8cm时肌肉注射 HCG(珠海丽珠制药)5 000~10 000U,36.5h后B超引导下经阴道穿刺取卵。
3.体外受精和胚胎移植:授精方式分为IVF和ICSI两种,取卵后3~4h体外授精。IVF:授精密度为2万条/卵母细胞,授精后4~6h拆除卵母细胞周围颗粒细胞,根据受精情况酌情行早补救ICSI。ICSI:取卵后4~6h选择成熟卵母细胞进行ICSI。在受精后第3天,根据卵裂球数目、大小和碎片等情况进行形态学评分为Ⅰ~Ⅳ级,Ⅲ级及以上的胚胎为可移植用胚,Ⅱ级及以上为优质胚胎。根据受精后D3胚胎发育情况选择性受精后D3/D4/D5移植1~2枚胚胎。若患者可用胚胎数量等于移植个数,则受精后D3移植或冷冻;若患者可用胚胎数量多于移植个数,则受精后D4选择早期囊胚或桑葚胚移植;若优质胚胎数量≥4个,则受精后D5选择囊胚移植。
4.黄体支持和妊娠确定:取卵当日即肌注黄体酮注射液(浙江仙琚)进行黄体支持。视HCG注射日E2水平,移植日给予适量E2(补佳乐,拜耳医药,德国)补充,移植当日常规使用黄体酮(安琪坦,博赏医药,法国)口服或阴道上药进行黄体支持。移植后14d查血HCG确定生化妊娠,移植后28d行B超检查,见孕囊确定临床妊娠。
5.分组及观察指标:根据受精后移植胚胎的时间分为两组:受精后第4天新鲜胚胎移植周期为D4移植组(292例),受精后第5天新鲜胚胎移植周期为D5移植组(65例)。比较两组患者基本资料、获卵数、正常受精率、卵裂率、卵裂胚胎质量、临床妊娠率和种植率等临床资料。
6.统计学方法:采用SPSS 17.0软件进行统计学分析。计量资料采用()表示,组间比较用独立样本t检验;计数资料用百分比表示,组间比较采用χ2检验。P<0.05为差异有统计学意义。
二、结果
1.一般资料比较:两组在年龄、体重指数(BMI)、基础FSH水平、HCG日激素水平、移植日子宫内膜厚度等方面均无显著差异(P>0.05);两组人群不孕因素分析中原发性不孕症、排卵障碍、多囊卵巢占比均无显著差异(P>0.05),但D4移植组输卵管因素不孕占比显著低于D5移植组(P<0.05);两组间受精方式占比无显著差异(P>0.05)(表1)。
2.两组胚胎情况比较:D4移植组的获卵数和正常受精率显著低于D5移植组(P<0.05),两组的卵裂率无显著性差异(P>0.05);D4移植组的D3可用胚胎数和优质胚胎数均显著低于D5移植组(P<0.05)(表2)。
3.两组临床结局比较:D4移植组和D5移植组在移植日子宫内膜厚度无显著性差异(P>0.05);D4移植组的移植胚胎个数显著高于D5移植组(P<0.05),两组的种植率和临床妊娠率均无显著性差异(P>0.05),但D4移植组的移植取消率显著低于D5移植组(P<0.05)(表3)。
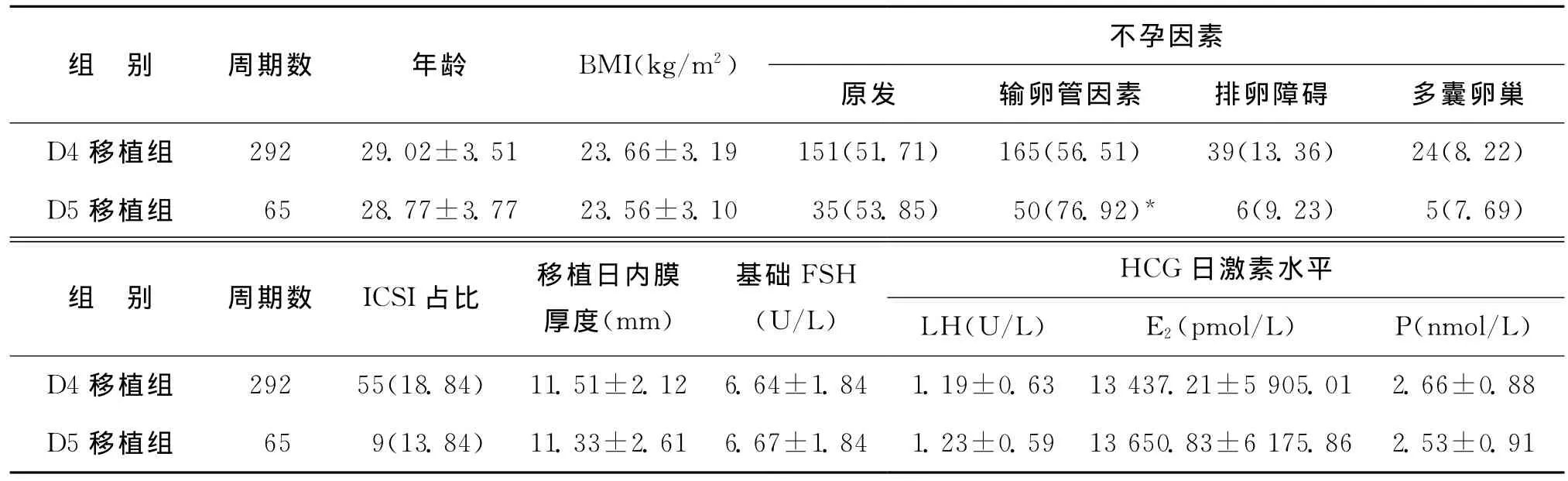
组 别 周期数 年龄 BMI(kg/m2) 不孕因素原发 输卵管因素 排卵障碍 多囊卵巢D4移植组 292 29.02±3.51 23.66±3.19 151(51.71) 165(56.51) 39(13.36) 24(8.22)D5移植组 65 28.77±3.77 23.56±3.10 35(53.85) 50(76.92)* 6(9.23) 5(7.69)组 别 周期数 ICSI占比 移植日内膜厚度(mm)HCG日激素水平LH(U/L) E2(pmol/L) P(nmol/L)D4移植组 292 55(18.84) 11.51±2.12 6.64±1.84 1.19±0.63 13 437.21±5 905.01 2.66±0.88 D5移植组 65 9(13.84) 11.33±2.61 6.67±1.84 1.23±0.59 13 650.83±6 175.86 2.53±0.91基础FSH(U/L)
注:与D4移植组比较,*P<0.05
表2 两组间胚胎质量比较[(),%]

表2 两组间胚胎质量比较[(),%]
注:与D4移植组比较,*P<0.05
组 别 周期数 获卵数 正常受精率 卵裂率 D3可用胚胎数 D3优质胚胎数D4移植组 292 12.24±4.17 70.22(2 316/3 298) 75.83(2 501/3 298) 6.80±2.88 1.28±1.10 D5移植组 65 13.83±5.17* 76.23(664/871)* 78.99(688/871) 8.37±3.91* 3.97±2.16*
表3 两组间移植妊娠结局比较[(),n(%)]
注:与D4移植组比较,*P<0.05
组 别 周期数 移植取消率 移植日内膜厚度(mm) 移植胚胎数 种植率 临床妊娠率D4移植组 292 3(1.02) 11.51±2.12 1.95±0.21 295/570(51.75) 195(66.78)D5移植组 65 4(5.80)* 11.33±2.61 1.80±0.40* 62/117(52.99) 43(66.15)
三、讨论
辅助生殖助孕通过促排卵的方式可以获得足够的卵母细胞用于体外受精后胚胎移植。然而随着取卵数的增多,虽然可用胚胎数是增加的,但可用胚胎的转化率却降低了,多数胚胎因为非整倍体等异常情况不能继续发育[7]。这符合了优胜劣汰的自然规律,但是为了减少患者负担,如何选择出正常的胚胎移植入子宫,获得满意的临床结局,在生殖医学领域成为永恒的话题。由于多种原因,核逆转、多核、逆乱裂和异常卵裂模式的存在,定时定点的形态学观察并不能有效地反映胚胎的发育情况[8-9],即使D3的优质胚胎也没有一个满意的种植率。多数中心通过延长培养时间的方法优选最具发育潜能的胚胎,大量研究表明,囊胚移植具有较高的种植率[10-11]。然而,培养囊胚具有较高的移植取消风险[12];同时,囊胚期胚胎移植同卵双胞胎发生率也明显升高,成为孕妇多胎妊娠的危险因素[13]。我们的研究数据表明,虽然D5移植组多为输卵管因素不孕,且卵裂期胚胎质量较好,但D4移植组相对于D5移植组通过形态学评分优选胚胎移植,具有类似的种植率和临床妊娠率。我们认为D4可能具有较好的移植种植率。本中心之前的研究表明,对于年龄≤30岁患者可根据胚胎质量灵活选择移植天数,与单纯D3胚胎移植相比,能够显著改善临床妊娠结局,并且不增加周期移植取消率[14]。
综上所述,患者具有多余可用胚胎时,建议受精后第4天根据胚胎发育情况,优选早期囊胚和桑葚胚移植进行移植。但是,我们仍然缺乏足够的证据证实IVF-ET中桑葚期胚胎相对于D5移植囊胚的优势。我们下一步将验证桑葚期胚胎冷冻的可行性,并进一步寻找D4桑葚胚移植与D5囊胚移植优劣的证据。

