NIMA相关蛋白激酶7、Nod样受体蛋白3与多囊卵巢综合征炎症指标相关性研究
王耀琴,许素铭,齐改梅,毕星宇,李艳宏,张新,武学清
(山西省儿童医院 山西省妇幼保健院生殖医学中心,太原 030013)
多囊卵巢综合征(PCOS)是育龄期妇女常见的内分泌紊乱型疾病,常伴随有肥胖、血脂异常、胰岛素抵抗及慢性炎症。研究指出,大部分PCOS患者由于外周血中炎性因子[C反应蛋白(CRP)、白细胞介素-1β(IL-1β)、IL-18、肿瘤坏死因子-α(TNF-α)、单核细胞趋化蛋白-1(MCP-1)、可溶性细胞间黏附分子(sICAM)和可溶性内皮白细胞黏附分子(sE-selectin)等]高表达,使PCOS机体处于慢性炎症状态[1]。另外,有研究显示PCOS卵巢功能异常的病理改变与炎性细胞在卵巢中的侵润和慢性炎症有关[2-4]。因此,研究炎症对PCOS发生发展的作用至关重要。
目前,Nod样受体蛋白3(NLRP3)炎性小体激活机制是大家关注的热点。NLRP3炎性小体识别病原体相关分子模式,活化半胱氨酸蛋白酶-1(caspase-1),导致IL-1β和IL-18的成熟和分泌,介导炎症反应诱导细胞凋亡[5-6]。2016年有研究显示,NIMA相关蛋白激酶7(NEK7)是NLRP3炎性小体激活过程必需的调节物质[7-8]。NEK7 作为NLRP3炎性复合体参与炎性小体的激活,调节炎性疾病的进展。研究显示,钾离子外流激活NEK7,调节NLRP3的寡聚化和激活,而NEK7一旦沉默,NLRP3炎性小体(包括NLRP3、caspase-1和IL-1β)表达则被抑制[9]。更为重要的是,NEK7作为一个细胞开关,在细胞周期有丝分裂和炎症小体的激活中起着重要的作用[5]。因此,NEK7可能成为炎症疾病治疗和预防的新靶点。
尽管关于NEK7和NLRP3调节关系的研究受到广泛关注,但到目前为止,针对PCOS中NEK7/NLRP3炎性小体激活关系的研究甚少。本研究旨在通过检测PCOS患者卵巢颗粒细胞中NEK7、NLRP3在mRNA水平表达量的变化,探讨其与PCOS各指标的相关性和预测价值,为PCOS慢性炎症的治疗及预防提出新策略。
资料和方法
一、研究对象
选取2018年8月至2019年3月于山西省儿童医院/山西省妇幼保健院生殖医学中心就诊的PCOS患者为研究组(n=30),选择同期非PCOS不孕患者为对照组(n=34)。本研究经本院伦理委员会批准,所有患者签署知情同意书。
研究组纳入标准:PCOS患者均符合鹿特丹诊断标准,即:(1)稀发排卵或不排卵;(2)高雄或高雄激素血症;(3)卵巢的多囊样改变(卵巢存在≥12个直径2~9mm的卵泡或卵巢体积>10cm3)。至少符合其中2项,并除外3个月内接受过促排卵治疗,曾接受过放化疗治疗或卵巢手术,合并子宫内膜异位症、先天性肾上腺增生、库欣综合征、垂体肿瘤或糖尿病等。
对照组纳入标准:(1)因男方因素或输卵管因素不孕就诊的患者;(2)月经周期规则;(3)内分泌激素水平正常;(4)无发热及炎症性疾病。排除标准:所有患者均排除吸烟、饮酒、最近6个月内服用影响炎症反应的药物及其他炎症性疾病,如类风湿性关节炎、系统性红斑狼疮、高血压、溃疡性结肠炎或恶性血液系统疾病等。
二、方法
1.促排卵方案:根据每个患者自身情况综合评估,定期监测卵泡大小和血清LH、E2水平,并调整用药,进行促排卵。当B超监测到至少3个卵泡直径≥18mm时,于当日注射HCG(珠海丽珠医药)5 000~10 000U,36h后经阴道超声引导下穿刺取卵。
2.基础性激素水平检测:月经来潮的第2~3天,空腹抽取患者静脉血,采用化学发光酶联免疫法(自动酶联免疫分析仪AIA-2 000ST,日本东曹株式会社)进行性激素(PRL、LH、FSH、E2、P 和 T)测定。
3.卵巢颗粒细胞及卵泡液上清液的收集:参照前期发表文章[10]收集卵巢颗粒细胞冷冻保存用于实时定量PCR(qPCR)检测,并收集离心所得卵泡液上清,用于后续酶联免疫(ELISA)检测炎症因子IL-1β和IL-18的表达。
4.NEK7和NLRP3mRNA表达量的检测:参照EZNA 提取试剂盒(OMEGA,美国)说明书操作,提取卵巢颗粒细胞总RNA,检测RNA浓度与纯度。使用反转录试剂盒(北京全式金生物)将1μg总RNA进行逆转录,产物用于qPCR扩增,引物退火温度为60℃,扩增循环设定为40个循环,GAPDH作为内参,采用2-△△Ct计算mRNA的相对表达量,引物序列见表1所示。
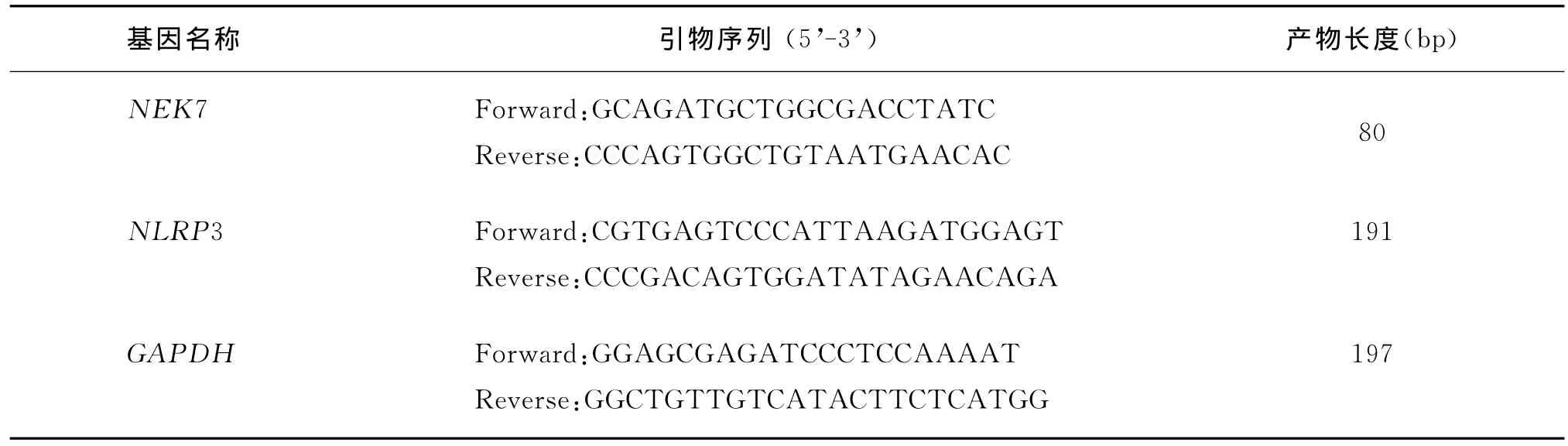
表1 实时定量PCR引物序列及产物长度
5.炎症相关指标检测:应用酶联免疫吸附实验(ELISA)试剂盒(武汉伊莱瑞特生物)检测卵泡液上清中炎症相关指标IL-1β、IL-18的表达水平,操作按试剂盒说明书要求进行。
三、统计学方法
所得数据采用SPSS 19.0软件进行统计学分析。计量资料用均值±标准误(珔x)表示,并采用独立样本t检验;各因素间关系分析采用Spearman相关性分析;应用ROC曲线分析NEK7、NLRP3的诊断效能;以P<0.05为差异具有统计学意义。
结 果
一、两组患者的一般资料及促排卵实验室指标比较
本研究共纳入64例患者,研究组30例,对照组34例。两组间年龄、不孕年限、月经初潮年龄、基础FSH、E2、P水平比较,差异均无统计学意义(P>0.05),而研究组的BMI、基础LH、LH/FSH和T显著高于对照组(P<0.05);促排卵实验室指标比较显示,两组的MⅡ卵率和受精率比较无显著性差异(P>0.05),研究组的获卵数显著高于对照组(P<0.05)(表2)。
二、两组患者卵泡液中炎症相关因子的表达比较
结果显示,研究组卵泡液中炎症因子IL-1β的表达水平[(3.43±0.50)pg/ml]显著高于对照组[(1.17±0.11)pg/ml](P=0.000 1),研 究 组IL-18的表达水平[(143.6±26.32)pg/ml]显著高于对照组[(56.35±3.61)pg/ml](P=0.002 4)(图1)。
表2 两组患者一般临床资料及促排卵指标比较(x )
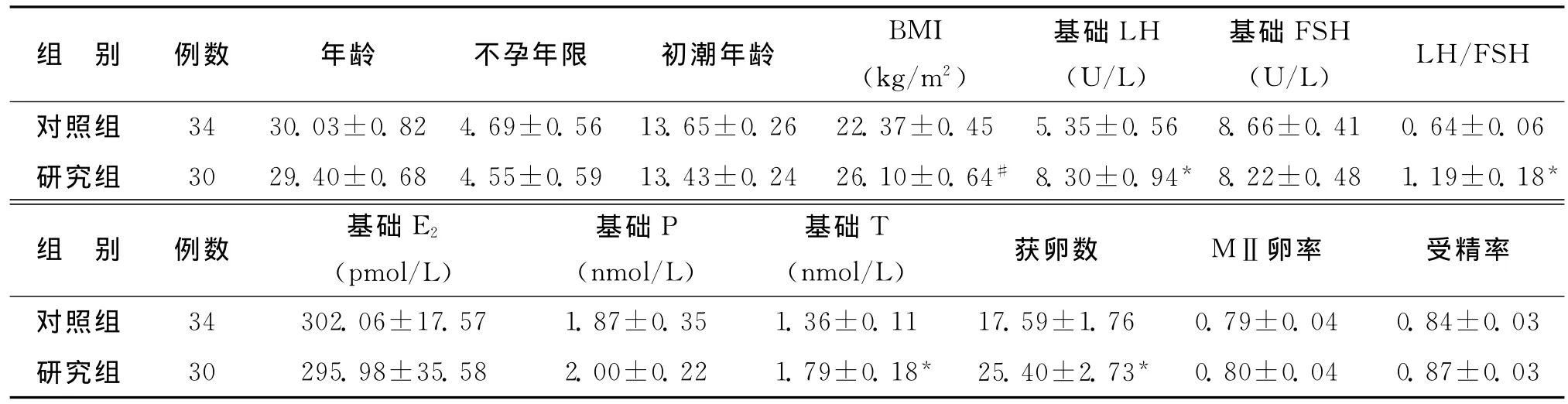
表2 两组患者一般临床资料及促排卵指标比较(x )
注:与对照组比较,*P<0.05,#P<0.001
组 别 例数 年龄 不孕年限 初潮年龄 BMI(kg/m2)基础LH(U/L)基础FSH(U/L) LH/FSH对照组 34 30.03±0.82 4.69±0.56 13.65±0.26 22.37±0.45 5.35±0.56 8.66±0.41 0.64±0.06研究组 30 29.40±0.68 4.55±0.59 13.43±0.24 26.10±0.64# 8.30±0.94* 8.22±0.48 1.19±0.18*组 别 例数 基础E2(pmol/L)基础P(nmol/L)基础T(nmol/L) 获卵数 MⅡ卵率 受精率对照组 34 302.06±17.57 1.87±0.35 1.36±0.11 17.59±1.76 0.79±0.04 0.84±0.03研究组 30 295.98±35.58 2.00±0.22 1.79±0.18* 25.40±2.73* 0.80±0.04 0.87±0.03
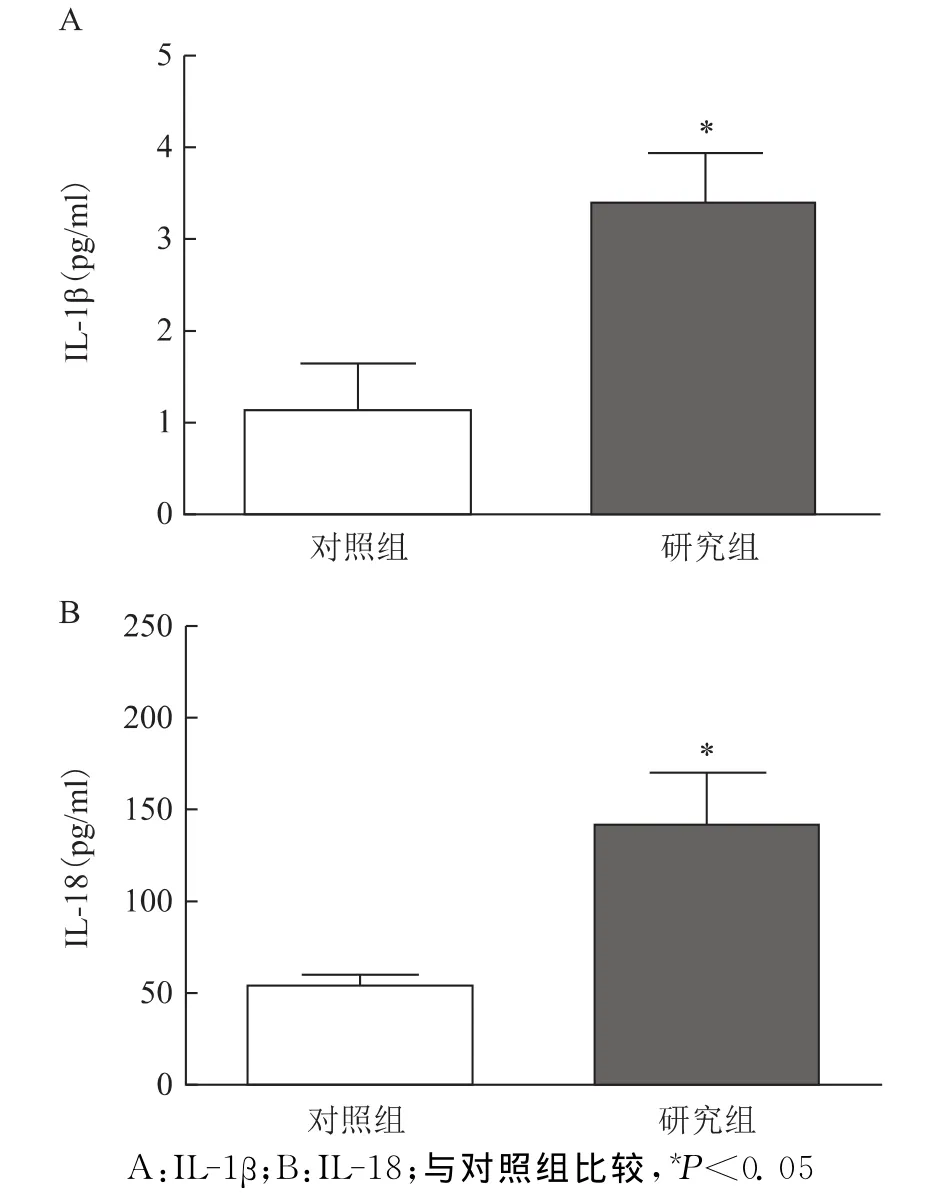
图1 两组卵泡液中炎症因子IL-1β、IL-18的表达水平比较
三、卵巢颗粒细胞中NEK7及NLRP3mRNA的相对表达量比较
研究组患者卵巢颗粒细胞中NEK7及NLRP3 mRNA的表达量均显著高于对照组[分别为(1.39±0.17)vs.(0.94±0.13);(1.70±0.26)vs.(1.06±0.10)](P<0.05)(图2)。
四、颗粒细胞中NEK7、NLRP3mRNA表达量与各指标的相关性分析
将研究组患者颗粒细胞中NEK7、NLRP3mRNA表达量分别与各指标进行相关性分析,结果表明颗粒细胞NEK7、NLRP3mRNA表达水平与基础LH、LH/FSH 及炎症因子IL-1β、IL-18呈显著正相关(P<0.05)(表3)。
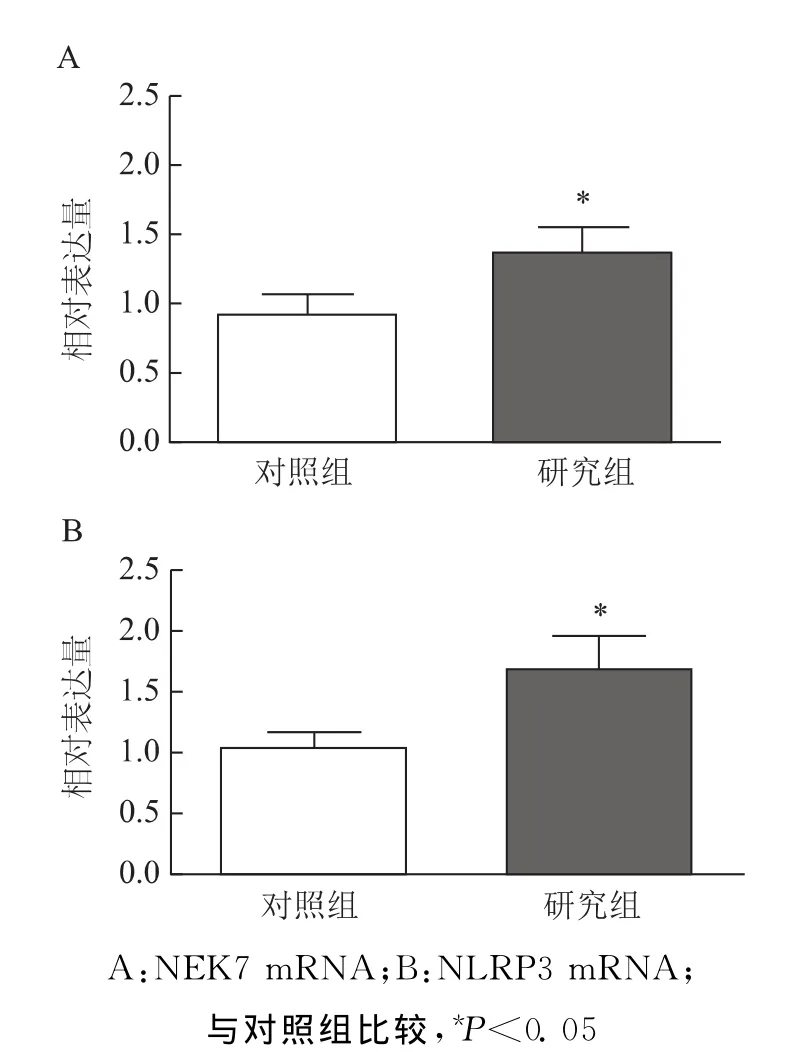
图2 两组卵巢颗粒细胞中NEK7和NLRP3mRNA表达水平比较
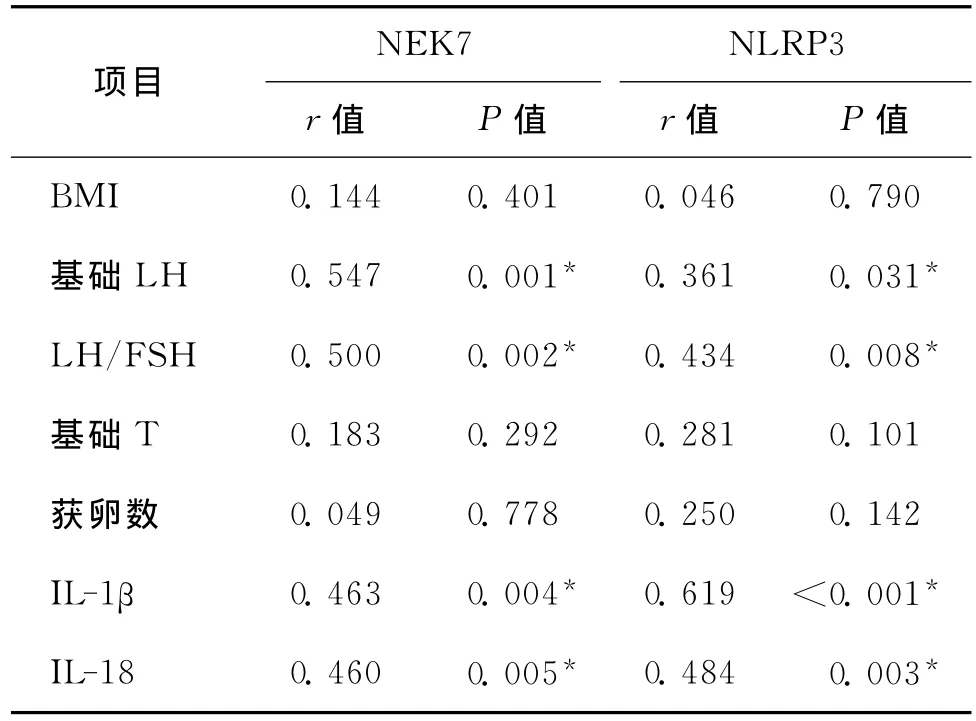
表3 颗粒细胞中NEK7、NLRP3mRNA表达与PCOS指标的相关性
五、NEK7和NLRP3mRNA对PCOS的诊断价值
ROC曲线对比分析显示,NEK7mRNA水平诊断PCOS的AUC为0.741,NLRP3mRNA诊断PCOS的AUC为0.694,而二者联合诊断PCOS的AUC为0.728,且均有统计学意义(P<0.05)。但NEK7和NLRP3mRNA的联合使用并不能有效增加对PCOS的诊断价值(图3、表4)。
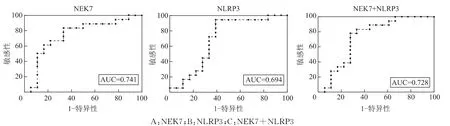
图3 ROC曲线分析
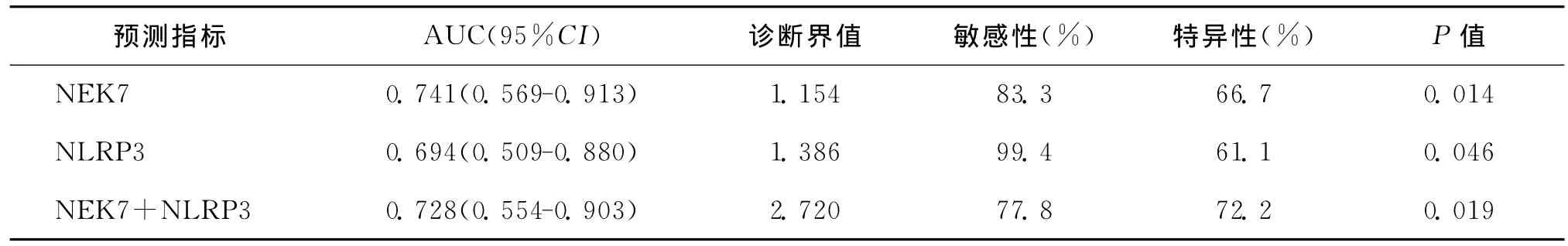
表4 各指标应用于PCOS诊断的ROC曲线统计描述
讨 论
PCOS是临床常见的导致排卵障碍性不孕的主要原因,临床特征主要表现为:稀发排卵或不排卵、高雄和/或高雄激素血症和卵巢的多囊样改变。PCOS病因学复杂,目前认为慢性炎症也是影响PCOS的一个重要因素。有研究指出高雄激素下,PCOS患者胰岛素受体信号通路与炎性因子信号转导相互影响[11],刺激卵巢内炎症因子IL-6、TNF-α分泌,造成卵巢组织慢性炎症,引起卵泡闭锁和退化过程受阻,最终导致排卵障碍和囊状卵泡形成[3,12]。PCOS患者常伴有糖耐量异常,增加了脂质过氧化,导致患者氧化应激水平升高,而卵巢组织氧化应激又可引起卵泡细胞膜脂质过氧化,从而导致卵巢功能紊乱[13]。慢性炎症和胰岛素抵抗又可进一步加剧PCOS的病理进程[14]。因此,研究PCOS慢性炎症的发生与发展至关重要。
然而,PCOS的炎症机制目前尚未完全清楚。NLRP3炎症小体是由胞内固有免疫受体NLRP3、接头蛋白ASC和半胱氨酸蛋白酶caspase-1作为核心组成的多蛋白复合物,诱导炎症因子IL-1β和IL-18的成熟和分泌,从而促进炎症的发生,而NLRP3炎症小体的激活需要NEK7的参与。目前关于NEK7及NLRP3在PCOS低度慢性炎症中的炎症激活通路的研究尚未见报道。在本研究中,我们利用qPCR技术发现研究组患者卵巢颗粒细胞中NEK7及NLRP3在mRNA水平表达量增加。
此外也有证据表明,通过体外受精(IVF)助孕的患者其炎症因子不仅影响卵母细胞的受精,而且与妊娠能否成功密切相关[15]。在本研究中,我们发现研究组卵泡液中炎症因子IL-1β和IL-18高表达。IL-1β是NLRP3炎症小体激活的下游关键效应分子,影响系统或局部炎症反应,IL-1β和TNF-α共同参与免疫和炎症反应[16]。有研究报道IL-1β和TNF-α是影响排卵和妊娠成功的重要标记物[17]。炎性小体信号通路中另一个炎症因子IL-18,可被半胱氨酸蛋白酶caspase-1激活并释放[18]。IL-18是一个多功能炎症因子,在对抗宿主感染中起重要防御作用,在卵泡液中有显著表达[19]。有研究显示,取卵日血清中高水平的IL-18可能预示PCOS和卵巢过度刺激综合征的发生,而低水平的IL-18被发现是不明原因不孕的一个特征[20-21]。以上结果提示我们,PCOS卵巢颗粒细胞中NEK7及NLRP3的高表达可能促进卵泡液中炎症因子IL-1β和IL-18的释放,导致PCOS患者出现低度慢性炎症。本研究中相关性研究结果显示,NEK7及NLRP3mRNA表达水平与炎症因子IL-1β、IL-18呈显著正相关,进一步证明了NEK7与NLRP3炎症小体激活通路在PCOS炎症发生与发展中发挥一定作用。
另外,相关性研究结果显示NEK7及NLRP3与LH和LH/FSH呈显著正相关,提示NEK7及NLRP3可能与PCOS的发生相关。对此我们进行ROC曲线分析,研究结果显示NEK7mRNA水平对PCOS具有良好的诊断价值,而二者联合应用并不能有效增加对PCOS的诊断价值。
综上,PCOS患者卵巢颗粒细胞中NEK7及NLRP3在mRNA水平高表达,其可能通过激活炎性小体信号通路,促进炎症因子IL-1β、IL-18的释放,导致PCOS慢性炎症。同时NEK7对PCOS具有良好诊断价值,提示NEK7可能作为PCOS的治疗靶点,为PCOS的治疗提供新思路。

