miR-23a通过调节PPP2R5E促进人舌鳞癌细胞的增殖
陶亚东, 柳 雪, 孙继红, 霍 峰, 郭洪杰
(1.承德医学院附属医院口腔科, 河北 承德 067000 2.承德医学院校医院, 河北 承德 067000)
口腔癌是世界上最常见的第十一种恶性肿瘤,尤其是在发展中国家,在发病总数中排名第九[1]。在口腔癌中舌鳞癌最常见,舌鳞癌恶性程度高,生长速度快,浸润性较强,易转移,是口腔癌部位发生率最高的[2]。近几十年来,舌鳞癌的发病原因逐步明确,预防措施以及临床诊疗技术也不断发展,但舌鳞癌的五年生存率一直停滞在50%左右。多种miRNAs在舌鳞癌中表达失调,并与舌鳞癌的发生发展及预后有密切联系[3]。例如,miR-24和miR-184在舌鳞癌中表达上调,促进舌鳞癌的发生发展;miR-22和miR-137在舌鳞癌中表达降低,抑制舌鳞癌的侵袭和转移[4]。在舌鳞癌细胞中提高miR-23a的表达水平可以促进顺铂引起的凋亡[5]。本课题将探讨在舌鳞癌组织中异常高表达的miR-23a及其靶基因PPP2R5E对舌鳞癌细胞增殖的影响。
1 资料与方法
1.1实验对象和主要试剂:舌鳞癌组织由承德医学院附属医院口腔科收集提供。舌鳞癌细胞系CAL27、兔抗人PPP2R5E和GAPDH多克隆抗体均购自天津赛尔生物技术有限公司。RPMI1640、DMEM培养基、RIPA裂解液、BCA试剂盒以及各种细胞培养所需耗材均购自郑州森辉生物科技有限公司。美国GIBCO公司的胎牛血清。美国invitrogen公司的Trizol和Lipofectamine 3000。RT-PCR试剂购自北京TakaRa公司。反义寡核苷酸购自苏州吉玛基因股份有限公司。舌鳞癌细胞Tca8113系和实验所需质粒都由天津医科大学生命科学中心实验室惠赠。
1.2方 法
1.2.1细胞培养及转染:在37℃含5%CO2的细胞培养箱中,用含10%胎牛血清的RPMI1640培养Tca8113细胞,用含10%胎牛血清的DMEM培养CAL27细胞。用Lipo3000将质粒和对照载体转入Tca8113细胞中。
1.2.2RNA抽提:每份组织样品,加入1mL的TRIZOL试剂。样品匀浆后室温下孵育5min,然后加入0.2mL的氯仿。剧烈振荡15s,室温孵育3min。4℃离心15min,转速12,000r/min。沉淀RNA将上清液转移到新离心管中。每管加入0.5mL异丙醇。混匀后室温静置10min后,然后4℃ 12,000 r/min离心10 min。弃去上清液,4℃冷藏的75%乙醇每管加1 mL。RNA沉淀在空气中自然晾干,约10min。每管加入20μL无RNA酶溶解10min。-80℃保存备用。
1.2.3合成cDNA:配制体系:总RNA,0.8 μg;0.5ug/ul Oligo(dT),1μL;dNTPs Mix(2.5mM),1.6μL;无RNA酶的H2O,11.1μL; 总体积14.5 μL。65℃水浴5min, 冰上放置2min。瞬离后,在离心管中依次加入RT反应液:5×First-Strand Buffer,4μL;0.1 M DTT, 1μL; RNase Inhibitor, 0.3μL; SuperScript III RT,0.2μL。混匀后37℃ 1min,50℃ 60min,70℃ 15min。cDNA产物置于冰盒中待用,或-20℃保存备用。
1.2.4实时定量PCR实验:按照所需用量增加配比体积。配置比例如下:2 × Master Mix,5μL;10uM 的PCR特异引物F,0.5μL;10μM的PCR特异引物R,0.5μL水,2μL(引物序列详见表1)。加样 取8ul混合液分别加入至每个孔中,再按照实验分组分别加入相应的cDNA,2μL /孔;封膜,混匀,瞬离;置于冰板上备用。设置如下反应程序:95℃,8min; 95℃,10s;60℃,60s;42个循环。计算结果:收集结果,采用2-△△CT法分析数据。Folds=2-△△Ct,△△Ct=(Ct1-Ct2)-(Ct3-Ct4)。

表1 引物序列
1.2.5MTT实验:转染后于5%CO2的37℃培养箱中孵育18h后收获细胞进行计数。处理数据前,观察并去掉异常值,计算均数进行统计学分析。
1.2.6集落形成实验:细胞转染24h后消化重悬,进行计数,以每孔300个细胞种于12孔板上,各设置3个副孔。每3d换一次培养液,12d后对包含超过50个细胞的集落进行计数。用结晶紫染色集落,以集落形成率来分析结果。
1.2.7生长曲线实验:转染后24h收获细胞进行计数,以每孔3000个细胞种于12孔板上,各设置3个副孔。每3d换一次培养液,每天同一时间进行细胞计数,连续计数7d。记录计数结果,绘制生长曲线。
1.2.8荧光素酶报告实验:通过MiRbase和Targetscan等生物信息学软件预测,miR-23a可以结合到PPP2R5E 3'UTR,结合位点序列为:AATGTGA,将该序列突变为TAAGAGT。将包含结合位点长度为150bp的野生型和突变型PPP2R5E 3'UTR(PPP2R5E 3'UTR, PPP2R5E 3'UTR mut)构建到pCD3/EGFP载体中。以50nmoL/L ASO-NC,ASO-23a,或者200ng pcDNA3,pri-miR-23a和PPP2R5E 3'UTR, PPP2R5E 3'UTR mut质粒共转24孔板中的Tca8113细胞,使用Lipofectamine 3000进行转染, 4h后换液;转染48h后,RIPA裂解细胞,收获蛋白,测定荧光值。

2 结 果
2.1miR-23a在舌鳞癌组织中的表达:在10对舌鳞癌组织中应用实时定量PCR实验检测miR-23a的表达水平,结果显示在舌鳞癌组织中miR-23a的平均表达水平是相应癌旁组织的4.617倍。miR-23a在舌鳞癌组织中表达异常升高(P<0.01),见图1。
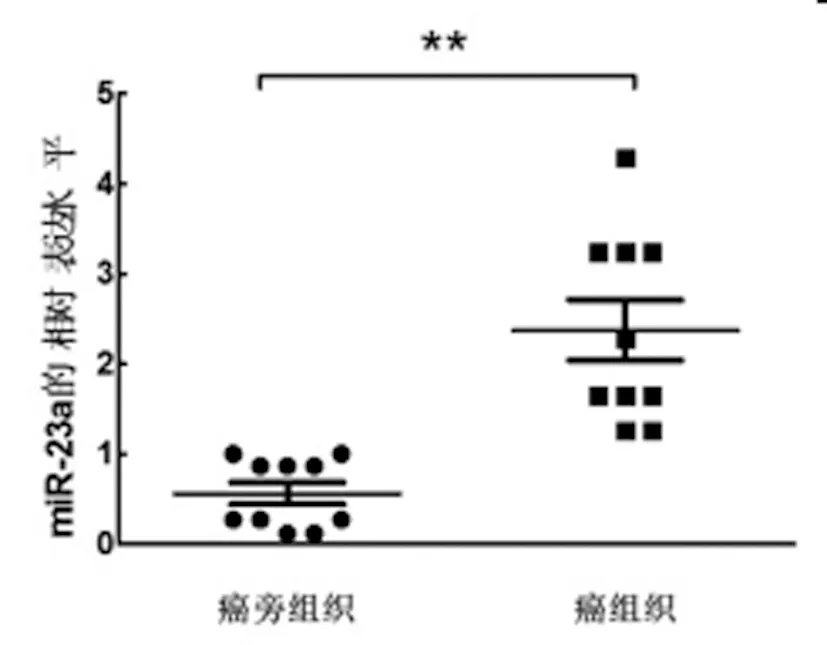
图1 舌鳞癌组织中miR-23a的相对表达水平
2.2miR-23a可以促进舌鳞癌细胞的增殖:在舌鳞癌细胞中,我们过表达或封闭miR-23a的表达,分别应用MTT实验、集落形成实验和生长曲线实验检测miR-23a对舌鳞癌细胞活性、集落形成能力和增殖能力的影响。在Tca8113细胞中,改变miR-23a的表达水平,应用MTT实验分别检测转染时、转染后24h,48h和72h的吸光光度值。结果显示,过表达miR-23a后,舌鳞癌细胞的活性明显增强;封闭miR-23a的表达后,舌鳞癌细胞的活性明显减弱(图2A)。与对照组相比,差异有统计学意义。在舌鳞癌细胞系Tca8113和CAL-27中,过表达miR-23a后,舌鳞癌细胞的集落形成率明显升高;封闭miR-23a的表达后,舌鳞癌细胞集落形成率明显降低(图2B和2D)。在Tca8113细胞中,改变miR-23a的表达水平,在一周内每天计数细胞的增长,过表达miR-23a后细胞,细胞增长明显加快;而封闭miR-23a后,细胞增长明显降低(图2C)。综上,miR-23a可以促进舌鳞癌细胞的增殖。

图2 miR-23a促进舌鳞癌细胞的增殖
(A)MTT实验检测miR-23a对Tca8113细胞活性的影响;(B)集落形成实验检测miR-23a舌鳞癌细胞系Tca8113和CAL27中过表达或封闭对细胞集落形成能力的影响;(C)生长曲线实验检测miR-23a对Tca8113细胞增殖能力的影响;(D)细胞集落形成的结晶紫染色结果。PCDNA3组是过表达组的对照,pri-miR-23a组是miR-23a过表达组;ASO-NC是miR-23a封闭组的对照,ASO-23a组是miR-23a封闭组。
2.3PPP2R5E是miR-23a的直接靶基因:通过TargetScan,miRBase等生物信息学网站PPP2R5E是miR-23a的潜在靶基因,miR-23a与PPP2R5E 3'UTR有一个结合位点,如图3、图4所示我们应用荧光报告载体实验进一步证实,在Tca8113细胞中,miR-23a的种子序列可以直接与PPP2R5E mRNA的3'UTR结合并抑制下游基因表达。在舌鳞癌细胞系中, miR-23a可以负性调控内源性PPP2R5E mRNA的表达。
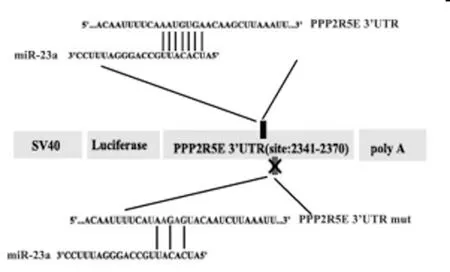
图3 miR-23a与PPP2R5E 3'UTR的结合位点信息
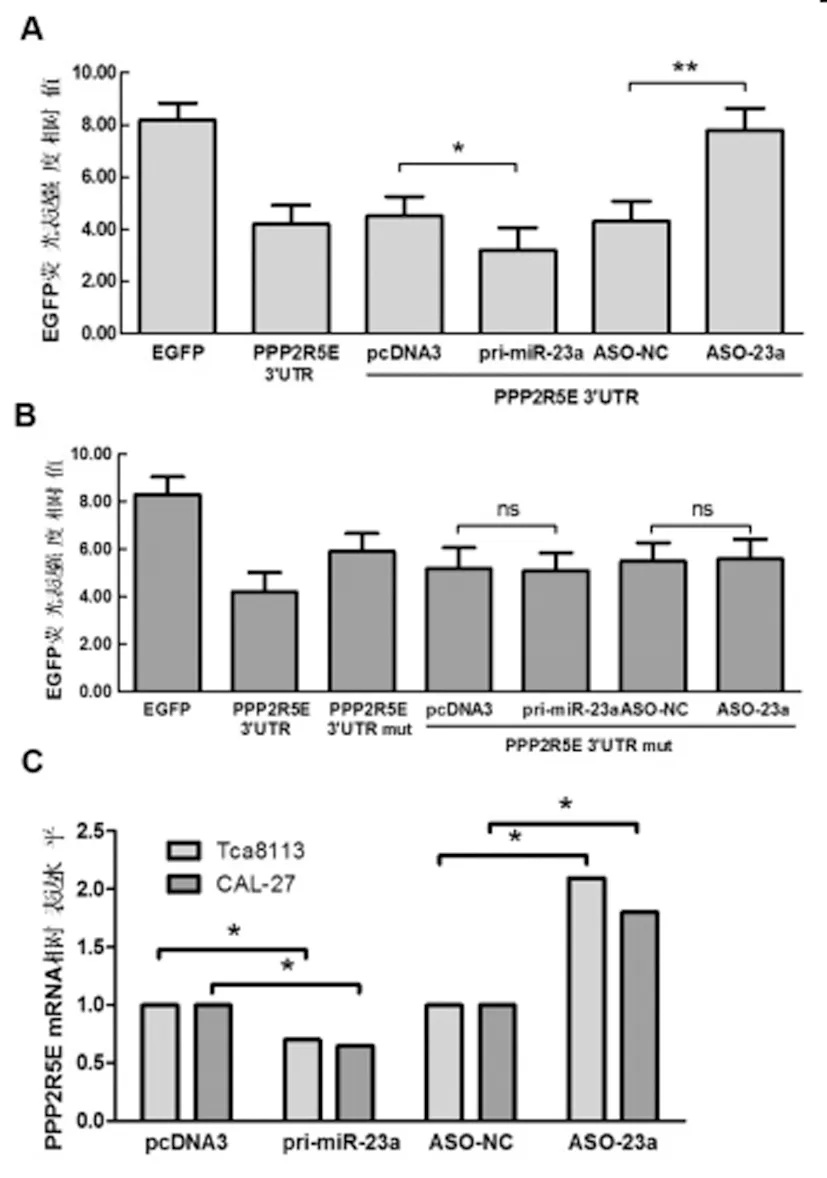
图4 PPP2R5E是miR-23a的直接靶基因且受miR-23a的负性调控
(A)miR-23a对野生型PPP2R5E 3'UTR荧光素酶的影响EGFP组为单独(B)miR-23a对突变型PPP2R5E 3'UTR荧光素酶的影响(C)miR-23a对 PPP2R5E mRNA水平的影响
分组设计:EGFP组为单独转染pcDNA3-EGFP,PPP2R5E 3'UTR组单独转染了pcDNA3-EGFP-PPP2R5E 3'UTR质粒,其他四组是共转染组,共同转染了pcDNA3-EGFP-PPP2R5E 3'UTR质粒以及如下四种: PCDNA3组是过表达组的对照,pri-miR-23a组是miR-23a过表达组;ASO-NC是miR-23a封闭组的对照,ASO-23a组是miR-23a封闭组。
单独转染pcDNA3-EGFP-PPP2R5E 3'UTR质粒比单独转染pcDNA3-EGFP的EGFP荧光表达强度低,由于Tca8113细胞中含有内源性miR-23a,与PPP2R5E 3'UTR结合抑制了下游的EGFP蛋白表达。将pcDNA3/EGFP-PPP2R5E 3'UTR与pcDNA3,pcDNA3-pri-miR-23a共转染后,pri-miR-23a组荧光表达强度比pcDNA3组明显降低,内源性miR-23a与PPP2R5E3'UTR结合抑制了下游EGFP蛋白表达,绿色荧光强度降低; PPP2R5E 3'UTR质粒与miR-23a的反义互补序列ASO-23a及对照组ASO-NC共转染,ASO-23a组的EGFP荧光强度明显高于ASO-NC组,表明内源性miR-23a被ASO-23a封闭后,不能与PPP2R5E 3'UTR相结合,解除对下游EGFP蛋白表达的抑制,荧光强度升高(图4A)。
对PPP2R5E 3'UTR中的miR-23a结合位点进行定点突变,构建pcDNA3/EGFP-PPP2R5E 3'UTR mut质粒。将PPP2R5E 3'UTR mut质粒分别与pcDNA3, pcDNA3-pri-miR-23a, ASO-23a及对照组ASO-NC共同转染Tca8113细胞,其荧光表达强度没有明显变化,表明PPP2R5E 3'UTR的 “种子序列”突变后,miR-23a不能再与PPP2R5E3'UTR结合,也不能抑制EGFP蛋白的表达,荧光强度没有变化(图4B)。
在Tca8113细胞中改变miR-23a的表达水平,应用实时定量PCR实验检测PPP2R5E mRNA的表达水平,结果显示:过表达miR-23a后,PPP2R5E mRNA表达水平明显下调;而封闭miR-23a后,PPP2R5E mRNA的表达水平明显升高(图4C)。统计学差异显著。
综上,miR-23a能够与PPP2R5E 3'UTR的结合,降低下游PPP2R5E mRNA的表达水平,由此证明 PPP2R5E是miR-23a的直接作用靶基因。
2.4PPP2R5E在舌鳞癌组织中的差异表达。
在10对舌鳞癌组织中,应用实时定量PCR实验检测PPP2R5E mRNA的表达水平,结果显示:在舌鳞癌组织中PPP2R5E mRNA的平均表达水平为0.582,而在相应癌旁组织的表达水平为1.119。舌鳞癌组织中PPP2R5E的表达降低至0.582,P=0.027,差异有统计学意义。PPP2R5E在舌鳞癌组织中表达异常降低(图5)。

图5 在舌鳞癌组织中PPP2R5E的表达水平
2.5PPP2R5E抑制舌鳞癌细胞的增殖。
我们在舌鳞癌细胞系中,分别转染pcDNA3/HA-PPP2R5E和pSilencer/sh-PPP2R5E及其空载体pcDNA3和pSilencer,改变舌鳞癌细胞中PPP2R5E mRNA的表达,应用MTT实验、集落形成实验和生长曲线实验检测其对舌鳞癌细胞活性,集落形成能力和增殖能力的影响。MTT实验结果显示,过表达PPP2R5E后,细胞的吸光光度值较对照组明显降低,即细胞活性减弱;而干扰PPP2R5E的表达后,细胞的吸光光度值较对照组明显升高,即细胞活性增强,差异有统计学意义(图4A)。集落形成实验结果显示,干扰PPP2R5E的表达后,细胞集落数较对照组明显升高,即细胞集落形成能力增强;而过表达PPP2R5E后,细胞细胞集落数较对照组明显降低,即细胞集落形成能力减弱,差异有统计学意义(图6B和6D)。生长曲线实验结果显示,过表达PPP2R5E后,细胞数较对照组明显减少;而干扰PPP2R5E的表达后,细胞数较对照组明显增加,差异有统计学意义(图6C)。综上,过表达PPP2R5E可以抑制舌鳞癌细胞的增殖,而干扰PPP2R5E的表达可以促进舌鳞癌细胞增殖。PPP2R5E基因可抑制舌鳞癌细胞增殖,在舌鳞癌中起抑癌基因作用。

图6 PPP2R5E抑制舌鳞癌细胞增殖
(A)PPP2R5E对Tca8113细胞活性的影响(B)PPP2R5E对Tca8113和CAL-27细胞集落形成能力的影响(C)PPP2R5E对Tca8113和CAL-27细胞生长能力的影响(D)Tca8113细胞集落形成的结晶紫染色图片。pcDNA3组是过表达的对照组,PPP2R5E为过表达pcDNA3/HA-PPP2R5E的组,pSilencer是敲降组的对照,sh-PPP2R5E组是转染pSilencer/sh-PPP2R5E的敲降组。
3 讨 论
在多种肿瘤中都发现miR-23a表达异常升高,促进了肿瘤的发生发展。miR-23a在胰腺癌中表达升高,并促进胰腺癌细胞的增殖和转移[6]。在结肠癌组织和细胞中miR-23a表达升高,并通过靶定PDK4促进结肠癌细胞增殖[7]。miR-23a在胃癌组织和细胞中表达异常升高,并促进胃癌细胞的增殖和转移。
同时,作者在本研究也发现miR-23a在舌鳞癌组织中表达明显升高。因此,推断miR-23a在舌鳞癌中也可能发挥致癌基因作用。本研究发现miR-23a过表达可明显促进舌鳞癌增殖,而封闭miR-23a表达可以抑制其增殖,与文献所得的研究结果相符,miR-23a在舌鳞癌中发挥致癌基因作用,对miR-23a在肿瘤中的作用做了进一步补充。
miRNAs通过调控其下游靶基因的表达水平从而影响一系列生理病理过程。miR-23a可以直接靶定并调控NID2,ESRP1,XIAP等重要功能基因来调节肿瘤细胞的增殖、凋亡、侵袭和迁移等[8]。PPP2R5E在胃癌组织和细胞中表达降低。
本研究发现PPP2R5E在舌鳞癌组织中表达明显高于对应癌旁组织,与miR-23a的表达趋势相反,而且通过生物信息学预测miR-23a确实可以与PPP2R5E3'UTR结合,因此,笔者推测在舌鳞癌中,PPP2R5E可能是miR-23a的潜在靶基因。实验结果显示:miR-23a可以抑制野生型PPP2R5E3'UTR荧光素酶活性,但不影响突变后的PPP2R5E3'UTR mut的荧光素酶活性, 改过表达miR-23a可以明显抑制PPP2R5E mRNA的表达。因此,在舌鳞癌细胞中PPP2R5E确实是miR-23a的直接作用靶基因。miR-23a可以调节PPP2R5E的表达水平,进而影响舌鳞癌细胞的增殖。
综上,本研究表明miR-23a可以通过直接靶定并下调PPP2R5E的表达水平促进舌鳞癌细胞的增殖,为舌鳞癌的早期诊断和治疗,提供了新的理论依据和潜在作用靶点。
——一道江苏高考题的奥秘解读和拓展

