Lnc RNA PCGEM1通过TGF β2/Smad2信号通路调控食管癌细胞侵袭和转移研究
刘 勇, 王 斌, 金建琴, 陈思思
(湖北医药学院附属十堰市人民医院, 湖北 十堰 442000)
作为恶性肿瘤,食管癌(esophageal cancer,EC)死亡率一直居于首位,对人们的生命健康造成了严重的威胁。EC早期症状不明显,患者在就诊时往往处于晚期,目前治疗EC的主要手段是手术及术后化疗药物灌注,但患者的5年生存率仅有10%[1],因此寻找新的治疗靶点尤为迫切。长链非编码RNA(long-chain noncoding RNA,Lnc RNA)是一类不编码蛋白的RNA分子,长度介于200~100000 nt之间[2]。研究表明[3],Lnc RNA在肿瘤细胞周期、肿瘤细胞侵袭转移与化疗耐药等相关的信号通路方面均发挥调节作用,其作用类似于癌基因或抑癌基因。Lnc RNA PCGEM1是一种在前列腺癌细胞中特异性高表达的Lnc RNA,并已证实可促进前列腺癌细胞的增殖和迁移。但目前关于PCGEM1在EC中的作用研究报道甚少,因此,本研究通过对EC组织和Eca-109细胞株的研究,探讨PCGEM1在EC进展中的作用机制。
1 材料和方法
1.1组织标本:收集2016年3月至2018年5月于我院接受手术治疗的62例EC患者癌组织及距离癌组织超过2cm处的正常组织,所有病例标本经组织病理学检测证实为原发性EC,其中腺癌32例,鳞癌30例。患者年龄35~76岁,中位年龄55岁。所有患者均同意本研究并签署知情同意书,且经我院伦理委员会审核批准后收集标本。
1.2细胞及主要试剂和仪器:人正常食管上皮细胞HET-1A,人食管癌细胞株Eca-109、SHEEC1、Ec-9706、EC8712、TE-1均购自上海赛百慷生物技术股份有限公司。siPCGEM1及阴性对照siNC、miR-148a-minic及阴性对照NC-minic,PCGEM1及U6引物均由上海吉玛制药技术有限公司设计完成。DMEM培养基(D777);SYBR Green 荧光定量PCR 检测试剂盒(QPK-201)于TOYOBO采购;Trizol reagent(9009)采购自TaKaRa;MTT试剂盒购自碧云天;Western blotting底物试剂盒及抗体购自北京百奥莱博科技有限公司。苏净Airtech超净工作台;SANYO MCO-15AC细胞培养箱;Nikon Ti-U/Ti-s倒置荧光显微镜;5810R 型高速离心机;Roche R480实时荧光定量PCR仪。
1.3细胞转染:调整食管癌Eca-109细胞株浓度至1×106个/mL,取2mL接种于6孔板中,培养过夜,采用Lipofectamine 2000将浓度均为100 nmoL/L的siPCGEM1和阴性对照转染至细胞,细胞分为:Eca-109-siPCGEM1组和Eca-109-siNC组,以Eca-109作为空白对照组。收集对数生长期的Eca-109-siPCGEM1细胞,采用上述方法转染simiR-148a及阴性对照siNC-minic,并分为Eca-109-siPCGEM1+simiR-148a组和Eca-109-siPCGEM1+simiR-148a组。
1.4qRT-PCR检测Lnc RNA PCGEM1的表达:采用Trizol法提取各组细胞总RNA并进行反转录,按照PrimeScrip反转录试剂盒进行反转录成cDNA,采用SYBR Premix Ex Taq说明书配置PCR反应体系,反应条件为:95℃预变性10min,然后95℃ 10s,60℃ 30s,72℃ 10s,40 个循环;95℃ 5s,60℃ 1min,95℃ 30s。U6作为内参(上游引物为 5'-CTCGCTTCGGCAGCACA-3',下游引物为 5'AACGCTTCACGAATTTGCGT-3'),Lnc RNA PCGEM1(上游引物为 5'-ACTGTCTCCCAACCCTTGTA-3',下游引物为5'-GTGCAGGGTCCGAGGT-3'),miR-148a(上游引物为 5'-ACTGTCTCCCAACCCTTGTA-3',下游引物为5'-GTGCAGGGTCCGAGGT-3')相对表达量用2-△△CT表示。每个样本独立重复实验3 次。
1.5MTT及平板克隆实验检测细胞增殖:将各组细胞按照每孔500-1000 个密度铺至96 孔板,轻轻混匀后,置入37℃培养箱继续培养,每孔加MTT溶液20μl,37℃避光4h 后,弃掉孔内液体,再加DMSO各100μl,置于37℃摇床上快速振荡15min,以便充分溶解结晶物,最后将96 孔板置于酶标仪上检测 492nm 处的OD值。将上述两种稳转细胞按每孔5×103个密度铺6孔板继续培养,隔周更换新鲜培养液,2周后用考马斯亮蓝染色,在显微镜下计数菌落形成数量。
1.6划痕实验检测细胞迁移:将各组细胞E按5×105均匀铺至6孔板,用10μl白枪头划线并以尺子辅助,加PBS将细胞碎片冲洗掉,然后加1%血清的培养基,置于显微镜下拍照并做好标记,此时记为0h,继续于37℃、5%CO2温箱培养,培养24h于倒置显微镜下观察细胞运动情况并拍照。
1.7生物信息学预测:使用生物信息学网站StarBase预测PCGEM1可互补结合的微小RNA(microRNA,miRNA),在根据Targetscan网站预测相应miRNA可靶向结合的基因。
1.8Western blotting检测:将转染48h的Eca-109细胞,加入适量的RIPA裂解液,裂解30min,12 000/min 4℃离心10min,收集上清,采用ECA试剂盒检测蛋白浓度,将蛋白样品和Loading buffer混合,100℃水域变性5min,然后加入至制备好的SDS-PAGE凝胶(5%浓缩胶,10%分离胶)上样孔中,每孔25μl,浓缩胶时调整电压为60V,分离胶电压为120V,结束后取出凝胶,4℃转膜1.5h,采用5%脱脂奶粉封闭PVDF膜2h,加入TGF-β2、Smad2一抗,4℃过夜,TBST洗膜后加入辣根过氧化物标记的羊抗兔IgG,37℃孕育2h后加入ECL显影,采用自动凝胶成像系统采集图像,以GAPDH作为内参,分析蛋白水平。
1.9统计学分析:用SPSS19.0对实验数据进行统计分析,计量资料以平均值±标准差表示,多组间比较采用单因素方差分析,两两采用独立样本t检验进行分析,以P<0.05为差异有统计学意义。
2 结 果
2.1Lnc RNA PCGEM1在EC不同组织和细胞中的表达:qRT-PCR结果显示,EC组织中 Lnc RNA PCGEM1的表达水平高于癌旁组织,且差异有统计学意义(P<0.05); Lnc RNA PCGEM1在肿瘤细胞中的表达明显高于人正常食管上皮细胞HFT-1A,差异均具有统计学意义(P<0.05),其中在Eca-109细胞中表达量最高(P<0.01),适合使用RNA干扰的方法进行后续Lnc RNA PCGEM1基因功能的研究,见图1。
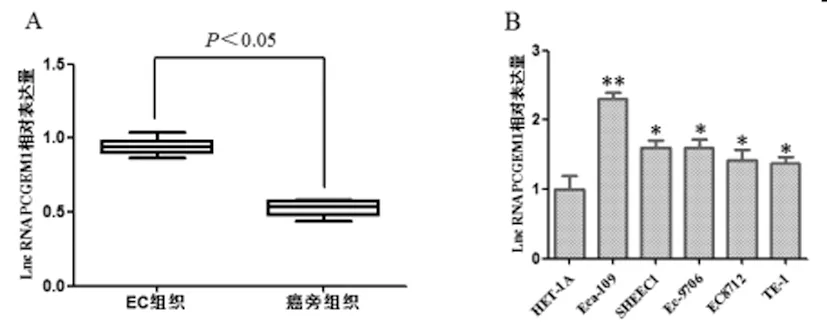
图1 Lnc RNA PCGEM1在EC组织和不同EC细胞系中的表达(A:Lnc RNA PCGEM1在不同组织中的表达;B:Lnc RNA PCGEM1在不同EC细胞系中的表达,与HET-1A相比,*P<0.05,**P<0.01)
2.2细胞系构建:qRT-PCR结果显示空白对照组和阴性对照组Lnc RNA PCGEM1的表达无统计学意义(P>0.05),Eca-109-siPCGEM1组细胞中Lnc RNA PCGEM1的表达量明显低于空白对照组和阴性对照组,差异具有统计学意义(P<0.05),提示成功构建PCGEM1沉默细胞系,见图2。

图2 Lnc RNA PCGEM1在各组Eca-109细胞中的表达
2.3Lnc RNA PCGEM1对EC细胞株Eca-109增殖能力的影响:平板克隆实验结果显示,沉默lnc RNA PCGEM1后,Eca-109-siPCGEM1细胞克隆数显著减少(P<0.05),空白对照组与Eca-109-siNC组间差异无统计学意义(P>0.05)。说明Lnc RNA PCGEM1被沉默后,细胞增殖能力显著降低,见图3。
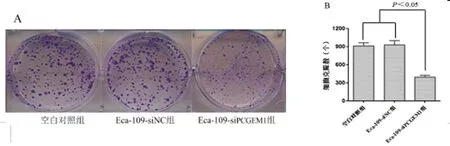
图3 Lnc RNA PCGEM1对EC细胞株Eca-109增殖能力的影响(A:平板克隆实验检测细胞增殖;B:各组Eca-109细胞平板克隆结果)
2.4Lnc RNA PCGEM1对EC细胞株Eca-109迁移能力的影响:细胞划痕实验结果,相比空白对照组Eca-109和阴性对照组Eca-109-siNC,Eca-109-siPCGEM1组细胞运动能力减弱,细胞的创伤愈合速率降低,差异具有统计学意义(P<0.05),说明沉默lnc RNA PCGEM1后,细胞迁移能力明显下降,见图4。

图4 Lnc RNA PCGEM1对EC细胞株Eca-109迁移能力的影响(A:划痕实验检测细胞迁移能力;B:迁移细胞数)
2.5生物信息学预测:采用StarBase网站预测结果显示,Lnc RNA PCGEM1可与miR-148a互补结合,再经Targetscan网站预测分析显示,miR-148a与TGFβ2存在靶向结合位点,qRT-PCR结果显示,Eca-109-siPCGEM1组中miR148的表达明显高于空白对照组与Eca-109-siNC组(P<0.05),见图5。
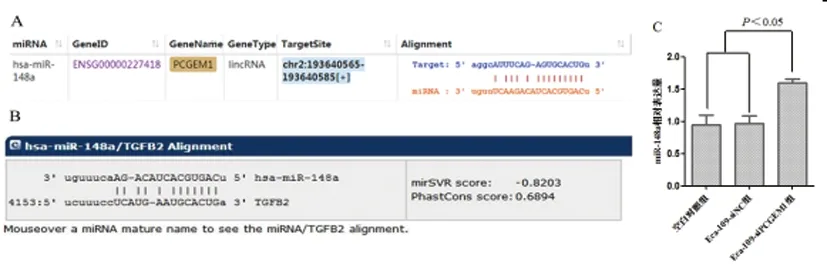
图5 生物信息学预测Lnc RNA PCGEM1与TGFβ2的关系(A:StarBase网站预测NEAT1与miR-148a互补结合位点;B:Targetscan预测miR-148a与TGFβ2靶向结合位点;C:miR-148a在不同细胞中的表达)
2.6下调miR-148a验证Lnc RNA PCGEM1对Eca-109细胞的影响:Eca-109细胞沉默Lnc RNA PCGEM1后,再下调miR-148a观察食管癌细胞增殖和迁移能力,siPCGEM1+simiR-148a组中miR-148a相对表达量明显低siPCGEM1+siNC组(P<0.05),提示沉默细胞系构建成功;平板克隆实验和划痕实验显示,siPCGEM1+simiR-148a组细胞克隆数明显增多,细胞运动能力增强(P均<0.05),说明下调miR-148a可逆转Lnc RNA PCGEM1沉默对Eca-109细胞的影响,见图6。

图6 下调miR-148a验证Lnc RNA PCGEM1对Eca-109细胞的影响(A:不同细胞中miR-148a的表达;B:平板克隆实验检测细胞增殖;C:各组Eca-109细胞平板克隆结果;D:划痕实验检测细胞迁移能力;E:迁移细胞数)
2.7Lnc RNA PCGEM1与TGF β2/Smad 2的作用关系:Western blot检测结果显示Eca-109-siPCGEM1组中TGF β2及Smad 2的表达明显低于空白对照组与阴性对照组(P<0.05),空白对照组和阴性对照组中上述指标的表达量差异无统计学意义(P>0.05),提示Lnc RNA PCGEM1对TGF β2/Smad 2通路蛋白表达的具有促进作用,见图7。

图7 Lnc RNA PCGEM1与TGF β2/Smad 2的作用关系(a:miR-148a在Eca-109细胞中的表达;b:Western blotting检测TGF β2和p-Smad2在Eca-109细胞中的表达;c:TGF β2和p-Smad2在Eca-109细胞中相对表达量,与空白对照组相比,*P<0.05)
3 讨 论
随着人们饮食结构和生活方式的改变,食管癌在多数国家的发病率均呈明显上升趋势。虽然近年来医疗技术取得飞速发展,但食管癌的发病、浸润和转移是由多种分子参与的复杂过程,已有的治疗手段不能抑制肿瘤细胞的增殖,导致治疗的失败。因此从分子生物学角度出发寻找其进展和转移的标志物,对于患者选择合适的治疗方法和预后指标的判定有着重要的意义。
目前关于Lnc RNA在肿瘤中的作用仅有一小部分被透彻研究,有些Lnc RNA在肿瘤中的表达异常改变,功能类似于癌基因或抑癌基因,可通过参与调控细胞周期,影响癌症的发生发展[4]。目前,尚无标志性Lnc RNA可以直接预测EC,但Lnc RNA PCGEM1在前列腺癌中特异性表达已由Srikantan等证实,该基因位于染色体2q32位点上。Zhang等[5]采用RT-PCR检测发现PCGEM1在结肠癌组织中的表达明显高于癌旁组织。Chen等[6]人研究表明在胰腺癌患者癌组织和血清中,Lnc RNA PCGEM1的表达量上升。Lnc RNA PCGEM1在胰腺癌细胞分化过程中表达量显著升高,而被沉默后,胰腺癌细胞的增殖能力减弱,并且增殖相关的基因亦表达量下降,由此推测Lnc RNA PCGEM1对胰腺癌细胞的增殖起到促进作用。本研究采用RT-PCR检测其在EC组织和癌旁组织中的表达发现,在EC组织中表达水平明显高于癌旁组织,提示Lnc RNA PCGEM1在EC的发生发展中可能起着重要作用。为了进一步研究Lnc RNA PCGEM1在EC中的作用,本研究构建了PCGEM1沉默细胞系,结果显示Lnc RNA PCGEM1下调后,EC癌细胞Eca-109的增殖能力和迁移能力明显下降。
研究表明[7],miRNA是通过碱基不完全互补的方式结合于靶基因上,从而影响肿瘤细胞的凋亡、迁徙与转移,并引发周围细胞的坏死与凋亡。同时miRNA也是Lnc RNA发挥作用的重要环节。本研究应用StarBase数据库,预测Lnc RNA PCGEM1可与miR-148a互补结合。李张维等[8]研究发现,miR-148a在食管癌组织中表达低于正常癌旁组织,上调miR-148a表达可抑制食管癌细胞的增殖和迁移,miR-148a作为癌基因对食管癌的进展发挥促进作用。本研究中,Eca-109细胞Lnc RNA PCGEM1沉默后,miR-148a表达上调,而下调miR-148a可逆转Lnc RNA PCGEM1基因沉默后Eca-109细胞株的生物学行为,提示Lnc RNA PCGEM1促进EC细胞株Eca-109的增殖作用可能与下调miR-148a有关。根据Targetscan 网站预测显示,miR-148a可互补结合TGF β2。本研究中,miR-148a表达上调后,TGFβ2蛋白的表达降低。TGF-β2/smad2 信号通路在肿瘤的发生发展中扮演了重要角色,该通路通过磷酸化转录因子Smad 蛋白,实现细胞内通路信号的传导[9]。Smad 蛋白包括 Smad1-Smad9,其中当 Smad2磷酸化水平受到抑制甚至沉默时,TGF-β2/Smad2信号通路的生物学功能发生转变,对肿瘤细胞增殖和侵袭起到抑制作用[10]。在本次实验中,我们发现过Eca-109-siPCGEM1组细胞中Smad2磷酸化水平明显降低。王劲等发现[11],下调Lnc RNA PCGEM1可调节TGF β2的表达从而抑制结直肠癌的侵袭及迁移。因此推断,Lnc RNA PCGEM1可能通过调节 TGF-β2/smad2 信号通路影响癌症的进展。
综上所述,Lnc RNA PCGEM1在食管癌中高表达,高表达Lnc RNA PCGEM1可能通过上调miR-148a水平,强化TGF β2/Smad2信号通路,从而促进EC的进展。可以将Lnc RNA PCGEM作为研究的新方向,为新型的生物药品提供理论基础。

