脑梗死患者血清ox-LDL IL-18 Lp-PLA2水平与颈动脉硬化斑块的相关性分析
张 军, 卢祖能
(武汉大学人民医院, 湖北 武汉 430000)
脑梗死又称为缺血性脑卒中,为临床常见中枢神经系统疾病,有较高病死率、致残率和复发率,严重影响患者生命健康[1]。脑梗死发病机制较复杂,与多种因素有关,而动脉粥样硬化为脑梗死的病理基础,目前较为公认的是损伤应答学说以及炎症学说(即内皮受损引发的功能障碍及炎症反应),多种刺激因子所致内皮细胞损伤是脑梗死发生的始发环节,白介素-18(Interleukin-18,IL-18)、脂蛋白相关磷酯酶 A2(lipoprotein-associated phosphatase A2,Lp-PLA2)是临床常用的炎性生物学指标,有研究指出血清氧化低密度脂蛋白(oxidized low density lipoprotein,ox-LDL)水平过高表达时,其所携带的胆固醇便积存在动脉壁上,久之易引起动脉硬化[2]。为此,本文对脑梗死患者血清ox-LDL、IL-18、Lp-PLA2水平与颈动脉硬化斑块的相关性进行分析,旨在为脑梗死患者病情评估和合理治疗方案制定提供理论参考。
1 资料与方法
1.1一般资料:选取2018年3月至2019年3月本院收治的120例脑梗死患者为对象。入选标准:符合2018年版《中国急性缺血性脑卒中诊治指南》有关诊断标准[3];入院后经颅脑MRI扫描检查确诊;病情发作到入院的时间短于48h;患者知情同意本次研究。排除标准:脑梗死后再出血;血流动力学不稳定;近半年内存在手术史或全身出血史;存在自身免疫性疾病和其它炎性疾病;合并严重肝肾功能损害等疾病。120例脑梗死患者纳为研究组,男68例、女52例,年龄48~70(60.08±3.15)岁,体质量指数BMI 21~28(24.08±1.02) kg/m2。同时纳入同期在本院体检的35名健康志愿者为对照组(既往无脑血管病病史且经头颅CT检查不存在脑卒中),对照组男20例、女15例,年龄39~81(51.09±3.12)岁,BMI 20~27(23.99±1.05) kg/m2。研究组和对照组基线资料比较差异不显著(P>0.05),有一定可比性。
1.2研究方法:①标本采集:采集患者3mL晨起空腹静脉血,室温凝固30min后,常规离心分离血浆留存血清后,置于-40℃冰箱内待测,全自动生化分析仪(德国产,型号为O-LYMPUS AU2700)检测两组血清中白介素-18(IL-18)、Lp-PLA2水平,ELISA试剂盒由美国RnD公司提供,操作过程严格按照说明书进行。②颈动脉超声检查:数字彩色多普勒超声仪(型号为SSD-d4000;日本ALOKA阿洛卡株式会社)测量两组研究对象的颈动脉内膜中层厚度(Carotid intima-media thickness,CIMT)、斑块最大面积,同时计算Crouse积分[4]。

2 结 果
2.1两组一般资料比较:研究组性别、年龄、BMI、吸烟史、饮酒史、糖尿病史占比与对照组比较无显著性差异(P>0.05),见表1。
表1 研究组对照组一般资料比较
2.2两组血清ox-LDL、IL-18、Lp-PLA2水平变化:研究组血清ox-LDL、IL-18、Lp-PLA2水平较对照组明显高(P<0.05),见表2。

表2 两组血清ox-LDL IL-18 Lp-PLA2水平变化
2.3两组颈动脉硬化斑块情况比较:研究组CIMT、斑块最大面积、颈动脉斑块Crouse积分明显高于对照组(P<0.05),见表3。

表3 两组颈动脉硬化斑块情况比较
2.4血清ox-LDL、IL-18、Lp-PLA2水平与颈动脉硬化斑块的相关性:分析提示CIMT、斑块最大面积、Crouse积分均与血清ox-LDL、IL-18、Lp-PLA2水平呈正相关(P<0.05),见表4。
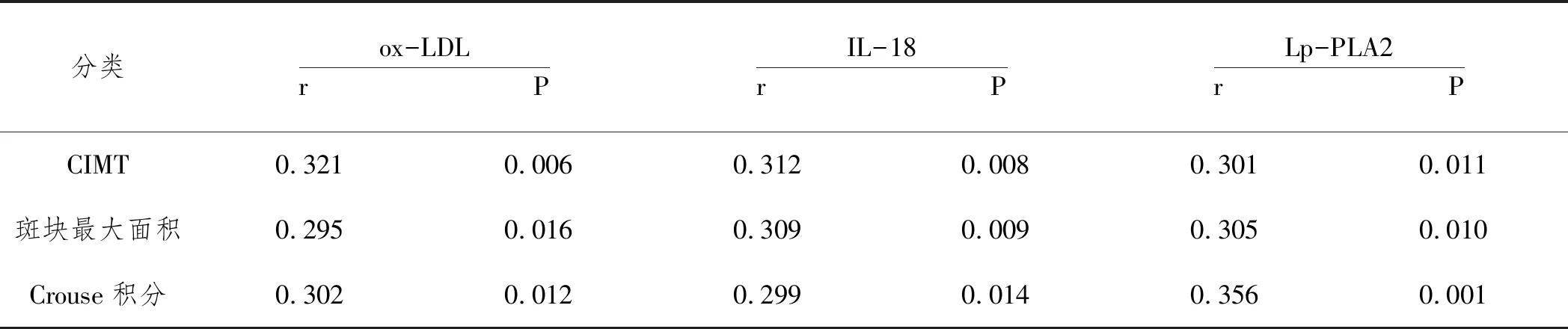
表4 血清ox-LDL IL-18 Lp-PLA2水平与颈动脉硬化斑块的相关性
3 讨 论
自国外学者首次指出动脉粥样硬化整个发展过程属于一种慢性炎症性反应,近年来国内外不少学者逐步深入探究了动脉粥样硬化与炎症反应的关系,并证实了炎症反应在动脉粥样硬化中的重要作用,表明炎症因子与动脉粥样硬化发生、发展以及斑块破裂等密切相关[5];IL-18、Lp-PLA2是近些年来评估机体炎症反应的常用指标,李亮等[6]研究证实血清Lp-PLA2水平与颈动脉超声造影联合检测将有利于早期颈动脉斑块易损性的评估,在疾病临床筛查以及干预治疗中能够提供依据,相关研究指出IL-18表达水平与急性脑梗死患者脑梗死面积密切相关[7];近期有学者研究表明血清ox-LDL在动脉粥样硬化性心脑血管疾病发生和进展中起到重要的临床作用[8]。
本次研究结果显示:两组性别、年龄、BMI等无显著差异,较好地排除了基线资料对本次研究结果准确性的影响,同时本研究还显示研究组血清ox-LDL、IL-18、Lp-PLA2水平、CIMT、斑块最大面积、颈动脉斑块Crouse积分均明显高于对照组,并且CIMT、斑块最大面积、Crouse积分均与血清ox-LDL、IL-18、Lp-PLA2水平呈明显的正相关,提示与健康人群相比,脑梗死患者血清ox-LDL、IL-18、Lp-PLA2水平呈明显升高趋势且存在明显的动脉粥样硬化,而相关性结果则提示血清ox-LDL、IL-18、Lp-PLA2或参与了颈动脉粥样硬化形成。研究指出ox-LDL水平升高时会损伤动脉血管内皮细胞,继而加剧脂质沉积在内皮细胞下,最终单核细胞被诱导演变为巨噬细胞、泡沫细胞,引发动脉粥样硬化;正常情况下血液中LDLC不会轻易被氧化,一旦血管壁破裂,血管内皮细胞的通透性随之明显的增加,最终释放大量的氧自由基,LDLC最终被氧化成为ox-LDL,并聚集在内皮下激活内皮细胞、树突细胞以及巨噬细胞等多种血管壁细胞后,引发系列炎症反应以及应激反应,参与脑梗死病理过程;Lp-PLA2是一种新型炎性因子,研究指出Lp-PLA2可促进动脉粥样硬化形成;IL-18作为一种前炎症因子,有潜在的致炎作用,能够通过释放r-干扰素,从而促进炎症反应诱发动脉粥样硬化[9],因而脑梗死患者血清ox-LDL、Lp-PLA2和IL-18呈明显上升趋势。并且血清ox-LDL、Lp-PLA2和IL-18参与了颈动脉粥样硬化形成,具体机制或与ox-LDL抑制巨噬细胞游离、促使上皮细胞脱落,加速内皮病变,并且在ox-LDL作用下,内皮细胞释放出多种包含IL-18等的细胞因子,引发血管斑块破裂以及血栓形成等有关。
基于以上分析,血清ox-LDL、Lp-PLA2、IL-18参与了脑梗死、颈动脉粥样硬化等病理过程,或可为脑梗死患者病情评估和早期防治方案制定提供参考。

