不同产地黄秋葵粗多糖体外抗氧化活性研究
何宝佳,魏 蔚,张艳华,彭王海,都帅帅,王伟前
黄秋葵(Abelmoschus moschatus)源产地非洲,于20世纪90年代传入中国[1].目前,我国很多地区均已种植.研究表明,黄秋葵的水提液可以提高寒冷条件下小鼠存活率,消除运动后的乳酸堆积,降低血清尿素氮含量.黄秋葵的新鲜嫩果可供食用,含有丰富的蛋白质、不饱和脂肪酸、游离氨基酸、矿物质、维生素、生物碱等多种活性成分,此外,其果实中还含有丰富的黏液质,具有促进胃肠蠕动、抗胃炎、通便等功效,其叶、芽、花也可食用,花、种子、根均可入药.黄秋葵含有丰富的营养物质,黄秋葵嫩果中由果胶和粗多糖等组成的粘性物质对人体具有促进消化[2-3]、调节血糖血脂、延缓衰老等功效,大量研究[4-6]证实,从天然产物中分离出的多糖具有重要的生物学功能[7],特别是抗氧化作用.抗氧化能力的强弱与多糖的含量具有一定的联系,不同产地、不同采收期,甚至是不同部位的黄秋葵,其胶质多糖的含量会有差异[8-9],故本实验采用吉林、安徽两产地6月份、8月份、10月份采收期的黄秋葵嫩果,从中提取多糖活性成分进行初步的体外抗氧化活性强弱的研究.黄秋葵可以被选来作为一种保健蔬菜食用,日后可增加对不同产地、不同药用部位的黄秋葵粗多糖抗氧化作用的功能研究.
1 试验材料与方法
1.1 材料
(1)仪器.超声波清洗器(宁波海曙科生超声设备有限公司),电热鼓风干燥箱(上海三发科学仪器有限公司),紫外分光光度计(上海元析仪器有限公司),电子天平(上海良平仪器仪表有限公司),恒温水浴锅(上海浦东电理仪器厂),旋转蒸发仪(巩义市予华仪器有限公司),索氏提取器等实验室常用仪器.
(2)原料.黄秋葵嫩果(购自吉林、安徽的农贸市场).
(3)试剂.DPPH(1,1-二苯基苦味酰基苯肼);维生素C、石油醚、无水乙醇(均为分析纯);蒸馏水.
1.2 方法与步骤
(1)黄秋葵嫩果粗多糖的制备.
①石油醚脱脂[10]:将所采购的吉林、安徽两产地的黄秋葵果实置于电热鼓风干燥箱中烘干(60 ℃)后粉碎,过80 目筛制成黄秋葵粗粉.将黄秋葵粗粉置于索氏提取器中,用石油醚(沸点30~60 ℃)重复回流3次进行脱脂操作,每次脱脂时间2 h,以除去黄秋葵粗粉中的脂溶性物质[11-12].
②超声辅助浸提[10]:脱脂后的黄秋葵粗粉置于水浴锅锅盖上,设置加盖水浴锅的温度恒定为50 ℃,促进粗粉中的石油醚挥发完全,之后将黄秋葵粗粉置于烘箱中(50 ℃)烘干1 h 后取出.往烘干后的粗粉中加入蒸馏水(1∶30料液比)[3],超声提取(50 ℃,每次15 min,重复2次)合并2次的提取液进行抽滤,再过滤得滤液.使用旋转蒸发仪将滤液减压浓缩至1/5原体积得浓缩液.
③乙醇沉淀[9]:往浓缩液中加5 倍量浓缩液体积的无水乙醇进行醇析,静置过夜留取沉淀物,经减压干燥得黄秋葵粗多糖.
(2)测定黄秋葵粗多糖对DPPH 自由基(DPPH·)的清除率.
①配制DPPH工作液:精密称取4 mg DPPH,用无水乙醇定容至100 mL 得100 μmol/L DPPH的工作液,低温存放[6].
②精密称取样品1.000 0 g,用蒸馏水溶解并定容至100 mL,分别吸取2~7 mL 样品液于6 个25 mL容量瓶中用蒸馏水定容[13],配置样品液的浓度为0.8~2.8 mg·mL-1.
③向6只已编号的10 mL的具塞管中分别滴加3 mL的DPPH溶液,再顺次加入不同质量浓度的样品溶液1 mL,充分混匀,测避光[5,6]放置30 min后的各管在波长517 nm[6-7,9-10]下的吸光度(A)值.每个质量浓度均设置3 个平行管同时测量,吸光度结果取3个测量值的算术平均值[6].
清除率计算公式如下:
DPPH·清除率%=[A0-(A1-A2)]/A0*100%[6],A0为用等量的蒸馏水代替样品溶液进行空白对照时测得的A 值;A1为加入样品液(浓度为0.8 mg·mL-1、1.2 mg·mL-1、1.6 mg·mL-1、2 mg·mL-1、2.4 mg·mL-1、2.8 mg·mL-1)时测得的A 值;A2为用等量蒸馏水代替DPPH工作液时测得的A值.
④临做实验前用维生素C作对照,步骤与①相同,得与样品溶液相同的质量浓度维生素C溶液,步骤与③相同,获得维生素C对照组吸光度测量值.
2 结果与讨论
2.1 不同产地、不同采收期黄秋葵粗多糖含量测定结果
以葡萄糖为标准品,用蒽酮-硫酸法[2]进行糖含量测定,各数据间采用SPSS 23.0 统计软件中ANOVA方差分析,P<0.05,结果见表1,吉林8月份黄秋葵粗多糖含量明显高于别组,整体上来看,吉林黄秋葵粗多糖含量明显高于安徽.
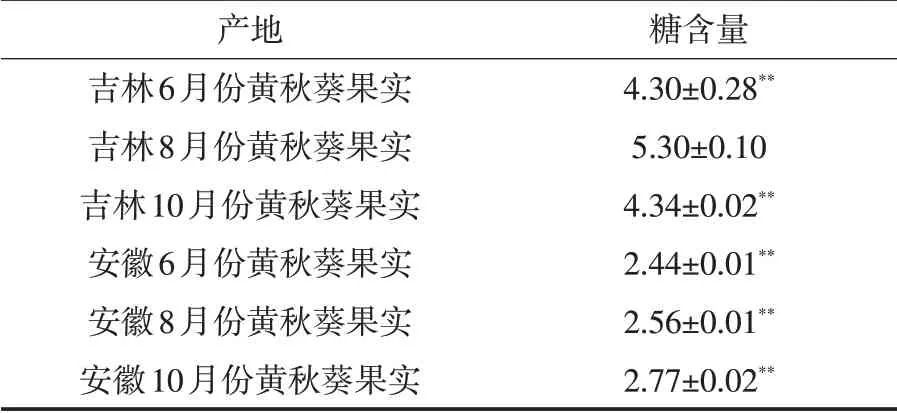
表1 不同产地不同采收期黄秋葵粗多糖含量 %
2.2 不同产地、不同采收期黄秋葵粗多糖对DPPH·的清除能力
在浓度0.8~2.8 mg·mL-1范围内,各数据间采用SPSS 23.0统计软件中ANOVA方差分析,P<0.05;随着黄秋葵粗多糖浓度的增加,其对DPPH·的清除率也增加,并且在0.8~2.8 mg·mL-1范围内6月份的清除率随着浓度的增加而明显升高,并趋于稳定.本次实验结果发现,安徽产地6月份、8月份、10月份的黄秋葵嫩果均有较强的抗氧化能力,6月份的抗氧化能力最强,抗氧化活性整体上要优于吉林产地的黄秋葵,尽管吉林省8月份黄秋葵抗氧化能力因其粗多糖含量高而相对较高,但与安徽相比较还是略低.结果详见表2.

表2 不同产地黄秋葵粗多糖对DPPH·的清除率 %
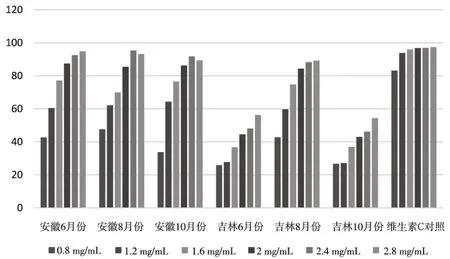
图1 不同产地不同采收期黄秋葵粗多糖对DPPH·的清除率
2.3 讨论
李晓等[13]研究发现,黄秋葵粗多糖具有良好的体外抗氧化活性,于梅等[14]对黄秋葵超微粉多糖的提取工艺进行优化并对其体外抗氧化活性也进行了研究,发现黄秋葵粗多糖对DPPH·等确实具有较强的清除能力,但是以往的研究均以单一产地为研究对象,且没有阐明具体的采收时间等问题,而本实验选择了不同产地、不同采收期黄秋葵,并对其粗多糖含量进行了比较分析,发现吉林产黄秋葵果实中的粗多糖含量远高于安徽产地,但从其DPPH·的体外抗氧化活性结果来看,安徽产6月份的黄秋葵对DPPH·的清除能力最强,分析其原因:可能是由于6月份是黄秋葵的盛果期,这个时候采收的黄秋葵其粗多糖中某些具有较强的抗氧化活性的单一成分含量较高,以至于其清除能力增强,本实验结果为今后确定黄秋葵的采收时间提供了一定的理论依据.本实验数据经SPSS 23.0 统计软件中ANOVA方差分析,P<0.05,说明各地区黄秋葵粗多糖对DPPH·的清除率结果具有统计学意义.
3 结论
近年来,随着对植物抗氧化活性成分研究的不断深入,植物性抗氧化物质在食品、化妆品和药品等领域的使用日益增多,其既可作为天然营养因子加入乳制品、焙烤食品和饮料产品中,也可开发成为功能性食品,作为健康饮品或保健饮品供给特定人群食用[15].因此,黄秋葵具有广阔的应用开发前景.本研究中,吉林产黄秋葵的粗多糖含量较高,但对DPPH·的清除能力略低于安徽6月份盛果期的清除能力,后期我们可对这两个样品中的粗多糖进行分离提纯,通过进一步的体外抗氧化活性实验及细胞模型和动物模型的体内抗氧化性做深入研究,以探究其构效关系,为其开发利用奠定一定的基础.黄秋葵体内存在的自由基种类很多,本实验仅初步研究了黄秋葵粗多糖对DPPH·的体外清除能力,过于单一,后期可以增加黄秋葵粗多糖对其他含氧自由基体外的清除能力研究.

