稻瘟病广谱抗性基因Pigm特异性分子标记的开发和应用
陈涛 孙旭超 张善磊 梁文化 周丽慧 赵庆勇 姚姝 赵凌 赵春芳 朱镇 张亚东 王才林,*
稻瘟病广谱抗性基因特异性分子标记的开发和应用
陈涛1, 2孙旭超1张善磊1梁文化1周丽慧1赵庆勇1姚姝1赵凌1赵春芳1朱镇1张亚东1王才林1,*
(1江苏省农业科学院 粮食作物研究所/江苏省优质水稻工程技术研究中心/国家水稻改良中心 南京分中心, 南京 210014;2扬州大学 江苏省粮食作物现代产业技术协同创新中心, 江苏 扬州 225009;*通信联系人, E-mail: clwang@jaas.ac.cn)
【目的】来自籼稻品种谷梅4号的是一个对稻瘟病菌具有广谱和持久抗性的重要基因。为有效提高基因的选择效率,有必要开发具有特异性的共显性分子标记进行辅助育种。【方法】本研究根据谷梅4号位点存在的特异性核苷酸变异,利用Tetra-primer ARMS-PCR和KASP两种不同的基因分型技术开发出分子标记T-和K-,对不同品种(品系)以及淮稻9号/谷梅4号的F2分离群体进行基因型检测,并结合穗颈瘟人工接种鉴定,对标记的准确性进行评价。【结果】序列比对分析表明,谷梅4号位点中基因起始密码子上游515 bp处存在一个特殊的单核苷酸变异。利用已开发的两种类型的分子标记能够有效区分3种不同的基因型,且基因型与穗颈瘟人工接种鉴定结果完全一致。【结论】利用分子标记T-和K-可以实现对基因型快速、准确的检测,加快抗稻瘟病水稻新品种的选育进程。
稻瘟病;;特异性标记;四引物扩增受阻突变体系PCR;竞争性等位基因特异性PCR
稻瘟病是由子囊菌[(Hebert) Barr.,无性态]引起的一种重要的真菌性病害,给世界粮食安全造成严重威胁[1-3]。实践证明,利用品种抗性是防治稻瘟病最经济、安全、有效的途径。由于稻瘟病菌具有高度的遗传多样性和变异性,品种抗性极易丧失,如何选育具有广谱、持久抗性的水稻品种一直是育种家关注的焦点。随着分子标记技术的发展和水稻基因组测序的完成,已有大量稻瘟病抗性基因被定位和克隆。迄今,至少报道了69个位点的100多个稻瘟病抗性主效基因,其中约45%来源于粳稻,51%来源于籼稻,4%来源于野生稻,并成功分离出30多个抗性基因[4]。从已克隆的基因来看,多数基因在染色体上具有成簇分布的特点。其中,、等是位于第6染色体短臂靠着丝粒附近的一个抗性基因簇,而、、、等则集中在第11染色体长臂的另一个基因簇。目前已发掘的稻瘟病抗性基因虽然较多,但大多存在抗谱窄、抗性不强等缺陷,难以进行育种利用[5-9]。
是来源于我国四川籼稻地方品种谷梅4号的一个广谱、持久抗性基因,它对不同国家和地区收集的30个强致病菌株中的29个表现为高抗和免疫[10]。研究表明,位点是一个包含13个NBS-LRR类抗病基因的基因簇,其中6为位点的抗病基因(),而8为感病基因()。PigmR自身可以形成同源二聚体,发挥广谱抗病功能,但导致千粒重降低;而受表观遗传调控的PigmS蛋白可以与PigmR竞争形成异源二聚体抑制PigmR介导的广谱抗病性,减轻病原菌产生致病性进化的选择压力,使其具有持久抗性,同时提高结实率,抵消千粒重降低对产量的影响[11]。由于基因具有广谱、持久抗性且不影响产量的优点,因而在籼稻特别是杂交籼稻抗病改良中得到广泛应用。通过谷梅4号及其衍生品种选育出的不育系川谷A、中谷A、谷丰A、广抗13A及其配制的杂交组合在生产中表现出良好的抗性。
传统稻瘟病抗病育种是在充分发病的条件下根据植株症状进行选择,这种方式不仅费时耗力而且极易受环境干扰,准确性不高。为提高基因的选择效率,已有研究者开发出不同类型的分子标记来鉴定其抗性基因型,并筛选出一些目标基因纯合的新材料[6, 12-13]。然而,在实际应用过程中这些标记存在亲本间多态性差、准确性不高、无法有效区分抗病纯合和杂合基因型等缺点,难以满足育种需求。为进一步开发高效、快捷且具有特异性的共显性分子标记,本研究根据谷梅4号Pigm位点存在的特异性核苷酸变异,利用四引物扩增受阻突变体系PCR(Tetra-primer Amplification Refractory Mutation System PCR,Tetra-primer ARMS-PCR)和竞争性等位基因特异性PCR(Kompetitive Allele- Specific PCR,KASP)两种不同的基因分型技术[14-15],设计相关引物并对基因型进行检测,以期为高效选育广谱、持久稻瘟病抗性品种提供技术手段。
1 材料与方法
1.1 试验材料
供试水稻品种(系)包括含抗性基因的籼稻地方品种谷梅4号(四川),以高感品种丽江新团黑谷为轮回亲本的4个近等基因系IRBL9-W()、IRBLz5-CA-1()、IRBLz-Fu()、IRBLzt-T()以及含该位点其他复等位基因材料IR65482-4-13()、二八占();籼稻恢复系材料镇恢084(江苏)、93-11(江苏)、中恢8006(浙江)、成恢727(四川)、宜恢1577(四川)、红恢589(贵州)、先恢527(湖南)、明恢63(福建)、航1号(福建)、金恢2号(广西)、广恢998(广东);籼稻保持系材料宁香1B(江苏)、川香29B(四川)、荃93-11B(安徽)、珍汕97B(江西);籼稻两系不育系03S(安徽)、Bph68S(湖北)、P88S(湖南)、培矮64S(湖南);常规粳稻品种包括日本晴(日本)、越光(日本)、一品(韩国)、珍富10号(韩国)、楚粳39(云南)、毕粳44(贵州)、宝农34(上海)、浙粳97(浙江)、嘉58(浙江)、南粳505(江苏)、南粳9108(江苏)、淮稻9号(江苏)、豫粳8号(河南)、临稻17(山东)、圣稻20(山东)、宁粳40号(宁夏)、伊粳12号(新疆)、新稻32号(新疆)、津稻263(天津)、沈农265(辽宁)、辽粳10号(辽宁)、盐丰47(辽宁)、吉粳88(吉林)、龙粳29(黑龙江)。其他材料包括以高感穗颈瘟粳稻品种淮稻9号为母本,谷梅4号为父本杂交配组的F1植株以及300个F2单株。50份水稻品种(系)由江苏省农业种质资源保护和利用平台提供,并在江苏省农业科学院粮食作物所南京试验田进行播种、移栽,按常规栽培方式进行田间管理。
穗颈瘟人工抗性接种鉴定所采用的含ZB3生理小种的菌液由江苏省农业科学院植物保护研究所提供,孢子浓度约为5×104个/mL。
1.2 试验方法
1.2.1序列对比、测序和引物设计
从NCBI数据库下载谷梅4号位点全长DNA序列(KU904633),选择-基因5′端上游序列和内含子序列分别与日本晴、明恢63、珍汕97和93-11基因组序列进行在线BLAST分析(https://www.ncbi.nlm.nih.gov, http://rice.hzau.edu. cn),发现谷梅4号中-基因起始密码子上游515 bp处和其他4个籼、粳稻品种存在一个G-C的碱基变异,同时结合3K水稻SNP与InDel子数据库以及设计引物对、、、、、复等位基因水稻材料测序结果进行分析,确定该变异特异性存在于谷梅4号位点中。在此基础上,参照Ye等[14]报道的在线四引物分析软件(http://primer1.soton.ac.uk/primer1.html)设计Tetra-primer ARMS-PCR引物,由上海赛默飞世尔科技(中国)有限公司(https://www. thermofisher. com/)合成;同时利用Oligo 7.57软件设计KASP引物,并综合考虑引物的Tm(Melting Temperature)值、发夹结构、二聚体、引物之间的互补情况,交由英国LGC公司北京办事处(https://www.lgcgroup.com /cn)合成分别带羧基荧光素(FAM)和5-六氯荧光素氨基磷酸酯(HEX)的引物。
1.2.2 DNA提取
水稻分蘖盛期,收集不同水稻品种、F1、F2群体的微量新鲜叶片,按CTAB法提取基因组DNA[16]。
1.2.3 四引物扩增受阻突变体系PCR检测
20 μL PCR体系包括DNA (10 ng/μL) 2.0 μL,四条引物(4 pmol/μL)各0.5 μL,10×缓冲液(含MgCl2)2.0 μL,dNTP (2.5 mmol/L)0.4 μL,(5 U/μL) 0.5 μL,ddH2O 13.1 μL。PCR反应程序如下:95℃下预变性5 min;95℃下变性30 s,55℃下复性30 s,72℃下延伸1 min,循环35次;72℃下延伸7 min,10℃冷却10 min,将扩增产物加溴酚蓝指示剂后备用。反应产物用加入DuRed核酸染料3.0%的琼脂糖凝胶130 V电泳30 min,在凝胶成像系统下观察记载。
1.2.4 竞争性等位基因特异性PCR检测
KASP基因分型在实时荧光定量PCR仪(ABI Step One Plus™)上进行,并设置3个以双蒸水代替模板DNA的空白对照。10 μL反应体系包括 DNA(10 ng/μL)1.0 μL,荧光引物混合液0.1 μL,2×KASP预混液5.0 μL,双蒸水 3.9 μL。反应条件如下:94℃下激活15 min;94℃下变性20 s,61℃~55℃下退火60 s(每一个循环降低0.6℃),10个循环;94℃下变性20 s,55℃下退火60 s,26个循环,数据分析在PCR仪自带的Step One Software 2.2.2软件上进行。
1.2.5 淮稻9号/谷梅4号F2群体单株的穗颈瘟抗性鉴定与评价
在水稻孕穗破口前5 d,对淮稻9号/谷梅4号F2群体的单株进行注射接种,每株注射3个稻穗,每穗接种1 mL菌液。接种选择在当天下午3:00后,以避免菌液的蒸发,影响接种效果。穗颈瘟发病调查的损失率为3个穗子损失率的平均值,病情分级参照NY/T 2646–2014进行[17]。其中,0级(高抗,HR):无病;1级(抗,R):小枝梗发病,穗平均损失率≤5%;3级(中抗,MR):主轴或穗颈发病,5%<穗平均损失率≤20%;5级(中感,MS):主轴或穗颈发病,谷粒半瘪,20%<穗平均损失率≤50%;7级(感,S):穗颈发病,大部分瘪谷,50%<穗平均损失率≤70%;9级(高感,HS):穗颈发病,穗平均损失率>70%,其中0、1、3 级记为抗病,5、7、9级记为感病。
2 结果与分析
2.1 谷梅4号Pigm位点中特异SNP变异的发掘和引物设计
谷梅4号位点基因组序列全长178 704 bp,由13个NBS-LRR类抗病基因(-~-)和大量转座元件(1个Ty3/gypsy类反转录转座子、13个长末端重复序列和33个DNA转座子)组成[11]。由于位点中-广泛存在该座位的其他复等位基因内,具有高度的保守性,同时考虑到-与-、-的编码序列(Coding Sequence,CDS)同源性较高,因此选择-基因5′端上游序列和内含子序列与测序粳稻品种日本晴的基因组序列进行同源性比对。结果表明,谷梅4号和日本晴在相关区域存在多个SNP变异。选择这些SNP位点上下游各200 bp的序列,利用华中农业大学基因组数据库中的明恢63、珍汕97和93-11基因组序列进行再次比对,发现谷梅4号中-基因起始密码子上游515 bp处的碱基G在4个测序品种中均为C。为确定该碱基变异的是否具有广泛的特异性,在3K水稻SNP与InDel子数据库(RFGB,http:// rmbreeding.cn/Jbrowse)中对2859份水稻相关位点的序列进行检索,没有发现该碱基为G的品种。由于与已克隆的、等均为同一位点的复等位基因,为有效区分同座位的其他基因,我们设计一对引物对含、、、、、基因水稻材料的相关序列进行测序分析。结果表明,该单核苷酸G的变异确实仅存在于谷梅4号的中(图1)。在此基础上进一步开发出Tetra-primer ARMS-PCR和KASP分子标记T-和K-(表1)。

数字表示碱基在水稻基因组中的物理位置;斜体碱基表示有差异的核酸变异;灰色碱基表示起始密码子上游515 bp处存在的特异单核苷酸变异。
Fig. 1. Sequence alignment of Gumei 4, sequencing varieties and other varieties(lines) carrying,,,,,.
2.2 T-Pigm标记对不同品种(系)及F2群体Pigm基因型的检测
利用T-标记对50份籼、粳稻品种(系)进行PCR扩增,从图2可以看出由正向外引物-O-F和反向外引物-O-R扩增起阳性对照作用的684 bp条带在每个品种(系)中都出现,这说明所有样品的DNA都能进行有效扩增。除该条带外,所有材料中只有谷梅4号能检测出一条295 bp的条带,它是由正向内引物T--I-F和反向外引物T--O-R扩增产生的,其特异扩增-基因起始密码子上游515 bp核苷酸为G的等位位点,为纯合的基因型;而其他49份包括含、、、、、基因的水稻材料,除684 bp的条带外,则只能扩增出一条444 bp的条带。它是由正向外引物T--O-F和反向内引物T--I-R扩增产生,其特异扩增核苷酸为C的等位位点,为纯合的基因型。为验证T-标记对杂合基因型的检测效果,对淮稻9号/谷梅4号F2群体300个单株的DNA进行扩增,其电泳产物出现三种类型的条带,其对应的基因型、、比例为1∶2∶1,符合1对基因的分离规律(χ2=4.08<χ20.05,2,0.10<<0.25)(图3)。

表1 检测水稻Pigm基因特异SNP变异的测序引物和相关标记
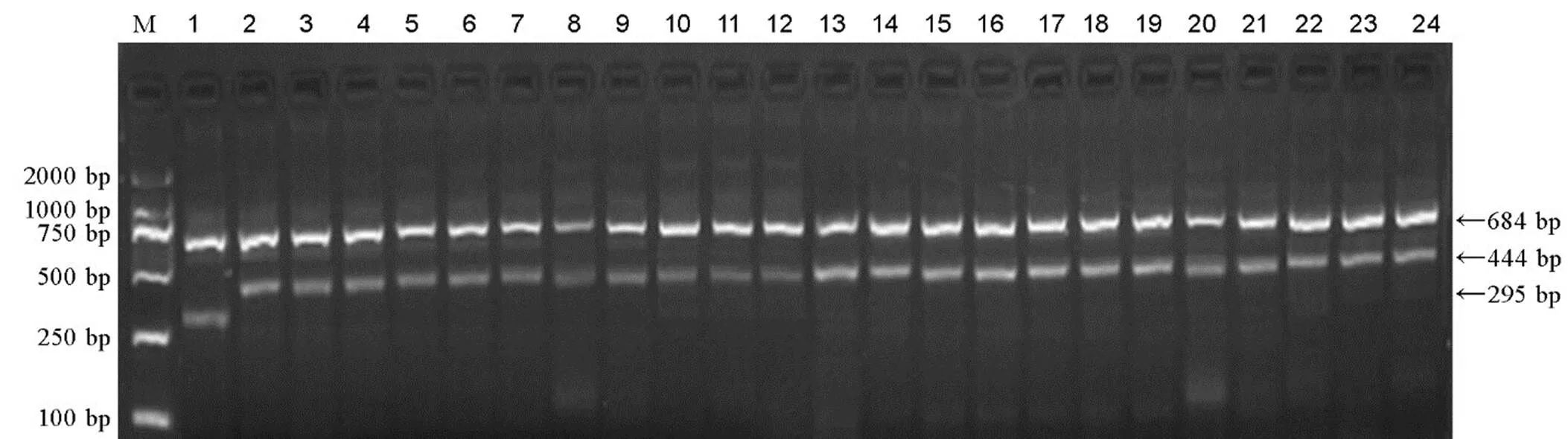
M-DNA分子量标准(DL2000);1-谷梅4号;2-IRBL9-W(Pi9);3-IRBLz5-CA-1(Pi2);4-IRBLz-Fu(Piz);5-IRBLzt-T(Piz-t);6-IR65482-4-13(Pi40);7-二八占(Pi50);8-24-部分籼、粳稻品种(系)依次为93-11、中恢8006、成恢727、红恢589、先恢527、明恢63、广恢998、川香29B、珍汕97B、培矮64S、日本晴、嘉58、淮稻9号、南粳9108、盐丰47、吉粳88、龙粳29。
Fig. 2. Electrophoresis detection ofgenotypes by T-marker in different rice varieties or lines.
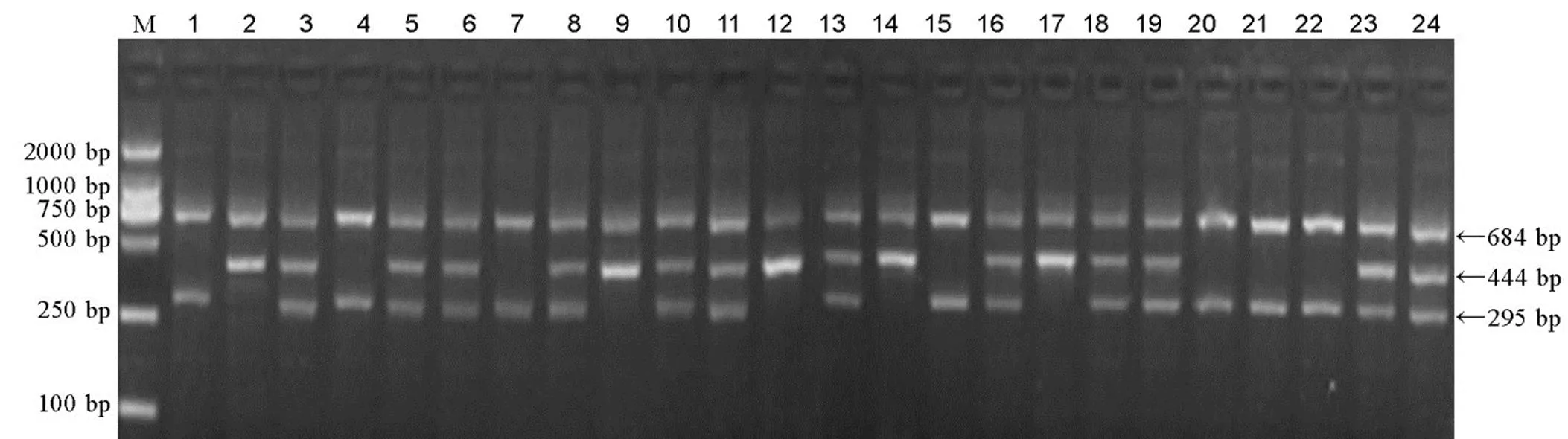
M-DNA分子量标准(DL2000);1-谷梅4号;2-淮稻9号;3-淮稻9号/谷梅4号 F1;4-24为部分F2分离单株。
Fig. 3. Electrophoresis detection ofgenotypes by Tmarker in F2population derived from Huaidao 9/Gumei 4.
2.3 K-Pigm标记对不同品种(系)及F2群体Pigm基因型的检测
为了进一步提高对大量分离群体单株的筛选效率,我们根据谷梅4号存在的特异单核苷酸变异,设计了相应的KASP标记,并利用实时荧光定量PCR仪对样品DNA进行分析。通过对50份籼、粳稻新品种(系)以及F2群体基因型的鉴定,发现该标记可以有效区分上述不同材料的基因型。在此基础上,与T-标记已鉴定的基因型进行比较,发现两种分子标记的检测结果完全一致(图4和图5)。
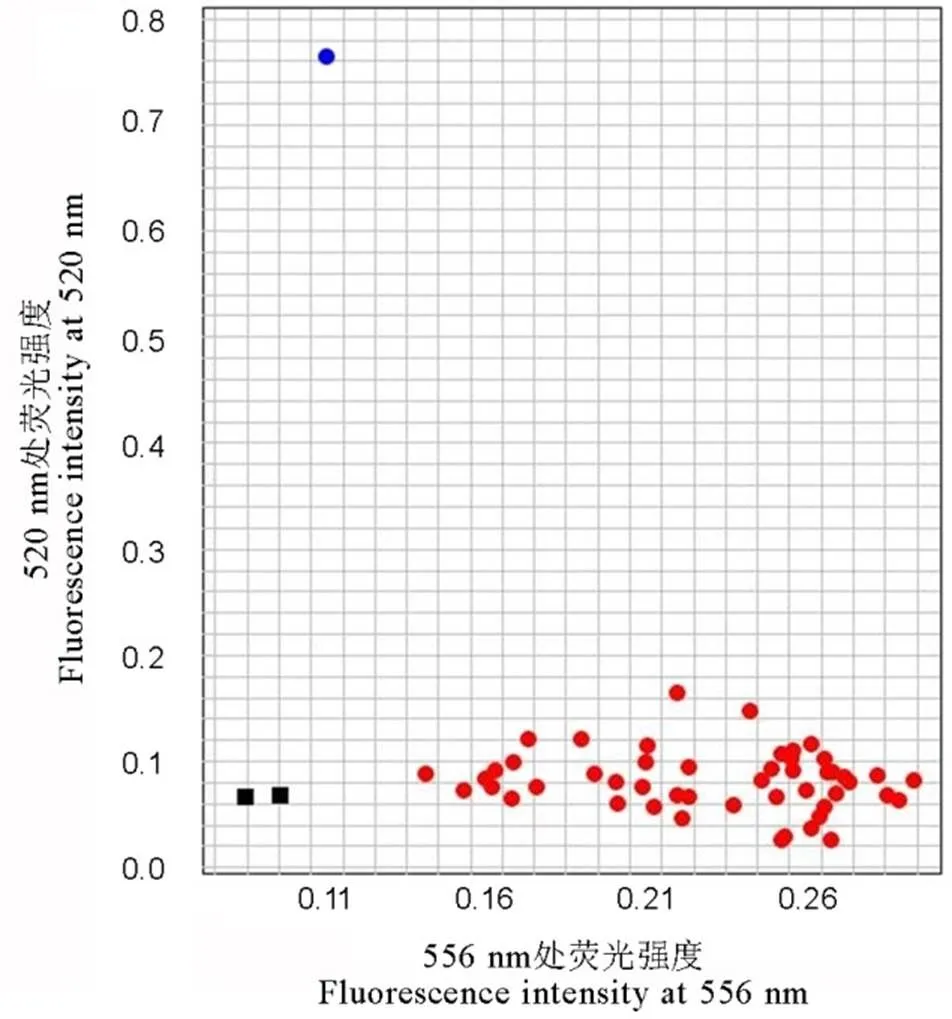
黑色方框代表无DNA模板的空白对照;蓝色和红色圆点分别代表纯合基因型(碱基G的等位变异)和纯合基因型(碱基C的等位变异)。
供试品种(系)分别为谷梅4号、IRBL9-W()、IRBLz5-CA-1 ()、IRBLz-Fu()、IRBLzt-T()、IR65482-4-13()、二八占()、镇恢084、93-11、中恢8006、成恢727、宜恢1577、红恢589、先恢527、明恢63、航1号、金恢2号、广恢998、宁香1B、川香29B、荃93-11B、珍汕97B、03S、Bph68S、P88S、培矮64S、日本晴、越光、一品、珍富10号、楚粳39、毕粳44、宝农34、浙粳97、嘉58、南粳505、南粳9108、淮稻9号、豫粳8号、临稻17、圣稻20、宁粳40号、伊粳12号、新稻32号、津粳263、沈农265、辽粳10号、盐丰47、吉粳88和龙粳29。
Black boxes indicate the negative controls with no DNA template; Blue and red dots showedhomozygous genotype (allelic variation G) andhomozygous genotype (allelic variation C), respectively.
The DNA of the tested varieties (lines) are Gumei 4, IRBL9-W(), IRBLz5-CA-1, IRBLz-Fu (), IRBLzt-T (), IR65482-4-13(), Erbazhan(), Zhenhui 084, 93-11, Zhonghui 8006, Chenghui 727, Yihui 1577, Honghui 589, Xianhui 527, Minghui 63, Hang 1, Jinghui 2, Guanghui 998, Ningxiang 1B, Chuanxiang 29B, Quan 93-11B, Zhenshan 97B, 03S, Bph68S, P88S, Peiai 64S, Nippobare, Koshihikari, Yipin, Zhenfu 10, Chujing 39, Bijing 44, Baonong 34, Zhejing 97, Jia 58, Nanjing 505, Nanjing 9108, Huaidao 9, Yujing 8, Lindao 17, Shengdao 20, Ningjing 40, Yijing 12, Xindao 32, Jinjing 263, Shennong 265, Liaojing10, Yanfeng 47, Jijing 88 and Longjing 29, respectively.
图4 K-标记对不同水稻品种(系)基因型的检测
Fig. 4. Detection of Pigm genotypes by K-marker in different rice varieties or lines.
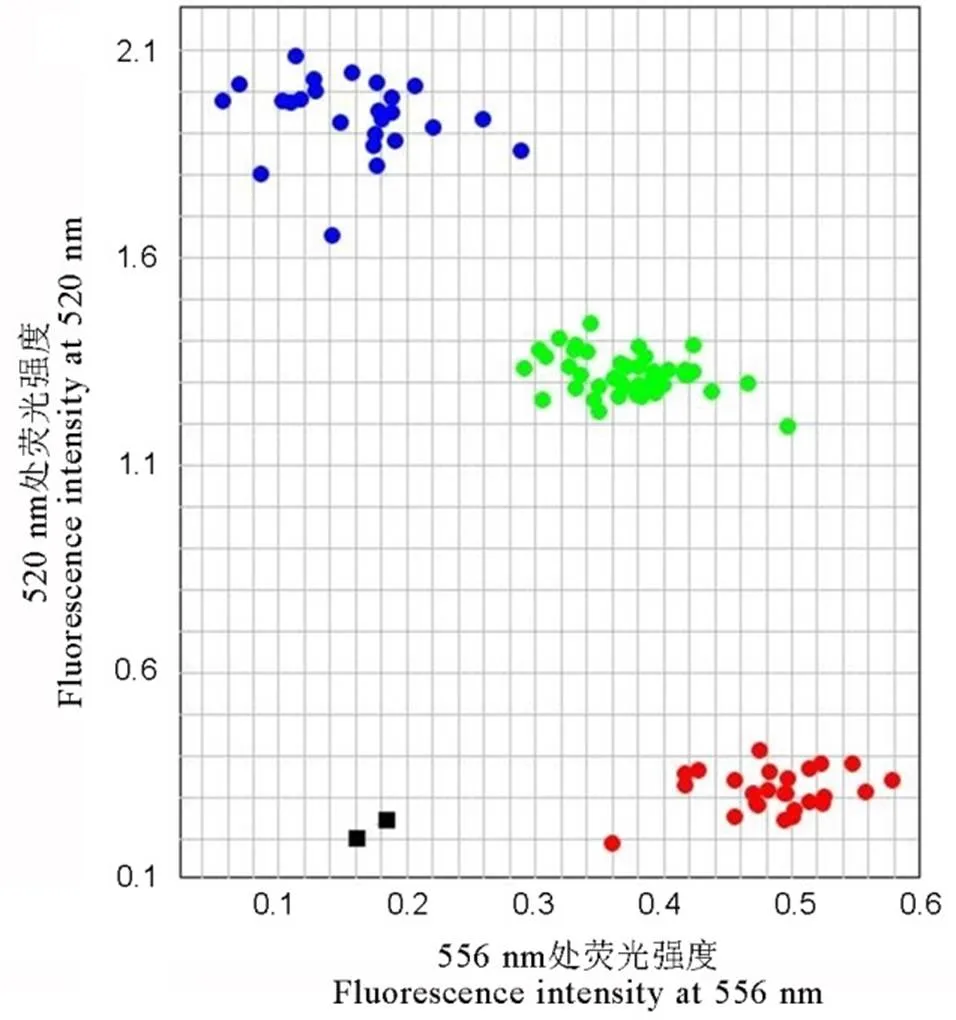
黑色方框代表无DNA模板的空白对照;蓝色、绿色和红色圆点分别代表PigmPigm纯合基因型(碱基G的等位变异), Pigmpigm杂合基因型(同时具有碱基G/C的等位变异)和pigm pigm纯合基因型(碱基C的等位变异)。
Fig. 5. Detection ofgenotypes by K-marker in F2population derived from Huaidao 9 and Gumei 4.
2.4 淮稻9号/谷梅4号F2群体不同Pigm基因型单株与穗颈瘟抗性的关系
为探究不同基因型与穗颈瘟抗性之间的关系,2017年采用人工接种的方法对感病品种淮稻9号、抗病品种谷梅4号、F1植株及F2群体的单株进行穗颈瘟抗性鉴定。淮稻9号、谷梅4号及其F1的穗损失率为82.65%、6.82%和7.65%,对应的病情等级分别为高感、抗、抗。通过对F2群体300个单株病情等级的统计,发现标记鉴定出的基因型为的228个单株全部表现为高抗、抗和中抗水平,而基因型为的72个单株中只有67个表现为中感、感和高感,而有5个单株则表现出抗和中抗(表2)。为排除由于接种不当造成的误判,继续收集上述5个单株的种子,2018年种成株系继续进行接种鉴定,每个株系连续接种5株,每株3穗,并统计病情等级,结果5个单株有4个表现为中感,1个表现为感。这说明开发出两个分子标记能准确地对基因型进行鉴定。
3 讨论
品种稻瘟病抗性弱、抗谱窄,抗性不持久,一直是江苏水稻特别是粳稻育种难以攻克的难题。已有研究表明,目前江苏常规粳稻中已利用的抗性基因主要有、、、、、、[18-19]。这些基因广泛分布在现有栽培粳稻品种中,易于杂交聚合育成抗病新品种。然而,长期使用上述基因,容易出现抗性减弱或丧失的问题,如广谱抗性基因的抗性近年来就有明显减弱的趋势[20]。因此,在抗稻瘟病育种中必须引入和利用新的广谱抗性基因。
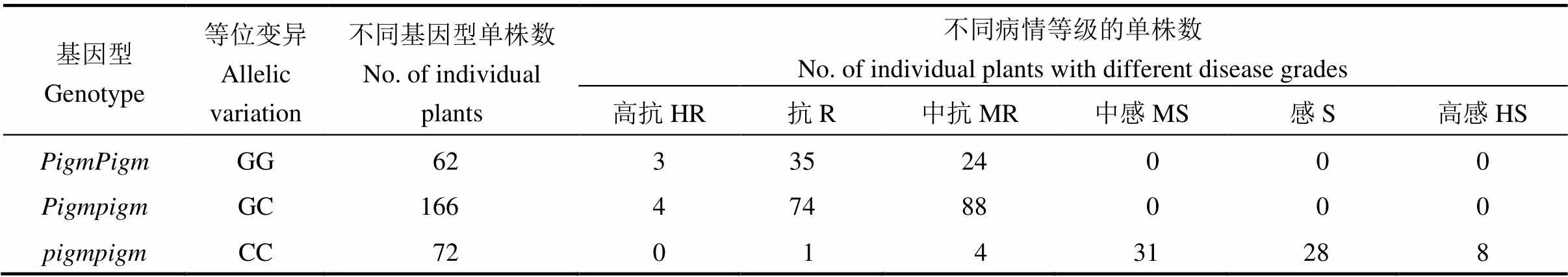
表2 淮稻9号/谷梅4号F2群体中三种Pigm基因型单株对穗颈瘟的抗性表现
、、、、是位于水稻第6染色体同一座位的复等位基因,它们虽然存在一定的抗谱差异,但对不同地区来源的绝大多数稻瘟病菌都具有良好的抗性。基因结构和功能解析证实这些基因是由不同数目的NBS-LRR元件串联排列而成。其中,、有9个NBS-LRR元件,起主要作用,其编码产物仅在3个LRRs区域有8个氨基酸的差异;有6个NBS-LRR元件,与抗性直接相关;有12个NBS-LRR元件,只有具有主要的抗性功能;而则含有13个NBS-LRR元件,且受与共同作用来维持水稻抗性与产量的平衡[21-23, 11]。这些同源抗病基因通过多个串联重复形成基因堆叠也是水稻抗病基因演化的一个重要途径[24]。已有研究表明,对不同粳稻地区的优势稻瘟病菌具有良好的抗性,特别是对强毒力的南方小种[13, 25-27]。不仅如此,该基因还可以与其他抗稻瘟病基因“兼容”,即使在不同亲本背景条件下,也能有效提升对稻瘟病的抗性等级[28-29]。这为进一步在粳稻中利用这一抗性基因,培育具有广谱、持久抗性的优良品种提供了理论依据。然而,从利用成效来看,目前并没有育成相关抗病粳稻品种在生产上推广。分析其主要原因可能是基因来源于特定的籼稻地方品种,抗源本身农艺性状不理想,与粳稻杂交亲和性差、后代分离大导致短时间内很难选育出兼具抗病、优质、丰产于一体的商业化品种。因此,在粳稻中对基因进行有效利用,尤其需要借助分子标记辅助选择这一高效、快捷、准确的技术手段。
随着基因研究的深入和标记技术的发展,为寻找基因内部或邻近区域差异序列从而开发实用性分子标记提供了可能。本研究通过对位点基因组序列的相关位点的测序以及比对分析,发现谷梅4号中-基因起始密码子上游515 bp处的一个碱基G与已测序的籼、粳稻品种以及其他复等位基因、、、、、材料不同,进而开发出Tetra-primer ARMS-PCR和KASP标记。至于谷梅4号如何在-上游区域形成这一特异的单核苷酸变异,还有待进一步研究。由于位点直接与抗病有关的基因是和,从严格意思上讲本研究中涉及的分子标记并不是根据这两个基因的差异序列开发的功能标记,其与、之间仍有45.6和79.1 kb的物理距离,但一般种植规模的遗传群体很难打破这种连锁而发生交换。因此,这些标记对基因型的鉴定具有非常高的准确性。
从实际应用效果来看,两种类型的分子标记各具优势。尽管KASP标记分型过程中需要使用荧光定量PCR仪或带荧光模块的酶标仪,对引物、技术、设备的要求相对较高,但节省了后续电泳检测的时间,在设施条件完备的科研机构适合对大量群体单株的检测;而Tetra-primer ARMS-PCR标记检测仅需简单的一步PCR扩增和琼脂糖电泳,具有操作简单、费用低廉等优点。因此,更符合基层育种单位的实际需求。
[1] 孙国昌. 关于水稻稻瘟病病原菌学名的正确使用[J]. 菌物学报, 1994, 13(2): 158-159.
Sun G C. Notes of the correct name of pathogen of rice blast fungus[J]., 1994, 13(2): 158-159. (in Chinese)
[2] Wilson R A, Talbot N J. Under pressure: Investigating the biology of plant infection by[J]., 2009, 7(3): 185-195.
[3] 陆明红, 刘万才, 朱凤, 张求东, 夏风. 2014年稻瘟病重发原因分析与治理对策探讨[J]. 中国植保导刊, 2015, 35(6): 35-39.
Lu M H, Liu W C, Zhu F, Zhang Q D, Xia F. Discussion and analysis of the solution and cause for rice blast outbroke in 2014[J]., 2015, 35(6): 35-39. (in Chinese)
[4] Sharma T R, Rai A K, Gupta S K, Vijayan J, Devanna B N, Ray S. Rice blast management through host-plant resistance: Retrospect and prospects[J]., 2012, 1(1): 37-52.
[5] 袁熹, 李大勇, 宋凤鸣. 水稻对稻瘟病的广谱抗性: 分子机制及其育种应用[J]. 植物生理学报, 2017, 53(8): 1348-1358.
Yuan X, Li D Y, Song F M. Rice broad-spectrum resistance against blast disease: Molecular mechanism and applications[J]., 2017, 53(8): 1348-1358. (in Chinese with English abstract)
[6] Deng Y W, Zhu X D, Shen Y, He Z H. Genetic characterization and fine mapping of the blast resistance locustightly linked toandin a broad-spectrum resistant Chinese variety[J]., 2006, 113(4): 705-713.
[7] Zhao H J, Wang X Y, Jia Y L, Minkenberg B, Wheatley M, Fan J B, Jia M H, Famoso A, Edwards J D, Wamishe Y S, Valent B, Wang G L, Yang Y N. The rice blast resistance geneencodes an atypical protein required for broad-spectrum disease resistance[J]., 2018, 9(1): 2039.
[8] Li W T, Zhu Z W, Chern M S, Yin J J, Yang C, Ran L, Cheng M P, He M, Wang K, Zhao W, Ma B T, Qin P, Chen W L, Wang Y P, Liu J L, Wang W M, Wu J J, Li P, Wang J R, Zhu L H, Li S G, Chen X W. A natural allele of a transcription factor in rice confers broad-spectrum blast resistance[J]., 2017, 170(1): 114-126.
[9] Fukuoka S, Saka N, Koga H, Ono K, Shimizu T, Ebana K, Hayashi N, Takahashi A, Hirochika H, Okuno K, Yano M. Loss of function of a proline-containing protein confers durable disease resistance in rice[J]., 2009, 325(5943): 998-1001.
[10] Wu Y Y, Chen Y, Pan C H, Xiao N, Yu N, Li Y H, Zhang X X, Pan X B, Chen X J, Liang C Z, Dai Z Y, Li A H. Development and evaluation of near-isogenic lines with different blast resistance alleles at thelocus inrice from the lower region of the Yangtze River, China[J]., 2017, 101(7): 1283-1291.
[11] Deng Y W, Zhai K R, Xie Z, Yang D Y, Zhu X D, Liu J Z, Wang X, Qin P, Yang Y Z, Zhang G M, Li Q, Zhang J F, Wu S Q, Milazzo J, Mao B Z, Wang E T, Xie H A, Tharreau D, He Z H. Epigenetic regulation of antagonistic receptors confers rice blast resistance with yield balance[J]., 2017, 355(6328): 962-965.
[12] 张礼霞, 王林友, 范宏环, 王建军. 利用基因改良粳稻保持系的稻瘟病抗性研究[J]. 核农学报, 2017, 31(3): 424-431
Zhang L X, Wang L Y, Fan H H, Wang J J. Study on improving rice blast resistance ofmaintainer line by introducinggene[J]., 2017, 31(3): 424-431. (in Chinese with English abstract)
[13] 曾生元, 李闯, 杜灿灿, 孙立亭, 景德道, 林添资, 余波, 钱华飞, 姚维成, 周义文, 龚红兵.特异性选择标记的开发及其在粳稻穗颈瘟抗性育种中的利用[J]. 中国水稻科学, 2018, 32(5): 453-461.
Zeng S Y, Li C, Du C C, Sun L T, Jing D D, Lin T Z, Yu B, Qian H F, Yao W C, Zhou Y W, Gong H B. Development of specific markers forin marker-assisted breeding of panicle blast resistantrice[J]., 2018, 32(5): 453-461. (In Chinese with English abstract)
[14] Ye S, Dhillon S, Ke X Y, Collins A R, Day I N M. An efficient procedure for genotyping single nucleotide polymorphisms[J]., 2001, 29(17): E88.
[15] He C L, Holme J, Anthony J. SNP genotyping: the KASP assay[J]., 2014, 1145: 75-86.
[16] Chen X, Temnykh S, Xu Y, Cho Y G, McCouch S R. Development of a microsatellite framework map providing genome-wide coverage in rice (L.) [J]., 1997, 95(4): 553-567.
[17] 中华人民共和国农业部. 水稻品种试验稻瘟病抗性鉴定与评价技术规程: NY/T 2646–2014[S]. 北京: 中国标准出版社, 2014.
Ministry of Agriculture and Rural Affairs of the People’s Republic of China. Technical specification for identification and evaluation of blast resistance in rice variety region test: NY/T 2646–2014[S]. Beijing: Standards Press of China, 2014. (in Chinese)
[18] 刘辉, 孟德龙, 查日扬, 徐大勇. 江苏水稻品种主效抗性基因鉴定及应用评价[J]. 福建农业学报, 2015, 30(5): 452-458.
Liu H, Meng D L, Zha R Y, Xu D Y. Identification and evaluation on blast resistance of rice varieties in Jiangsu[J]., 2015, 30(5): 452-458. (in Chinese with English abstract)
[19] 王军, 宫丹妮, 杨杰, 朱金燕, 范方军, 李文奇, 王芳权, 仲维功. 江苏省粳稻品种抗稻瘟病基因型与穗颈瘟抗性分析[J]. 江苏农业学报, 2016, 32(2): 250-256.
Wang J, Gong D N, Yang J, Zhu J Y, Fan F J, Li W Q, Wang F Q, Zhong W G. Relationship between rice blast resistance genotypes and neck blast resistance ofrice in Jiangsu Province[J]., 2016, 32(2): 250-256. (in Chinese with English abstract)
[20] 宋兆强, 刘艳, 王宝祥, 王芳权, 迟铭, 刘金波, 陈庭木, 方兆伟, 邢运高, 徐波, 杨波, 杨杰, 徐大勇. 稻瘟病抗性基因、、、的育种应用价值评价[J]. 江苏农业学报, 2017, 33(5): 968-974.
Song Z Q, Liu Y, Wang B X, Wang F Q, Chi M, Liu J B, Chen T M, Fang Z W, Xing Y G, Xu B, Yang B, Yang J, Xu D Y. Application value of blast resistant genes,andin rice breeding[J]., 2017, 33(5): 968-974. (In Chinese with English abstract)
[21] Zhou B, Qu S H, Liu G F, Dolan M, Sakai H, Lu G D, Bellizzi M, Wang G L. The eight amino-acid differences within three leucine-rich repeats betweenandresistance proteins determine the resistance specificity to[J]., 2006, 19(11): 1216-1228.
[22] Qu S H, Liu G F, Zhou B, Bellizzi M, Zeng L R, Dai L Y, Han B, Wang G L. The broad-spectrum blast resistance geneencodes a nucleotide-binding site-leucine-rich repeat protein and is a member of multigene family in rice[J]., 2006, 172(3): 1901-1904.
[23] Su J, Wang W J, Han J L, Chen S, Wang C Y, Zeng L X, Feng A Q, Yang J Y, Zhou B, Zhu X Y. Functional divergence of duplicated genes results in a novel blast resistance geneat thelocus[J]., 2015, 128(11): 2213-2225.
[24] 郭长江. 抗稻瘟病基因快速演化位点的遗传分析和人工进化研究[D]. 南京: 南京大学, 2017.
Guo C J. Genetic analysis and artificial evolution of rapidly evolving rice blast resistance genes[D]. Nanjing: Nanjing University, 2017. (in Chinese with English abstract)
[25] 田红刚, 陈红旗, 胡江, 雷财林, 朱旭东, 钱前. 抗稻瘟病基因导入对寒地粳稻抗病性和产量性状的影响[J]. 沈阳农业大学学报, 2016, 47(5): 520-526.
Tian H G, Chen H Q, Hu J, Lei C L, Zhu X D, Qian Q. Effect of introgressedgene on rice blast and yield traits ofrice in cold area[J]., 2016, 47(5): 520-526. (in Chinese with English abstract)
[26] 王飞, 王立广, 潘梅瑶, 钮中一, 周勇, 梁国华. 水稻抗稻瘟病(t)基因的分子标记辅助选择和利用[J]. 华北农学报, 2016, 31(1): 51-56.
Wang F, Wang L G, Pan M Y, Niu Z Y, Zhou Y, Liang G H. Marker-assisted selection and application of blast resistant gene(t)in rice[J]., 2016, 31(1): 51-56. (in Chinese with English abstract)
[27] 吕学莲, 白海波, 惠建, 蔡正云, 张龙飞, 李树华. 利用广谱抗病基因改良水稻稻瘟病抗性[J]. 分子植物育种, 2017, 15(11): 4336-4342.
Lv X L, Bai H B, Hui J, Cai Z Y, Zhang L F, Li S H. The improvement of rice blast resistance by broad-spectrum gene[J]., 2017, 15(11): 4336-4342. (in Chinese with English abstract)
[28] 于苗苗, 戴正元, 潘存红, 陈夕军, 余玲, 张晓祥, 李育红, 肖宁, 龚红兵, 盛生兰, 潘学彪, 张洪熙, 李爱宏. 广谱稻瘟病抗性基因和的抗谱差异及与的互作效应[J]. 作物学报, 2013, 39(11): 1927-1934.
Yu M M, Dai Z Y, Pan C H, Chen X J, Yu L, Zhang X X, Li Y H, Xiao N, Gong H B, Sheng S L, Pan X B, Zhang H X, Li A H. Resistance spectrum difference between two broad-spectrum blast resistance genes,and, and their interaction effect on[J]., 2013, 39(11): 1927-1934. (in Chinese with English abstract)
[29] Wu Y Y, Xiao N, Yu L, Pan C H, Li Y H, Zhang X X, Liu G Q, Dai Z Y, Pan X B, Li A H. Combination patterns of major R genes determine the level of resistance to thein rice[J]., 2015, 10(6): e0126130.
Development and Verification of Specific Molecular Markers forGeneAssociated with Broad-spectrum Resistance to Rice Blast
CHEN Tao1, 2, SUN Xuchao1, ZHANG Shanlei1, LIANG Wenhua1, ZHOU Lihui1, ZHAO Qingyong1, YAO Shu1, ZHAO Ling1, ZHAO Chunfang1, ZHU Zhen1, ZHANG Yadong1, WANG Cailin1,*
(1Institute of Food Crops, Jiangsu Academy of Agricultural Sciences, Jiangsu High Quality Rice R&D Center / Nanjing Branch of China National Center for Rice Improvement, Nanjing 210014, China;2Jiangsu Co-Innovation Center for Modern Production Technology of Grain Crops, Yangzhou University, Yangzhou 225009, China;∗Corresponding author, E-mail: clwang@jaas.ac.cn)
【Objective】from anrice variety Gumei 4, is one of the most important genes with broad-spectrum and durable resistance to rice blast. It is very necessary to improve its selection efficiency by developing specific and co-dominant markers in breeding. 【Method】The molecular markersT-and K-were developing with Tetra-primer ARMS-PCR and KASP technique, based on the specific nucleotide mutation inlocus. Then, the consistency of the genotype and phenotype was evaluated in different varieties and the F2population derived from Huaidao 9/ Gumei 4 by artificial inoculation methods of panicle blast.【Result】The sequence alignment analysis indicated that a specific SNP was at -515 bp of thegene initiation codon in Gumei 4. The three different genotypes oflocus could be distinguished by the Tetra-primer ARMS-PCR and KASP markers, which exactly conformed to the results of artificial inoculation.【Conclusion】 T-and K-markers could be used to detect the genotype ofgene rapidly and accurately, and improved the selection efficiency of blast resistant rice varieties in breeding.
rice blast;; specific marker; tetra-primer ARMS-PCR; competitive allele-specific PCR
S435.111.4+1; S511.034
A
1001-7216(2020)01-0028-09
10.16819/j.1001-7216.2020.9082
2019-07-12;
2019-11-20。
国家重点研发计划重点专项(2017YFD0100305);江苏省重点研发计划资助项目(BE2018357);江苏省农业重大新品种创制项目(PZCZ201703);现代农业产业技术体系建设专项资金资助项目(CARS-01-62);江苏省农业科学院粮食作物研究所科研基金资助项目(LZS17-7)。

