水稻蜡质稀少突变体wax1的鉴定及基因定位
潘孝武 黎用朝 刘文强 熊海波 董铮 薛丹 盛新年 赵文锦 魏秀彩 李小湘
水稻蜡质稀少突变体的鉴定及基因定位
潘孝武 黎用朝 刘文强 熊海波 董铮 薛丹 盛新年 赵文锦 魏秀彩 李小湘*
(湖南省农业科学院 水稻研究所/农业部长江中下游籼稻遗传育种重点实验室,长沙 410125;*通信联系人,E-mail: xiaoxiang66196@126.com)
【目的】蜡质是植物表面的一种重要保护物质,筛选和鉴定水稻蜡质相关突变体有助于解析水稻蜡质形成的遗传机制。【方法】利用EMS诱变籼稻品种湘早籼6号,从突变体库中筛选出一个蜡质稀少的突变体,考查突变体的形态特征和农艺性状,利用突变体与02428杂交的F2群体定位目标基因,并通过荧光定量PCR分析相关基因的表达情况。【结果】与野生型相比,突变体具有叶片短小皱褶、叶表面蜡质晶体减少、穗长变短等形态特征;在农艺性状方面,突变体的株高、每穗总粒数和千粒重显著降低,但有效穗数显著高于野生型;遗传分析表明,的突变表型受一对隐性核基因控制,将基因定位在第10染色体上SSR标记RM5806与InDel标记P1之间,物理距离约为49.8 kb;定位区间内的测序结果表明,突变体中β-酮脂酰-CoA合酶的编码基因发生单碱基突变,导致催化活性中心的一个氨基酸发生改变。基因的突变显著提高了同源异型盒基因的表达,同时引起部分IAA基因的差异表达。【结论】基因突变引起叶表面蜡质晶体的减少,同时通过影响茎尖分生组织和生长素的信号转导引起植株生长发育等多方面的异常。
水稻;蜡质;基因定位;生长素
植物表面覆盖有角质层,由表皮细胞分泌而来,是植物与空气接触的一层疏水性屏障。它在降低植物非气孔水分散失,保护植物抵御干旱、紫外辐射以及病虫害等不良环境中起到重要作用[1,2]。角质层由角质和蜡质组成,而蜡质又可分为内外两层,内表皮蜡质通常填充在角质层致密的网状结构内,而外表皮蜡质堆积在最外层并且自我组装成各种形态的蜡质晶体[3]。蜡质是由一些碳链长度在18以上的超长链脂肪酸(very long chain fatty acids, VLCFAs)及其衍生物组成的有机混合物[4]。
蜡质合成主要包括三个步骤:第一步在表皮细胞的细胞质内从头合成C16/C18饱和脂肪酸,第二步在内质网中由脂肪酸延长酶(fatty acid elongase,FAE)复合体催化C16/C18脂肪酸延长合成不同链长的超长链脂肪酸,最后超长链脂肪酸通过脱碳基途径和酰基还原途径转换成初级醇、烷烃、初级醛、酮类以及次级醛等蜡质组分[3,5]。脂肪酸延伸复合体(FAE)是由β-酮脂酰-CoA合酶(3-ketoacyl-CoA synthase, KCS)、β-酮脂酰-CoA还原酶(3-ketoacyl-CoA reductase, KCR)、β-羟脂酰-CoA脱水酶(3-hydroxacyl-CoA dehydratase, HCD)和反式烯脂酰-CoA还原酶(trans-2, 3-enoyl-CoA reductase, ECR)组成的多酶体系[6]。其中催化第一步缩合反应的被认为是延伸反应的限速酶,并且具有严格的碳链长度特异性[7]。水稻基因组中共有34个同源基因,通过蜡质相关突变体的研究,目前已克隆了[8,9]、[10]、[11]、[12,13]等多个基因,这些基因突变都引起超长链脂肪酸含量下降,进而导致叶表面的蜡质晶体数量减少。此外,超长链脂肪酸含量的下降还影响茎尖分生组织的功能及生长素等信号途径[8,14,15],因此这些突变体还表现出器官融合、形态结构异常等其他表型[16],其中和突变体在种子萌发后不久就停止生长。与基因的突变表型相类似,水稻基因突变体的叶色变浅,表皮蜡质减少且分布不均匀[17]。水稻基因编码拟南芥HOTHEAD的同源蛋白,参与长链脂肪酸(long chain fatty acids, LCFAs)的合成,基因突变后也引起超长链脂肪酸含量下降,植株极端矮小,不能发育到生殖阶段[18,19]。水稻基因参与超长链脂肪酸转换成蜡质组分的过程,基因的突变体或干扰植株同样表现出蜡质含量减少,且对干旱的敏感性增强[5,20]。另外,酰基转移酶编码基因受osa-miR1848调控,也参与超长链脂肪酸和蜡质的生物合成[21]。综上,虽然多个蜡质合成相关基因被克隆,但水稻中的蜡质合成途径仍不完全清楚。
本实验室利用化学诱变水稻品种湘早籼6号,获得了一个蜡质减少的突变体。本研究对突变体开展了形态学观察、遗传分析、基因定位和相关基因的表达分析,为进一步阐明水稻蜡质合成的分子机制奠定基础。
1 材料与方法
1.1 试验材料
籼稻湘早籼6号的种子经0.5%的甲基磺酸乙酯(Ethylmethylsulfone,EMS)处理,2014年种植于长沙试验田。种子成熟后每个M1单株收一单穗;2014–2015年种植M2株系于海南三亚基地,每个株系种植20株,观察各株系的形态性状并收种。其中一个株系表现出矮秆、叶片皱褶等明显形态异常,该株系经2015–2018年连续自交已稳定遗传,命名为。利用突变体与野生型湘早籼6号正反交,观察F1的表型,并统计F2群体的分离比例,通过卡方检验进行遗传分析;利用突变体与广亲和粳稻品种02428杂交构建F2群体,用于基因定位。
1.2 农艺性状调查
于成熟期考查野生型和突变体的产量等农艺性状,3次重复,每次重复取5株考种。考查性状包括株高、有效穗数、每穗总粒数、结实率和千粒重。利用DPS 14.10分析野生型和突变体之间的差异显著性。
1.3 叶片表面的超微结构观察
取分蘖期水稻的倒1叶,使用直径为0.8 cm的打孔器在叶片中央取圆片,迅速放入2.5%(/)的戊二醛溶液中固定,24 h后使用去离子水润洗样品3次,每次10 min;将样品放入1%(/)的锇酸溶液中继续固定,2 h后使用0.1 mol/L磷酸缓冲液清洗3次,每次20 min;依次用梯度浓度的乙醇溶液对样品脱水,每次15 min;丙酮置换两次,每次15 min;在临界点干燥仪(Quorum K850)中干燥后真空喷镀;将样品(叶片正面)放在扫描电镜(HITACHI Regulus 8100)下观察、拍照。
1.4 基因定位和候选基因预测
基因定位主要根据株高和叶片扭曲情况判断野生型和突变型。以突变体与02428杂交的F2群体为定位群体,采用混合群体分离分析法(Bulked Segregant Analysis,BSA)进行基因的初步定位。采用SDS法提取亲本及群体各单株的DNA。从F2群体中各取10株野生型单株和10株突变型单株,各单株取等量DNA混合构建两个混池;利用亲本间的多态性引物扩增两个基因池,筛选与目标基因连锁的SSR标记,并利用少量突变型单株在连锁标记附近进行初定位;根据初定位结果,以日本晴和93-11的基因组为参考,比对目标区间内的籼粳基因组序列,找出序列差异后利用DNAMAN 6.0设计InDel标记引物,在目标区间继续筛选和加密分子标记。利用新的分子标记,对所有突变型单株进行基因型分析,根据各标记的重组个体数量进行精细定位。PCR总体积10 μL,含2×PCR预混试剂5 μL、正反向引物各1 μL(5 μmol/L),DNA模板1 μL,去离子水2 μL。PCR程序如下:94℃下预变性5 min;94℃下变性30 s、55℃下退火30 s、72℃下延伸30 s,35个循环;72℃下延伸5 min。根据基因的功能注释信息,在精细定位区间进行候选基因预测,并比较野生型和突变体的序列差异。
1.5 基因表达检测
采用Yoshida营养液培养水稻至3叶1心,使用RNA提取试剂盒(Omega,USA)抽提叶片的总RNA,通过琼脂糖凝胶电泳和微量分光光度计(NanoDrop 2000,Thermo)检测RNA的浓度和完整性。RNA经检测合格后,使用反转录试剂盒(HiScript®II Q RT SuperMix,南京诺唯赞)获得cDNA;基因表达检测:cDNA模板稀释5倍后用于荧光定量PCR分析。使用SYBR qPCR Master Mix(Vazyme)作为荧光染料,反应体系为20 μL,在荧光定量PCR仪上进行(IQ5,Bio-Rad,USA)。PCR条件如下:95℃下预变性1 min;95℃下变性10 s,60℃下退火和延伸30 s,40个循环。引物设计所用软件为DNAMAN 6.0,引物序列见表1。以肌动蛋白基因作为内参基因,基因表达的相对量采用2–法计算。样本间的差异显著性分析采用Student-检验。

表1 基因定位及表达分析引物信息
2 结果与分析
2.1 wax1突变体的表型分析
形态学观察发现突变体除了植株变矮以外,还具有多个异常表型。与野生型相比,突变体的叶片变短变窄、叶表面皱褶、穗长变短且局部扭曲(图1)。另外,叶片的亲水特性在野生型和突变体之间也存在明显差异,野生型叶片在沾水后形成水珠,而突变体叶片上的水珠则逐渐分散到叶片表面。农艺性状调查结果表明(表2),突变体的结实率与野生型没有显著差异,但株高、每穗总粒数和千粒重都极显著降低;相反,突变体的有效穗数极显著高于野生型。扫描电镜(SEM)观察显示,野生型叶片表明覆盖有一层致密的蜡质晶体,突变体的乳突数量与野生型相比没有明显差异(图2-A, B),但蜡质晶体的数目明显减少,特别是乳突上的晶体更加稀疏(图2-C, D),这可能是叶片发育异常的主要原因。
2.2 突变体的遗传分析及基因定位

A,B—野生型和突变体的植株形态;C—野生型和突变体的穗型;D—野生型和突变体的叶片形态;E—野生型和突变体叶片沾水后的浸润特性。
Fig. 1. Morphological traits of the wild type(WT) and its mutant
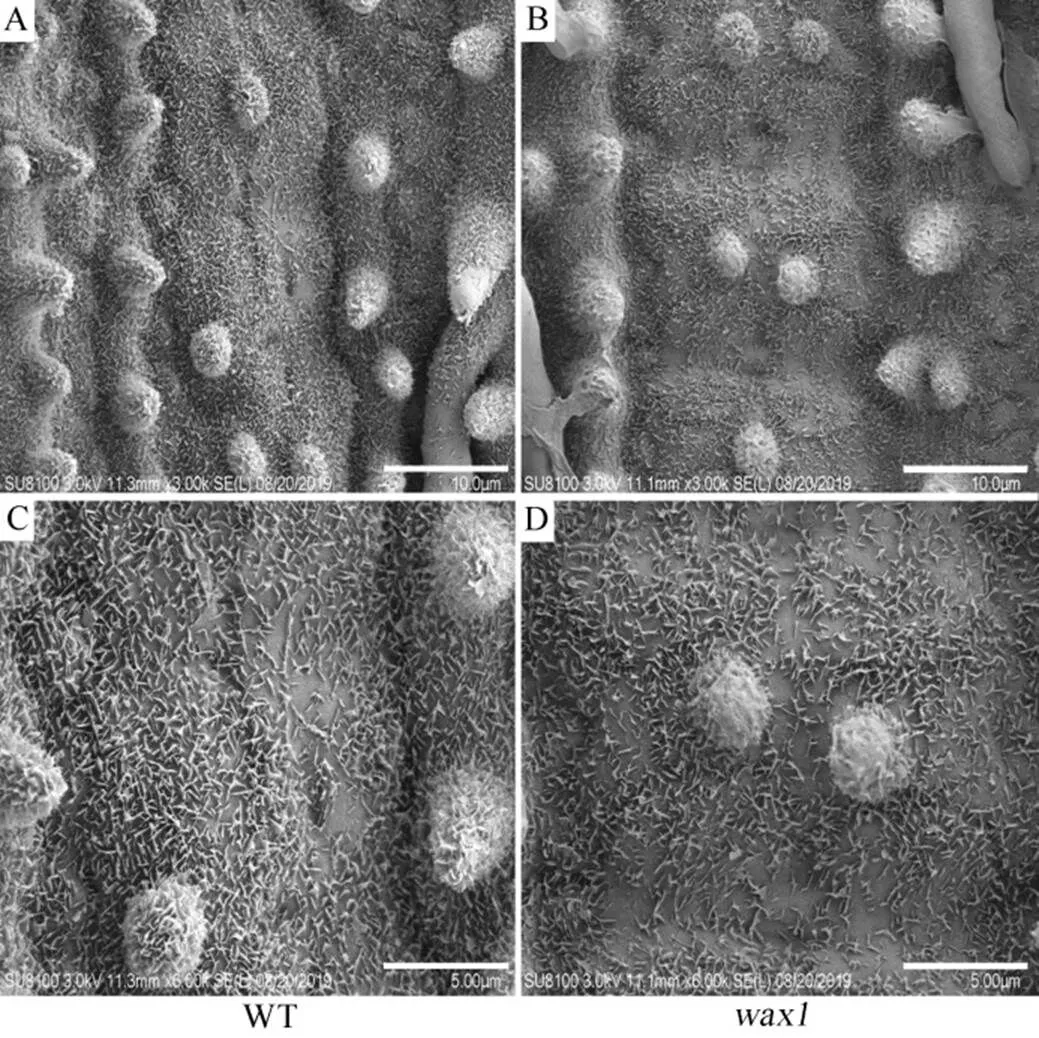
图2 野生型和突变体叶片的扫描电镜图
Fig. 2. Leaf scanning electron microscopic map of wild type and mutant.
根据株高和叶片扭曲情况作为突变表型的判断依据,突变体与野生型正反交的杂种F1均表现正常,湘早籼6号的F2群体中正常株755株,突变型单株235株,分离比例经卡方检验符合3∶1(χ2=0.84 < χ2 0.05=3.84);在湘早籼6号/的F2群体中,正常株732株,突变型单株218株,卡方检验正常株与突变型株的分离比例同样符合3∶1(χ2=2.13 < χ2 0.05=3.84),表明该突变表型受一对隐性核基因控制。
将突变体与广亲和粳稻品种02428杂交,利用F2群体进行基因定位。在F2群体中分别选取10株正常株和10株突变型单株构建DNA混池,使用亲本间的168对多态性引物扩增两个DNA混池,发现第10染色体上的SSR引物RM271在两个混池之间有明显多态。随后在RM271附近加密分子标记,利用106个突变型F2单株,将目标基因定位在SSR标记RM5806和InDel标记ID09139之间。进一步扩大突变型单株数量至809个,根据日本晴和93-11的基因组序列差异开发新的InDel标记,最终将目标基因定位在RM5806与InDel标记P1之间,物理距离约为49.8 kb(图3)。参考日本晴的基因组序列,发现该区间内共有4个开放阅读框(open reading frame, ORF)。其中, ORF1、ORF2和ORF3(Os10g0416100,Os10g0416500和Os10g0416800)均编码几丁质酶,ORF4(Os10g0416200)编码β-酮脂酰-CoA合酶,是VLCFAs合成途径中的关键限速酶。测序结果表明,ORF1-ORF3在野生型和突变体之间没有序列差异,但突变体在ORF4编码区的第863位碱基由T突变成A,导致编码蛋白的第288位氨基酸由缬氨酸(Val)突变为天冬氨酸(Asp)。蛋白结构域分析发现,ORF4共有两个外显子,编码一个由523个氨基酸组成的蛋白质,该蛋白第96–514位氨基酸为β-酮脂酰-CoA合酶的催化活性中心,该区域非常保守。因此,预测ORF4为候选基因。
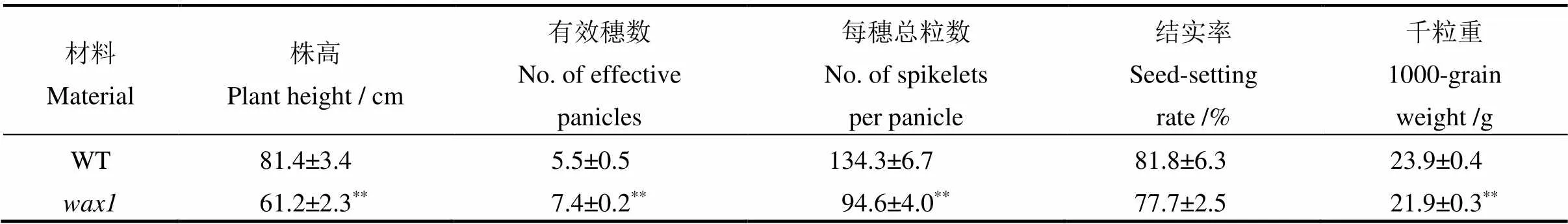
表2 野生型与突变体wax1的主要农艺性状比较
**表示突变体与野生型之间的差异达0.01显著水平。
**Difference between the mutant and WT was significant at 0.01 level.

图3 水稻WAX1基因的精细定位及突变位点
Fig. 3. Fine mapping and the mutantion site of the ricegene.
2.3 水稻生长发育相关基因的表达分析
前人研究已经证明,KCS基因突变会影响茎尖分生组织(SAM)的功能及生长素信号途径[8,14]。同源异型盒(KNOTTED1-like homeobox, KNOX)基因在SAM中特异表达,受生长素的负调控[22],其表达水平在维持SAM功能和植物正常发育过程中起到关键作用。
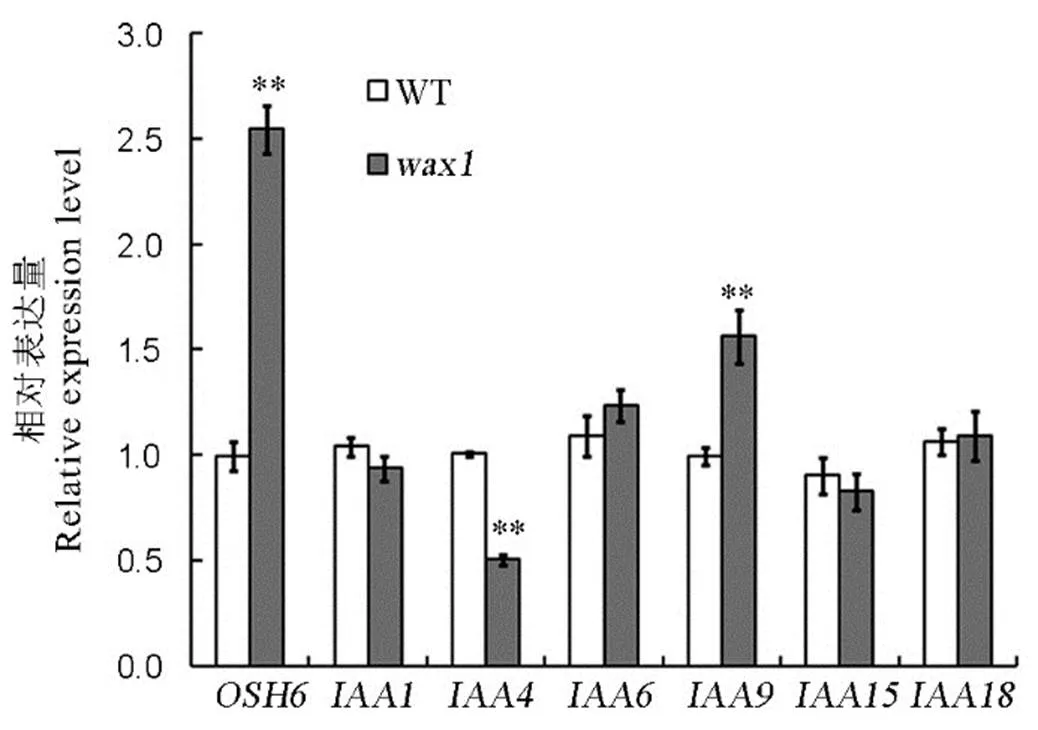
**表示突变体与野生型之间的差异达0.01显著水平。
Fig. 4. Relative expression level ofandgenes.
鉴于突变体表现出多方面的形态异常,我们进一步分析基因和生长素相关基因在突变体中的表达情况。如图4所示,基因的表达水平在突变体中极显著上升,约为野生型的2.5倍。生长素信号转导基因的表达趋势并不一致,其中在突变体中显著下调表达,而在突变体中的表达水平则高于野生型,其他IAA基因包括,,和的表达在野生型和突变体之间差异不显著。
3 讨论
本研究鉴定了一个水稻蜡质减少的突变体,叶片沾水后表现出浸润特性,扫描电镜观察发现突变体表皮的蜡质晶体明显减少。我们通过图位克隆方法定位并预测了候选基因,该基因编码β-酮脂酰-CoA合酶,与基因[10]等位,但突变体的表型特点与差别较大。突变体的叶片之间相互融合,表面观察不到正常的乳突形态,且种子萌发后不久就停止生长;突变体叶表面的蜡质晶体虽然减少,但乳突形态清晰可见,植株能发育到生殖生长阶段并正常结实。这些表型差异可能与基因的突变位置有关,Ghanevati等[23]发现,拟南芥FAE1/KCS18的第222位半胱氨酸,第389位组氨酸和第422位的天冬酰胺非常保守,这些特定氨基酸的突变会显著降低KCS的催化活性;Wang等[12]发现WSL4蛋白第228位的丝氨酸在与OsCER2的互作过程中起重要作用,基因的不同等位突变体和具有不同的蜡质组分,说明不同突变位点的功能有差异。突变体在第2外显子内有一个16 bp的缺失,而本研究中突变体仅有一个核苷酸的突变,推测该突变可能并未使蛋白失活,而只是降低了酶的活性或影响了与其他蛋白的互作。与突变体的表型特点类似,叶片表面的蜡质晶体减少,植株能开花结实,T-DNA插入位点位于基因的5′-UTR区域,可能影响蛋白的翻译水平[11]。但是的结实率显著降低,而突变体的结实率与野生型没有显著差异,推测这可能与不同KCS蛋白的底物特异性和组织特异性有关。
VLCFAs主要在表皮细胞中合成,然后分泌到胞外形成角质层。植物的表皮细胞除承担保护功能外,还参与调控SAM的功能和组织器官发育[24,25]。本研究中的突变体除蜡质减少以外,还表现出株高变矮、叶片窄小皱褶、穗长变短等多种形态异常,可能是因为突变引起的SAM功能受损引起的。前人研究表明,组织器官的发生与SAM中基因的下调和生长素的积累有密切关系[26]。基因是一类维持分生组织功能的重要基因,主要在未分化的细胞中表达,在分化出的其他组织器官中表达水平较低[27]。基因突变会导致分生组织缺失的表型[28,29],但过量表达也会引起叶片形态异常等表型。本研究发现,基因在突变体中显著上调表达,一部分生长素诱导表达基因IAA在野生型和突变体间差异表达,表达趋势与[8,9]、[10]突变体中相关基因的基本一致。我们根据这些研究结果推测,基因突变可能引起VLCFAs的合成受阻,一方面减少表面蜡质晶体的形成,另一方面通过影响SAM和生长素的信号转导引起植株形态异常。
[1] Lee S B, Suh M C. Advances in the understanding of cuticular waxes inand crop species[J]., 2015, 34(4): 557-572.
[2] Yeats T H, Rose J K C. The formation and function of plant cuticles[J]., 2013, 163(1): 5-20.
[3] 陈伟, 刘德春, 杨莉, 刘山蓓, 刘勇. 植物表皮蜡质及相关基因研究进展[J]. 植物生理学报, 2016, 52 (8): 1117-1127.
Chen W, Liu D C, Yang L, Liu S B, Liu Y. Advances in studies on plant epidermal wax and related genes[J]., 2016, 52(8): 1117-1127. (in Chinese with English abstract).
[4] 杨贤鹏, 王宙雅, 高翔, 李荣俊, 吕世友. 植物表皮蜡质生物合成及调控[J]. 中国生物工程杂志, 2016, 36(9): 75-80.
Yang X P, Wang Z Y, Gao X, Li R J, Lü S Y. Biosynthesis and regulation of wax in plant epidermis[J]., 2016, 36(9): 75-80. (in Chinese with English abstract).
[5] Zhou L, Ni E, Yang J, Zhou H, Liang H, Li J, Jiang D, Wang Z, Liu Z, Zhuang C. Riceis involved in leaf cuticular wax accumulation and drought resistance[J]., 2013, 8(5): e65139.
[6] 倪郁, 郭彦军. 植物超长链脂肪酸及角质层蜡质生物合成相关酶基因研究现状[J]. 遗传, 2008, 30(5): 561-567.
Ni Y, Guo Y J. Progress in the study on genes encoding enzymes involved in bio-synthesis of very long chain fatty acids and cuticular wax in plants[J]., 2008, 30(5): 561-567. (in Chinese with English abstract).
[7] Millar A, Kunst L. Very-long-chain fatty acid biosynthesis is controlled through the expression and specificity of the condensing enzyme[J]., 2010, 12(1): 121-131.
[8] Tomoaki T, Yukihiro I. Altered expression of auxin-related genes in the fatty acid elongase mutantof rice[J]., 2011, 6(6): 887-888.
[9] Yukihiro I, Fumiko K, Kazuma H, Katsutoshi T, Tomoaki T, Mitsugu E, Kiyotaka N, Nori K. Fatty acid elongase is required for shoot development in rice[J]., 2011, 66: 680-688.
[10] Tsuda K, Akiba T, Kimura F, Ishibashi M, Moriya C, Nakagawa K, Kurata N, Ito Y. ONION2 fatty acid elongase is required for shoot development in rice[J]., 2013, 54(2): 209-217.
[11] Yu D, Ranathunge K, Huang H, Pei Z, Franke R, Schreiber L, He C.encodes a-ketoacyl CoA synthase involved in biosynthesis of cuticular waxes on rice leaf[J]., 2008, 228(4): 675-685.
[12] Wang X, Guan Y, Zhang D, Dong X, Tian L, Qu L Q. A-ketoacyl-CoA synthase is involved in rice leaf cuticular wax synthesis and requires a CER2-LIKE protein as a cofactor[J]., 2016, 173(2): 944-955.
[13] Gan L, Zhu S, Zhao Z, Liu L, Wang X, Zhang Z, Zhang X, Wang J, Wang J, Guo X., encoding a-ketoacyl-coenzyme A synthase 6, is involved in rice cuticular wax accumulation[J]., 2017, 36(10): 1655-1666.
[14] Tsuda K, Ito Y, Yamaki S, Miyao A, Hirochika H, Kurata N. Isolation and mapping of three rice mutants that showed ectopic expression ofgenes in leaves[J]., 2009, 177(2): 131-135.
[15] Yamauchi T, Shiono K, Nagano M, Fukazawa A, Ando M, Takamure I, Mori H, Nishizawa N K, Kawaiyamada M, Tsutsumi N. Ethylene biosynthesis is promoted by very-long-chain fatty acids during lysigenous aerenchyma formation in rice roots[J]., 2015, 169(1): 180-193.
[16] Nobusawa T, Okushima Y, Nagata N, Kojima M, Sakakibara H, Umeda M. Synthesis of very-long-chain fatty acids in the epidermis controls plant organ growth by restricting cell proliferation[J]., 2013, 11(4): e1001531.
[17] Lu G, Wang X, Cheng Z, Liu L, Wang J, Zhe Z, Ren Y, Lei C, Zhao Z, Zhu S.encoding a-ketoacyl-CoA reductase is involved in cuticular wax biosynthesis in rice[J]., 2016, 35(8): 1687-1698.
[18] Fang Y, Hu J, Xu J, Yu H, Shi Z, Xiong G, Zhu L, Zeng D, Zhang G, Gao Z. Identification and characterization of, a gene regulating rice shoot development[J]., 2015, 57(2): 151-161.
[19] Akiba T, Hibara K, Kimura F, Tsuda K, Shibata K, Ishibashi M, Moriya C, Nakagawa K, Kurata N, Itoh J. Organ fusion and defective shoot development inmutants of rice[J]., 2014, 55(1): 42-51.
[20] Mao B, Cheng Z, Lei C, Xu F, Gao S, Ren Y, Wang J, Zhang X, Wang J, Wu F., a rice homologue of, is involved in synthesis of leaf cuticular wax[J]., 2012, 235(1): 39-52.
[21] Xia K, Ou X, Gao C, Tang H, Jia Y, Deng R, Xu X, Zhang M.involved in cuticular wax biosynthesis is regulated by[J]., 2015, 38(12): 2662-2673.
[22] Tabata R, Ikezaki M, Fujibe T, Aida M, Tian C, Ueno Y, Yamamoto K T, Machida Y, Nakamura K, Ishiguro S.AUXIN RESPONSE FACTOR6 and 8 regulate jasmonic acid biosynthesis and floral organ development via repression of class 1genes[J]., 2010, 51(1): 164-175.
[23] Mahin G, Jaworski J G. Engineering and mechanistic studies of theFAE1 beta-ketoacyl-CoA synthase, FAE1 KCS[J]., 2010, 269(14): 3531-3539.
[24] Takada S, Iida H. Specification of epidermal cell fate in plant shoots[J]., 2014, 5: 49.
[25] Knauer S, Holt a L, Rubiosomoza I, Tucker E J, Hinze A, Pisch M, Javelle M, Timmermans M C P, Tucker M R, Laux T. A protodermal miR394 signal defines a region of stem cell competence in theshoot meristem[J]., 2013, 24(2): 125-132.
[26] Rast M I, Simon R.acts withto coordinateandexpression in shoot and root meristems[J]., 2012, 24(7): 2917-2933.
[27] Ito Y, Eiguchi M, Kurata N.homeobox genes are sufficient in maintaining cultured cells in an undifferentiated state in rice[J]., 2001, 30(4): 231-238.
[28] Tsuda K, Ito Y, Sato Y, Kurata N. Positive autoregulation of agene is essential for shoot apical meristem maintenance in rice[J]., 2011, 23(12): 4368-4381.
[29] Kerstetter R A, Laudenciachingcuanco D, Smith L G, Hake S. Loss-of-function mutations in the maize homeobox gene,, are defective in shoot meristem maintenance[J]., 1997, 124(16): 3045-3054.
Identification and Genetic Analysis of Waxy Sparse Mutantin Rice
PAN Xiaowu, LI Yongchao, LIU Wenqiang, XIONG Haibo, DONG Zheng, XUE Dan, SHENG Xinnian, ZHAO Wenjin, WEI Xiucai, LI Xiaoxiang*
(Hunan Rice Research Institute, Hunan Academy of Agricultural Sciences; Key Laboratory of indica Rice Genetics and Breeding in the Middle and Lower Reaches of Yangtze River Valley, Ministry of Agriculture, Changsha 410125;*Corresponding author, E-mail: xiaoxiang66196@126.com)
【Objective】Wax is an important protective substance on plant surface.Screening and identification of waxy-related mutants help elucidate the genetic mechanism of waxy synthesis in rice. 【Method】A waxy sparse mutant,, was isolated from an ethylmethylsulfone (EMS) mutagenic population of Xiangzaoxian 6. The morphological characteristics and agronomic traits ofmutant were analyzed. The F2segregating population was constructed from a cross betweenandvariety 02428, and the recessive individuals were selected for fine mapping ofgene. In addition, the expressions of related genes were analyzed by quantitative PCR. 【Results】Compared with the wild type,mutant showed many morphological abnormalities, including small wrinkled leaves, shorter panicle and reduced waxy crystals on leaf surface. Themutant was also featured by increased effective panicle number, and obviously decreased plant height, 1000-grain weight and number of grains per panicle. Genetic analysis implied that the mutant phenotype was controlled by a pair of recessive nuclear gene. Thegene was fine-mapped to a 49.8 kb interval between markers RM5806 and P1 on the chromosome 10. A total of 4 ORFs (open reading frames) were found in this region. Sequencing analysis indicated that a single base transition was present in the coding region of 3-ketoacyl-CoA synthase, which resulted in an amino acid substitution. In addition, mutation ofincreased the expression ofgene, and caused differential expressions of some IAA genes. 【Conclusion】Thegene mutation resulted in the decrease of waxy crystals on leaf surface and abnormalities in plant growth and development through affecting shoot apex meristem and auxin signal transduction.
rice; waxy; gene mapping; auxin
Q755; S511.01 献标识码:A
1001-7216(2020)01-0001-07
10.16819/j.1001-7216.2019. 9101
2019-09-16;
2019-10-27。
国家现代农业产业技术体系建设专项(CARS-01-14);国家自然科学基金资助项目(31801335);湖南省重点研发计划资助项目(2017NK2020);湖南创新型省份建设专项(2019RS2047)。

