猪主动脉瓣内皮细胞的分离与鉴定
既往钙化性主动脉瓣疾病(CAVD)被认为是不可逆的被动的退行性病变。但越来越多的临床研究发现,CAVD是包括内皮损伤、慢性炎性反应、细胞外基质重构、细胞表型分化及细胞凋亡等多个复杂病理变化的过程,为主动过程[1-4]。内皮损伤可能是CAVD的起始因素[5],随后瓣膜间质细胞(VIC)在多种因素刺激下向成骨细胞样细胞主动转化,最终导致瓣膜中钙盐沉积[6]。有学者认为瓣膜内皮细胞(VEC)参与CAVD的主要机制为VEC通过内皮-间质转换机制(EndMT)转化成为具有增殖能力的VIC[7-8],另有学者认为VEC主要通过旁分泌机制影响VIC的形态学特征或功能[9-10]。目前对于VEC在CAVD发展过程中的始动作用机制尚未明确。体外分离和培养VEC是深入研究VEC在CAVD病理生理中改变的细胞学基础,本文探讨猪主动脉瓣VEC的分离和培养方法。
1 材料与方法
1.1 实验动物和试剂
2~3月龄雄性家猪由上海五丰上食公司提供。高糖DMEM培养基、青霉素/链霉素、胎牛血清(FBS)均购自美国Gibco公司;Ⅱ型胶原酶粉剂购自美国Sigma公司;CD31抗体购自于美国abcam公司(ab28364),波形蛋白(Vimentin)荧光直标抗体购自于美国Santa Cruz公司(sc6260),α-平滑肌肌动蛋白(α-SMA)抗体购自于美国Affinity公司(AF1032),荧光二抗Alexa Fluor 488购自于美国EarthOx公司(E032211-01);内皮细胞培养基(ECM)购自于美国ScienCell公司。
Ⅱ型胶原酶溶液使用DMEM培养基配制,Ⅱ型胶原酶终浓度为2 mg/mL,青霉素/链霉素终浓度为1%。内皮细胞培养使用DMEM完全培养基,青霉素/链霉素终浓度为1%。
1.2 主动脉瓣内皮细胞的分离和培养
于屠宰场处死家猪后立即切除其主动脉瓣,放置在消毒的无纺布上,佩戴无菌手套和口罩,用高温灭菌的器械取出瓣膜,放置于预冷的PBS中,于1 h内送至实验室。使用无菌PBS反复清洗猪主动脉瓣,共3次,每次3 min。将瓣膜置于培养皿中,加入6 mL预热的Ⅱ型胶原酶溶液并放入37 ℃培养箱中孵育5~10 min。轻轻移除内皮层,用干燥的无菌棉签刮擦瓣膜表面,使内皮细胞从组织中分离出来。所施加的力量为能感受到组织的阻力,但未穿透基底膜。在Ⅱ型胶原酶溶液中涂抹棉签,使内皮细胞中从棉签中分离出来。收集细胞悬液,以1 500 转/min离心5 min,去除上清液。用DMEM培养基重悬细胞,将细胞移入培养皿中,37 ℃、5%CO2培养箱中培养2~3 d,而后改用ECM培养细胞。
1.3 免疫荧光染色法检测猪主动脉瓣内皮细胞(PAVEC)
将细胞接种到12孔板,待细胞贴壁后培养细胞至融合度达30%~50%。75%乙醇室温固定细胞15 min,PBS洗3次后,1%Triton-100室温破膜10 min,5%BSA室温封闭30 min。加入1∶200一抗(抗CD31抗体、抗Vimentin抗体、抗α-SMA抗体)4 ℃孵育过夜,1∶400 Alexa Fluor 488标记的羊抗兔IgG二抗37 ℃避光孵育30 min,4,6-联脒-2-苯基吲哚(DAPI)复染细胞核,荧光显微镜下观察并拍照。
1.4 流式细胞仪检测分离细胞CD31和Vimentin的表达
胰酶消化12孔板中的细胞,离心去除上清,1% Triton-100室温破膜10 min,5% BSA封闭30 min。1∶200一抗(抗CD31抗体、抗Vimentin抗体)4 ℃孵育过夜,Alexa Fluor 488标记的羊抗兔IgG二抗37 ℃避光孵育30 min,流式细胞仪检测分离细胞的CD31和Vimentin表达情况。
2 结果
2.1 VEC形态
从新鲜猪主动脉瓣膜分离获取的VEC约8 h贴壁,分离后第2天VEC增殖速度显著增快,第3天时VEC汇集成单层,互相接触抑制,细胞形态呈铺路石样。
2.2 VEC表型鉴定
通过免疫荧光染色法对细胞进行表型鉴定,结果显示VEC的CD31染色为阳性,α-SMA和Vimentin染色为阴性,VIC的Vimentin和α-SMA染色为阳性,CD31染色为阴性(见图1),分离培养的VEC为PAVEC,且VIC污染率低。通过流式细胞仪进一步对细胞进行鉴定,结果显示VEC的Vimentin阳性率为3.06%,CD31阳性为99.01%,为CD31+Vimentin-细胞,VIC的Vimentin阳性率为97.76%,CD31阳性率为0.99%,为CD31-Vimentin+细胞(见图2)。主动脉瓣由VEC和VIC构成,VEC主要表达CD31和血管性血友病因子(vWF),VIC主要表达Vimentin和α-SMA,而分离获取的细胞以CD31+Vimentin-细胞为主,因此可以认为通过胶原酶消化法获取的VEC没有VIC污染,再次验证胶原酶消化法分离获得的VEC纯度较高。
3 讨论
VEC起源于胚胎发育时期的中胚层,其覆盖于瓣膜的外表面,与VIC及细胞外基质共同构成瓣膜。VEC直接接触血流,因此血流动力学及炎性改变均能直接作用于VEC[12]。从某种意义上说,VEC可以作为一个探测器,感受外界的变化,然后通过调节基底膜的渗透性、炎性细胞黏附能力转导外界的信号变化,维持瓣膜内环境的稳定[13]。越来越多的研究证明,VEC在CAVD的发生过程中可能起着始动作用。
在本研究中,我们通过胶原酶消化法,将瓣膜表面的VEC分离出,在DMEM培养基中培养2~3 d后,再改用内皮培养基培养细胞。该方法有助于细胞的状态恢复和分裂,但整体来说细胞产量较低。值得注意的是,内皮细胞接触抑制可导致细胞转化,因此细胞传代时机的选择非常重要。分离出的细胞呈典型的内皮细胞形态,单层生长,呈铺路石样。通过免疫荧光染色法检测细胞CD31、Vimentin和α-SMA等表型,显示VEC为CD31表达阳性,Vimentin和α-SMA表达阴性细胞,符合内皮细胞的表型特点。进一步通过流式细胞仪对获取的细胞进行表型鉴定,VEC为CD31+Vimentin-细胞,同时显示该分离方法获得的VEC纯度较高,受间质细胞污染率低。
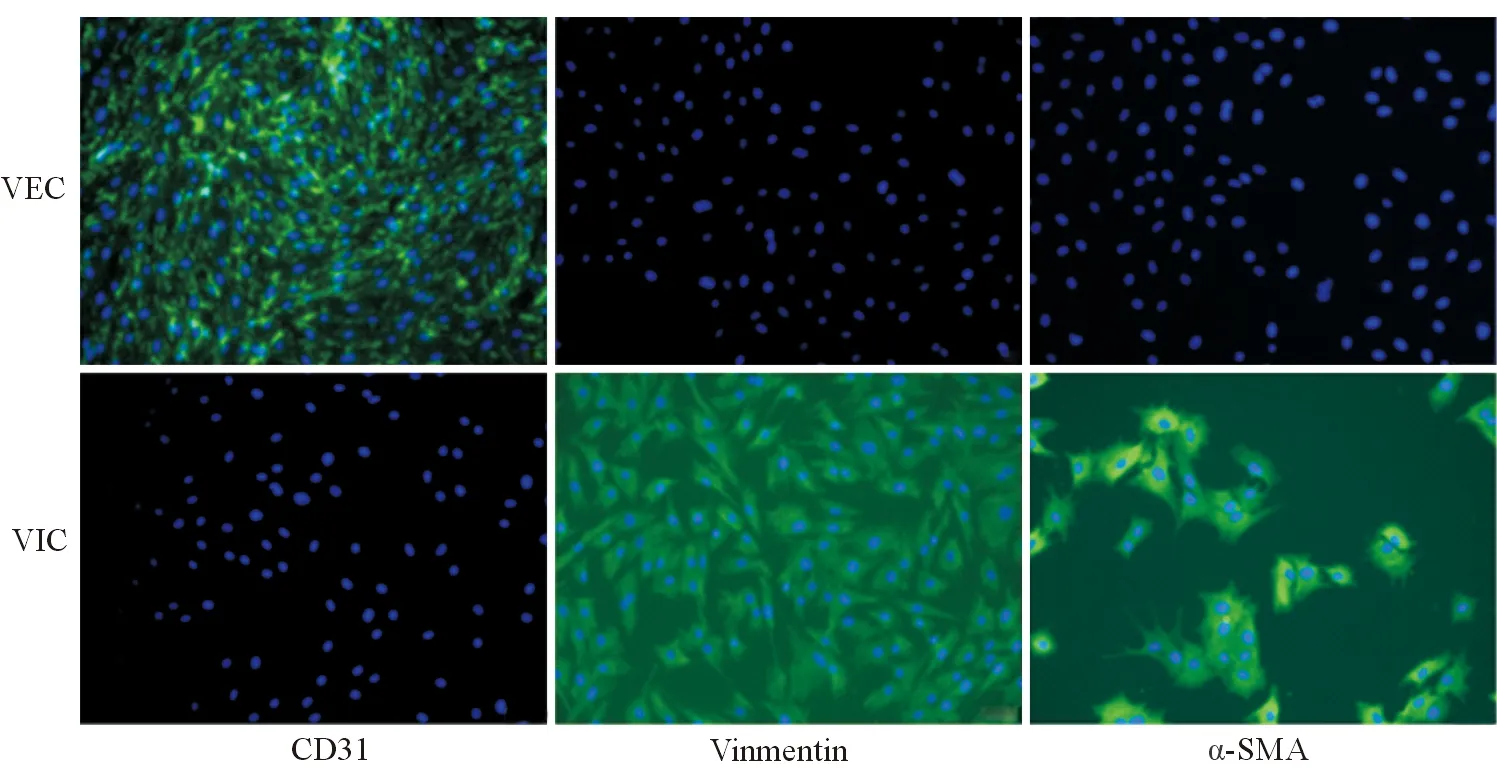
注:VEC呈现CD31染色阳性,Vimentin和α-SMA染色阴性;VIC呈现Vimentin和α-SMA染色阳性,CD31染色阴性
图1 免疫荧光染色法鉴定VEC细胞表型

注:VEC Vimentin阳性率为3.06%,CD31阳性率为99.01%;VIC Vimentin阳性率为97.76%,CD31阳性率为0.99%
图2 流式细胞仪鉴定VEC细胞表型
VEC在CAVD发生过程中的始动作用机制可能为:(1)血流动力学改变对VEC的影响。有研究表明,在紊乱的血流剪切力作用下,与促钙化、炎性反应相关的基因,包括骨形成蛋白-4(BMP-4)、转化生长因子-β1(TGF-β1)、细胞间黏附分子-1(ICAM-1)、血管细胞黏附分子-1(VCAM-1)等的表达升高[14]。(2)VEC通过EndMT成为具有增殖能力的VIC。Paruchufi等[15]研究发现,成年人瓣膜中存在同时表达CD31、α-SMA的细胞,即发生EndMT的细胞。Dal-Bianco等[16]通过构建机械损伤羊瓣膜模型,发现处理组中内皮细胞发生EndMT的细胞数量明显高于对照组。(3)VEC旁分泌机制发生变化,影响 VIC 的形态学和功能。VEC主要通过旁分泌一氧化氮(NO)和C型利尿钠肽(CNP)对VIC进行调控[17-18]。然而,目前关于VEC在CAVD进程中的具体作用机制尚未达成共识。
综上所述,本研究探讨了通过胶原酶从猪主动脉瓣分离获取VEC的方法,该方法实施方便,分离得到的VEC纯度良好,有助于体外研究VEC在CAVD中的作用及机制。

