冠状动脉夹层后腔内旋磨术治疗扭曲钙化病变1例
1 病例简介
患者男性,69岁,因“反复胸闷1年,加重伴胸痛2 d”入院。入院1年前患者在劳累后反复出现胸闷不适,每次持续3~5 min,休息后可缓解,无心悸、气促等伴随症状,未行特殊处理。入院2 d前,患者胸闷症状加重,持续时间延长,约0.5 h,伴心前区压榨性疼痛,放射至背部,伴心悸、出汗,当地医院心电图示Ⅱ、Ⅲ、aVF导联ST段弓背抬高,药物保守治疗后至我院。入院检查:血压126/76 mmHg,心率70次/min,心律齐,未闻及早搏,心脏各瓣膜听诊区未闻及病理性杂音。胸片示双肺未见实质性病变。心电图示窦性心律,Ⅱ、Ⅲ、aVF导联病理性Q波,胸导联T波低平、倒置。腹部超声示肝、胆、脾、双肾未见异常。超声心动图示左房增大(前后径37 mm),三尖瓣局限性反流,左室舒张功能减退,射血分数(EF)56%。实验室检查:肌酸激酶同工酶11.30 ng/mL,肌钙蛋白Ⅰ3.16 ng/mL,三酰甘油(TG)1.22 mmol/L,总胆固醇(TC)7.3 mmol/L,低密度脂蛋白胆固醇(LDL-C)4.94 mmol/L,高密度脂蛋白胆固醇(HDL-C)1.77 mmol/L。血常规、肝肾功能、凝血功能、大小便常规未见异常。心肌梗死溶栓试验(TIMI)危险评分5分,急性冠脉综合征患者出血危险CRUSADE评分17分。入院后给予阿司匹林100 mg/d,替格瑞洛90 mg每日2次,阿托伐他汀40 mg/d,低分子肝素钠皮下注射4 000 U每日2次。
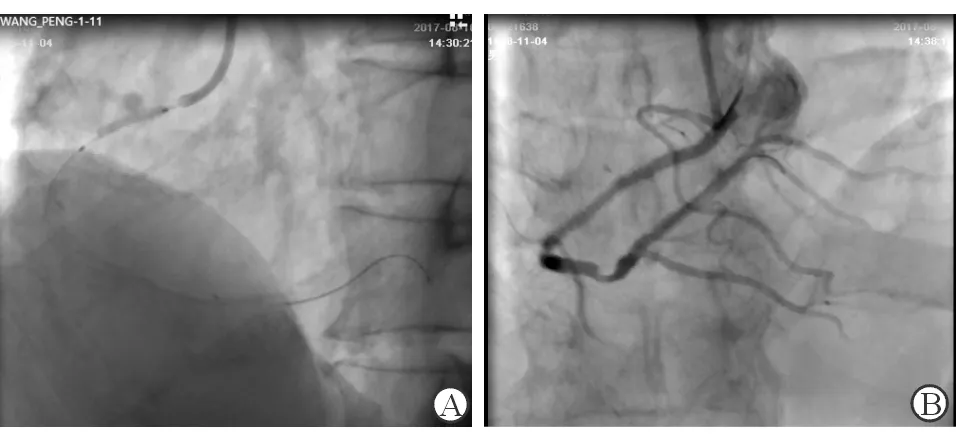
因患者入院时错过急诊经皮冠状动脉介入术(PCI)治疗时间窗,血流动力学稳定,故住院1周后行冠状动脉造影(桡动脉路径),示左主干末端至前降支近段弥漫性粥样硬化伴钙化(见图1A),狭窄约70%,前降支中段严重钙化扭曲呈螺旋状狭窄,狭窄约95%,病变长约50 mm,前向血流TIMI 2级;回旋支中段呈弥漫性粥样硬化病变(图1A),狭窄约50%,前向血流TIMI 3级;右冠状动脉近中段次全闭塞病变,狭窄约95%,长度约22 mm,远段狭窄约70%,前向血流TIMI 2级(见图1B)。SYNTAX评分41分。

注:A为左冠状动脉造影图像,示左主干末端至前降支近段弥漫性粥样硬化伴钙化,回旋支中段呈弥漫性粥样硬化;B为右冠状动脉造影图像,示近中段次全闭塞
图1 患者冠状动脉造影检查结果
建议患者首选外科冠状动脉旁路移植术(CABG),患者及家属拒绝,故行PCI治疗。首先处理罪犯血管右冠状动脉:置入6F JR3.5指引导管,BMW导丝,导丝顺利通过狭窄段并送达远端,2.5×20 mm球囊以10 atm充分预扩张8 s(见图2A),将2.75×24 mm药物涂层支架球囊覆盖近中段狭窄病变,以3.0×12 mm后扩球囊高压扩张支架扩张近段,前向血流恢复至TIMI 3级(见图2B),远端狭窄病变无需处理。
注:A示球囊扩张;B示术后血流TIMI 3级
第二步处理前降支钙化病变,置入6F XB3.5指引导管,BMW导丝,导丝顺利通过狭窄病变,血管内超声(IVUS)示导管无法通过严重钙化段,长度约2~3 mm,先送入1.2×12 mm球囊以20 atm扩张10 s,再送入2.5×15 mm球囊以16 atm扩张10 s,血管狭窄程度未见改善,送入2.5×6 mm切割球囊同样无法通过狭窄段。送入2.75×12 mm后扩球囊以16 atm扩张6 s,血管仍未见扩张(见图3A),且导致严重螺旋状夹层形成,前向血流TIMI 1级,导管内反复推注硝普钠后血流恢复至TIMI 3级(见图3B)。
与患者家属沟通后决定行冠状动脉内旋磨术(RA),沿BMW导丝送入微导管交换旋磨导丝,使用1.25 mm旋磨头,配置250 mL生理盐水+硝酸甘油5 mg+肝素钠6 250 U旋磨液,以17万转/min旋磨,旋磨过程中严密观察转速,避免转速急速下降,每次持续20 s,间歇30~60 s,旋磨2次后旋磨头顺利通过严重钙化病变(见图3C),避开前后夹层开口处进行旋磨修饰,避免夹层撕裂及撕裂的内膜片脱落导致慢血流或无复流。复查冠状动脉造影示钙化病变较前明显减轻,残余狭窄约30%,夹层未见扩大,前向血流TIMI 3级(见图3D)。再次送入2.5×6 mm切割球囊,在前降支钙化病变处以12 atm扩张切割10 s(见图3E),共3次,造影示狭窄处扩张充分。送入2.75×28 mm药物涂层支架在病变处以12 atm释放,送入3.5×28 mm支架在左主干-前降支近段以12 atm 释放,两支架前后衔接。冠状动脉造影示狭窄病变消失,对角支无明显挤压,前向血流TIMI 3级(见图3F)。术后IVUS示钙化病变扩张充分,支架贴壁良好(见图3G)。
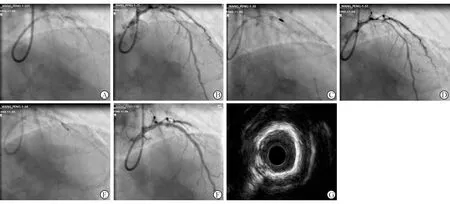
注:A示后扩球囊扩张不充分;B示冠状动脉内夹层形成;C示冠状动脉内旋磨;D示旋磨后血管钙化减轻;E示再次切割球囊扩张;F示支架置入后造影;G示术后血管内超声检查
图3 PCI处理前降支钙化病变
PCI后予阿司匹林100 mg/d,替格瑞洛90 mg每日2次,阿托伐他汀40 mg/d,硝酸异山梨醇酯5 mg每日3次,曲美他嗪20 mg每日2次治疗。患者无胸闷、胸痛、气促等不适症状。术后半年复查心电图示窦性心律,Ⅱ、Ⅲ、aVF导联病理性Q波,胸导联T波低平、倒置。超声心动图示左房稍增大,三尖瓣局限性反流,左室舒张功能减退,射血分数58%。
2 讨论
本例患者冠状动脉造影提示前降支扭曲钙化并成角狭窄,PCI术中无法通过IVUS导管进行检查及评估,球囊无法充分扩张病变,且导致严重夹层出现。后经过RA联合切割球囊扩张处理,最后成功置入支架,术后患者恢复良好。
随着人口老龄化和糖尿病患者的增加,冠状动脉狭窄伴钙化病变的发生率显著增加,但仅凭冠状动脉造影难以区分钙化病变为内膜或外膜钙化[1],内膜严重钙化病变可导致球囊无法通过、无法扩张或扩张不完全,IVUS或冠状动脉内光学相干断层成像(OCT)检查探头无法通过时会导致评估不准确,增加了PCI的难度和风险,严重影响患者的长期预后[2]。
严重冠状动脉内膜钙化病变首选RA处理。2017年中国RA专家共识里明确提出冠状动脉钙化合并严重螺旋夹层为RA禁忌证[3],但临床上因多种原因,无法预先准确评估冠状动脉钙化病变程度,导致在使用球囊扩张钙化狭窄病变时,会出现病变未能充分扩张及夹层。下一步治疗是选择外科搭桥,还是RA,各介入中心有不同方案,具体处理需根据冠状动脉血管病变及患者、家属意愿进行。
RA是处理冠状动脉严重钙化病变的重要手段,可有效消蚀钙化斑块,为PCI的成功提供有利条件。钙化严重的病变可直接采用RA技术,以降低手术风险,若由于旋磨操作技术、旋磨安全性、病变评估准确性等因素未首先采用RA,而反复预扩张球囊,会导致钙化病变扩张不成功进而形成夹层,引起冠状动脉破裂等严重后果。在部分研究中心夹层形成、常规PCI无法继续的钙化病变中,根据实际情况进行RA处理亦可保证PCI顺利完成[4-5]。
本例可行性分析:(1)夹层长度约10 mm,继续撕裂的可能性大,CABG难度增加;(2)严重钙化病变短,约2~3 mm,旋磨时间短,通过性良好;(3)夹层近心端破口距离钙化处有一定距离(约20 mm),术中可控制旋磨头,避免在夹层近心端破口处旋磨,降低旋磨致夹层扩大的风险;(4)术中遵循小磨头、慢通过原则[6],选择1.25 mm旋磨头,减少微栓塞、内膜撕裂、急性闭塞、旋磨头嵌顿等并发症[7],在高速转速 17万转/min下快速通过钙化病变,避免冠状动脉穿孔等并发症[8];(5)旋磨后使用切割球囊充分切割。
结合本例分析,若钙化病变无法顺利进行常规PCI,且出现严重继发性夹层时,不能完全列为RA禁忌证,需要分析病变实际情况及旋磨可行性。本例较为特殊,不足以说明此类手术操作的安全性,要保证手术成功还需要旋磨经验丰富的技术人员熟练操作。
——导丝概述及导丝通过病变技巧

