Wistar大鼠癫痫模型的多模态功能磁共振成像与病理组织学对照研究
邢桂荣,牛广明,曲琳,谢生辉,乔鹏飞*
原发性癫痫是常见的慢性神经系统疾病,具有致残率高、病程长及易复发等特点,严重影响患者的生命健康[1]。因此,研究癫痫患者脑微观结构的病理生理学信息及其发生机制,为其诊断、预防与治疗提供必要的理论依据至关重要。近年来,影像学技术逐渐被应用于癫痫疾病的检查中,并取得一定临床应用效果。扩散峰度成像(diffuse kurtosis imaging,DKI)是较新的MRI序列,在动物脑组织及一些临床病变影像学研究中取得一定成果[2]。三维磁化强度预备梯度回波(3D-magnetization preparatory gradient echo,3D-MPRAGE)是临床诊断神经系统疾病的常用手段,具有较高的时间及空间分辨率[3]。目前,鲜见有关采用包含DKI及3D-MPRAGE序列在内的多模态功能MRI应用于癫痫的文献报道。本研究在建立大鼠癫痫模型后,对其进行多模态功能MRI及组织病理学分析,探究癫痫的发病机制及大鼠癫痫模型的多模态功能MRI与其病理组织学间的关系,旨在为临床诊断及治疗癫痫提供理论参考。
1 材料与方法
1.1 实验动物
3周龄健康Wistar大鼠60只,雌雄各半,体质量180~230 g,平均(205.23±14.18) g,由上海西普尔-必凯实验动物有限公司提供,许可证号:SCXK(沪)2015-1106。先将大鼠置于实验室环境中适应性喂养1周,整个实验过程中大鼠自由饮水和进食。本研究经本院伦理委员会批准同意。
1.2 动物模型制备
适应性喂养1周后将大鼠分为正常对照组(n=30)及癫痫模型组(n=30)。癫痫模型组大鼠用于制备大鼠癫痫模型,模型建造参照文献[4]所述方式:对大鼠进行腹腔注射6 mg/kg的KA(kainic)(10 mg/支,Sigma公司提供),腹腔注射KA后30 min起至12 h内观察并记录大鼠行为,按Racine的癫痫大鼠发作时行为学变化分级标准判断癫痫模型是否成功[5],本研究癫痫模型组30只大鼠均建模成功。对照组腹腔注射等量生理盐水。
1.3 大鼠MRI
1.3.1 MR成像
分别于致病后3 d、1周、3周、5周和8周取雌雄各3只进行MRI检测,同时取相同数量的正常大鼠作为空白对照扫描。釆用Discovery 750 3.0 T超导型磁共振扫描仪(美国GE公司),四通道相控阵老鼠射频线圈,线圈规格为24 cm×10.5 cm×13 cm。扫描序列包括:冠状面3D-MPRAGE、T1WI快速自旋回波(fast spin echo,FSE)、T2WI FLAIR,矢状面T2WI FSE,冠状面扩散加权成像(diffusion weighted imaging,DWI)、扩散张量成像(difussion tensor imaging,DTI)、DKI,体素内不相干运动成像(intravoxel incoherent motion,IVIM)序列,DKI序列采集6个b值:0、500、1000、1500、2000、2500 s/mm2,25个扩散敏感梯度方向。
1.3.2 MRI图像处理及参数计算
采用MRIcro软件,手动勾画大鼠脑内感兴趣区域(region of interest,ROI)并对ROI中脑灰质(gray matter,GM)和脑白质(white matter,WM)中参数值进行测量,同时参考3D-MPRAGE及大鼠常规MRI以确定解剖部位。大鼠脑内ROI设定:参照大鼠解剖图谱及文献中方法,设定大鼠脑内9组ROI。每个ROI测3次,ROI控制在4个体素左右。将DKI图像数据传输至工作站采用Functool软件处理数据,分别得到不同时间点各组大鼠脑部ROI区域不同部位表观扩散系数(apparent diffusion coefficient,ADC)图及DKI相关参数,包含各向异性分数(fractional anisotropy,FA)、平均扩散系数(mean diffusivity,MD)、平均扩散峰度(mean kurtosis,MK)。
1.4 癫痫KA模型大鼠脑组织学检查
分别在各时间点的扩散模型成像技术检查结束后,立即收集大鼠脑组织,行苏木素-伊红(HE)染色分析,置于显微镜下观察并拍照。并随机取海马CA1区域5个及CA3区1个不连续高倍镜视野,计算残存正常神经元数量。
1.5 统计学方法
采用SPSS 20.0软件进行数据分析处理,对于连续型资料以± s表示,采用t检验进行组间比较。采用Pearson法进行相关性分析,P<0.05为差异有统计学意义。
2 结果
2.1 两组大鼠不同时期脑部MRI相关参数比较
随着致病时间延长,正常对照组大鼠脑部FA、MD、MK无明显差异(F=0.165、0.309、0.399,P>0.05);癫痫模型组大鼠脑部FA及MD逐渐降低(F=34.913、56.272,P<0.05),MK逐渐升高(F=41.971,P<0.05)。在相同致病时间点,癫痫模型组大鼠脑部FA及MD均低于正常对照组,而MK高于正常对照组(P<0.05)。见表1。
2.2 致病3 d后MRI观察组大鼠脑组织
致病3 d后,癫痫模型组大鼠在MRI影像学检查冠状面、矢状面T2WI序列,冠状面T2WI-FLAIR及3D-MPRAGE图像上均未出现明显异常信号。见图1。
2.3 两组大鼠不同时期脑部ROI区域不同部位MRI相关参数比较
随着致病时间的延长,正常对照大鼠脑部GM及WM区域内FA、MD及MK均无明显变化(P>0.05);癫痫模型组大鼠脑部GM及WM区域内FA、MD均逐渐降低,而MK逐渐升高(P<0.05)。见表2~6。
2.4 癫痫模型组大鼠脑部MRI相关参数与致病时间间的相关性分析
癫痫模型组大鼠脑部FA、MD与致病时间呈负相关(P<0.05),MK与致病时间呈正相关(P<0.05)。见表7。
表1 两组大鼠不同时期脑部MRI相关参数比较(±s,n=6)Tab. 1 Comparison on brain MRI related parameters in rats at different stages between the two groups (±s, n=6)
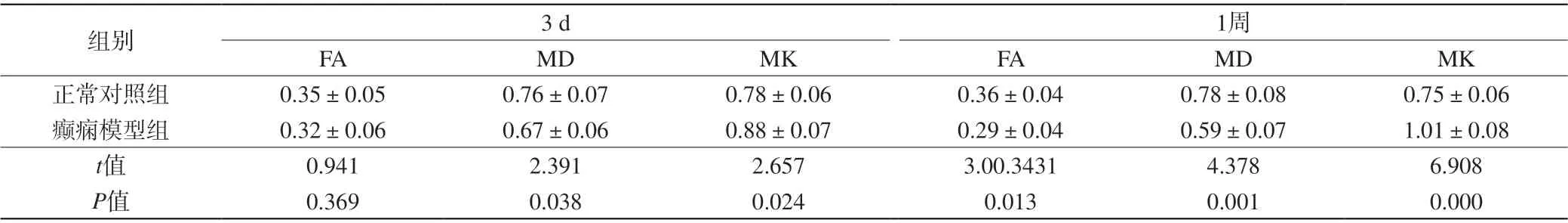
表1 两组大鼠不同时期脑部MRI相关参数比较(±s,n=6)Tab. 1 Comparison on brain MRI related parameters in rats at different stages between the two groups (±s, n=6)
注:MD单位为×10-4 mm2/s,FA、MK无单位。
组别 3 d 1周FA MD MK FA MD MK正常对照组 0.35±0.05 0.76±0.07 0.78±0.06 0.36±0.04 0.78±0.08 0.75±0.06癫痫模型组 0.32±0.06 0.67±0.06 0.88±0.07 0.29±0.04 0.59±0.07 1.01±0.08 t值 0.941 2.391 2.657 3.00.3431 4.378 6.908 P值 0.369 0.038 0.024 0.013 0.001 0.000
续表1 两组大鼠不同时期脑部MRI相关参数比较(±s,n=6)Tab. 1(Cont) Comparison on brain MRI related parameters in rats at different stages between the two groups (±s, n=6)
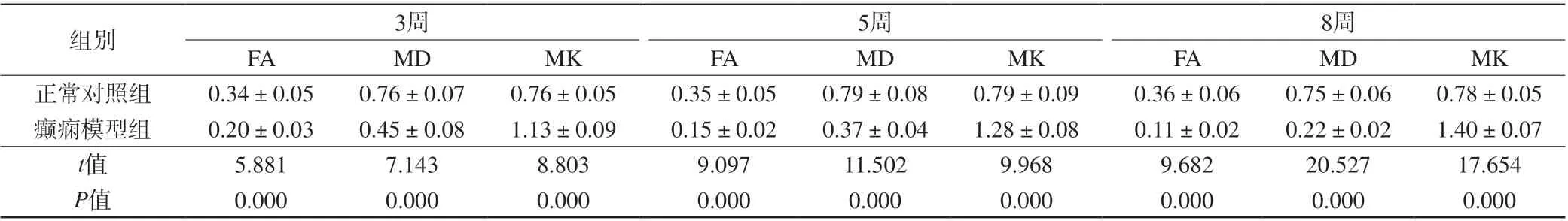
续表1 两组大鼠不同时期脑部MRI相关参数比较(±s,n=6)Tab. 1(Cont) Comparison on brain MRI related parameters in rats at different stages between the two groups (±s, n=6)
注:MD单位为×10-4 mm2/s,FA、MK无单位。
组别 3周 5周 8周FA MD MK FA MD MK FA MD MK正常对照组 0.34±0.05 0.76±0.07 0.76±0.05 0.35±0.05 0.79±0.08 0.79±0.09 0.36±0.06 0.75±0.06 0.78±0.05癫痫模型组 0.20±0.03 0.45±0.08 1.13±0.09 0.15±0.02 0.37±0.04 1.28±0.08 0.11±0.02 0.22±0.02 1.40±0.07 t值 5.881 7.143 8.803 9.097 11.502 9.968 9.682 20.527 17.654 P值 0.000 0.000 0.000 0.000 0.000 0.000 0.000 0.000 0.000
表2 两组大鼠致病3 d脑部ROI区域不同部位MRI相关参数比较(±s,n=6)Tab. 2 Comparison on MRI related parameters in pathogenic 3 days of rats brain ROI areas during different periods between the two groups (±s, n=6)
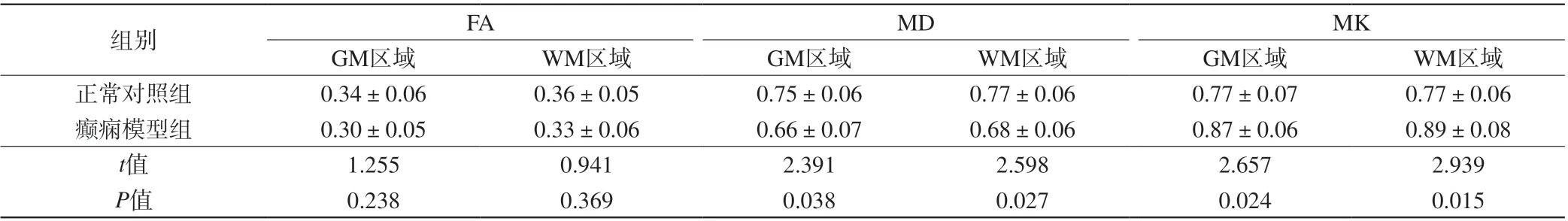
表2 两组大鼠致病3 d脑部ROI区域不同部位MRI相关参数比较(±s,n=6)Tab. 2 Comparison on MRI related parameters in pathogenic 3 days of rats brain ROI areas during different periods between the two groups (±s, n=6)
注:MD单位为×10-4 mm2/s,FA、MK无单位。
组别 FA MD MK GM区域 WM区域 GM区域 WM区域 GM区域 WM区域正常对照组 0.34±0.06 0.36±0.05 0.75±0.06 0.77±0.06 0.77±0.07 0.77±0.06癫痫模型组 0.30±0.05 0.33±0.06 0.66±0.07 0.68±0.06 0.87±0.06 0.89±0.08 t值 1.255 0.941 2.391 2.598 2.657 2.939 P值 0.238 0.369 0.038 0.027 0.024 0.015
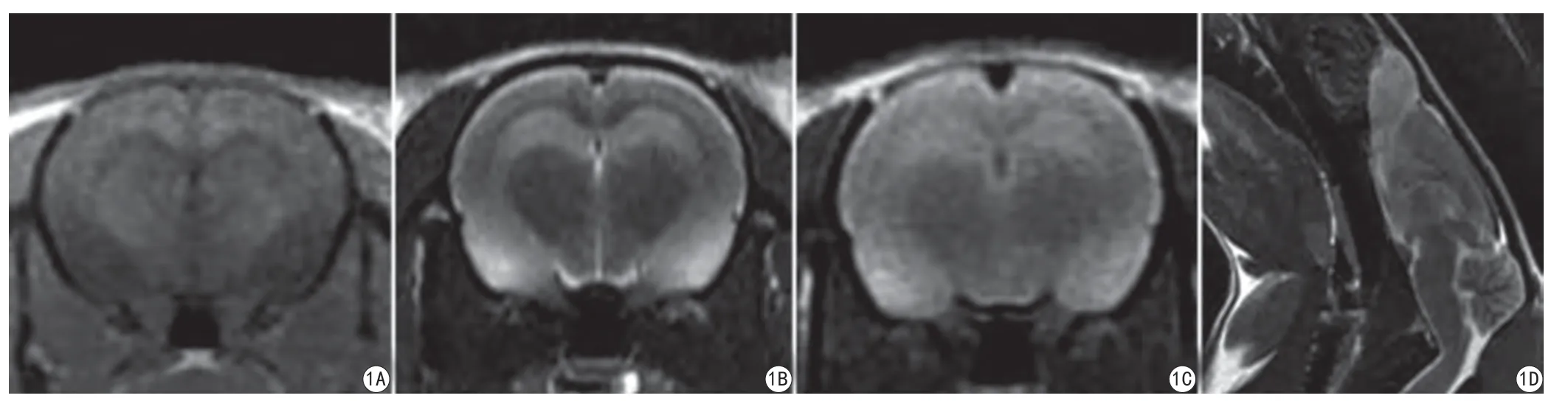
图1 致病3 d后大鼠MRI成像图片。A:冠状面3D-MPRAGE;B:冠状面FSE;C:冠状面FLAIR T2WI;D:矢状面FSE T2WIFig. 1 Pictures of routine MRI imaging of rats. A: 3D-MPRAGE of coronal plane; B: FSE of coronal plane; C: FLAIR T2WI of coronal plane; D: FSE T2WI of sagittal plane.
表3 两组大鼠致病1周脑部ROI区域不同部位MRI相关参数比较(±s,n=6)Tab. 3 Comparison on MRI related parameters in pathogenic 1 week of rats brain ROI areas during different periods between the two groups (±s, n=6)
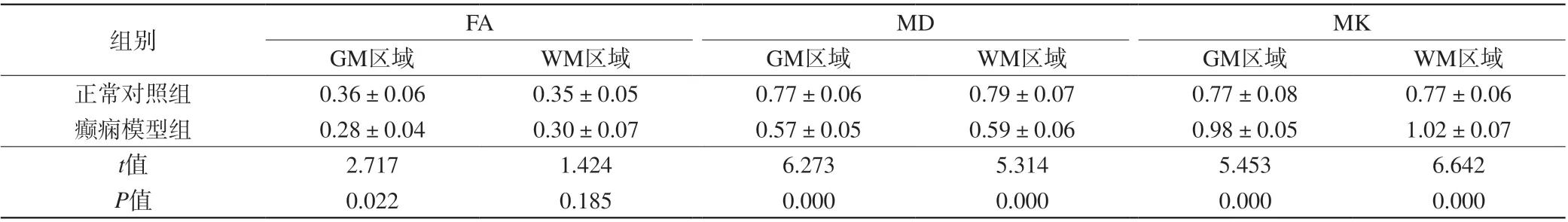
表3 两组大鼠致病1周脑部ROI区域不同部位MRI相关参数比较(±s,n=6)Tab. 3 Comparison on MRI related parameters in pathogenic 1 week of rats brain ROI areas during different periods between the two groups (±s, n=6)
注:MD单位为×10-4 mm2/s,FA、MK无单位。
组别 FA MD MK GM区域 WM区域 GM区域 WM区域 GM区域 WM区域正常对照组 0.36±0.06 0.35±0.05 0.77±0.06 0.79±0.07 0.77±0.08 0.77±0.06癫痫模型组 0.28±0.04 0.30±0.07 0.57±0.05 0.59±0.06 0.98±0.05 1.02±0.07 t值 2.717 1.424 6.273 5.314 5.453 6.642 P值 0.022 0.185 0.000 0.000 0.000 0.000
表4 两组大鼠致病3周脑部ROI区域不同部位MRI相关参数比较(±s,n=6)Tab. 4 Comparison on MRI related parameters in 3 weeks of rats brain ROI areas during different periods between the two groups (±s, n=6)
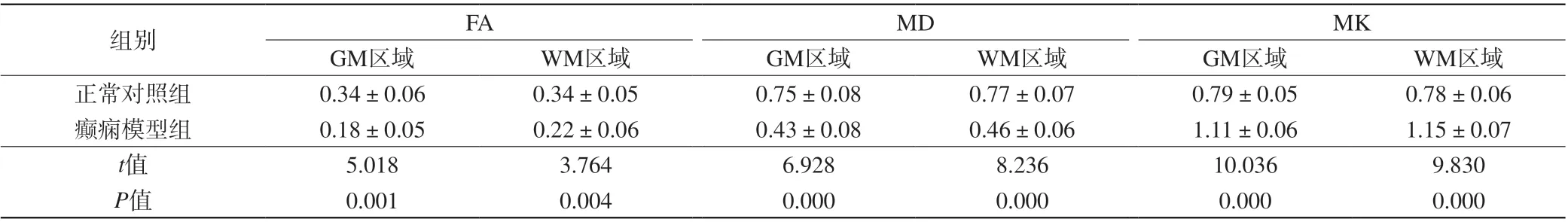
表4 两组大鼠致病3周脑部ROI区域不同部位MRI相关参数比较(±s,n=6)Tab. 4 Comparison on MRI related parameters in 3 weeks of rats brain ROI areas during different periods between the two groups (±s, n=6)
注:MD单位为×10-4 mm2/s,FA、MK无单位。
组别 FA MD MK GM区域 WM区域 GM区域 WM区域 GM区域 WM区域正常对照组 0.34±0.06 0.34±0.05 0.75±0.08 0.77±0.07 0.79±0.05 0.78±0.06癫痫模型组 0.18±0.05 0.22±0.06 0.43±0.08 0.46±0.06 1.11±0.06 1.15±0.07 t值 5.018 3.764 6.928 8.236 10.036 9.830 P值 0.001 0.004 0.000 0.000 0.000 0.000
表5 两组大鼠致病5周脑部ROI区域不同部位MRI相关参数比较(±s,n=6)Tab. 5 Comparison on MRI related parameters in 5 weeks of rats brain ROI areas during different periods between the two groups (±s, n=6)
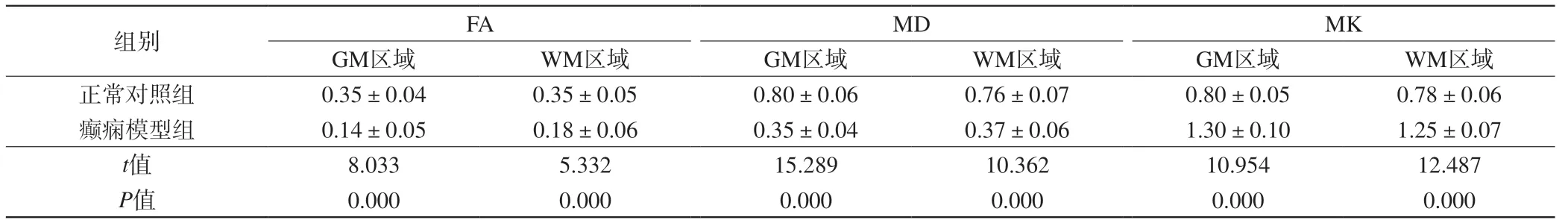
表5 两组大鼠致病5周脑部ROI区域不同部位MRI相关参数比较(±s,n=6)Tab. 5 Comparison on MRI related parameters in 5 weeks of rats brain ROI areas during different periods between the two groups (±s, n=6)
MD单位为×10-4 mm2/s,FA、MK无单位。
?
表6 两组大鼠致病8周脑部ROI区域不同部位MRI相关参数比较(±s,n=6)Tab. 6 Comparison on MRI related parameters in 8 weeks of rats brain ROI areas during different periods between the two groups (±s, n=6)
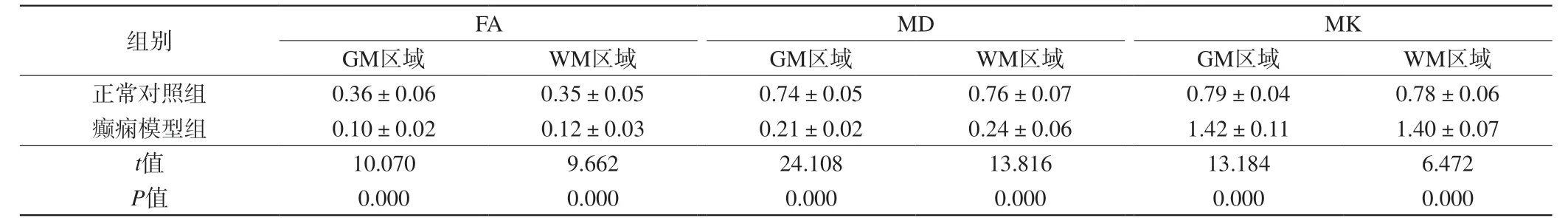
表6 两组大鼠致病8周脑部ROI区域不同部位MRI相关参数比较(±s,n=6)Tab. 6 Comparison on MRI related parameters in 8 weeks of rats brain ROI areas during different periods between the two groups (±s, n=6)
注:MD单位为×10-4 mm2/s,FA、MK无单位。
FA MD MK 组别 GM区域 WM区域 GM区域 WM区域 GM区域 WM区域
表7 癫痫模型组大鼠脑部MRI相关参数与致病时间间的相关性分析Tab. 7 Correlation analysis between brain MRI related parameters and pathogenic time in epilepsy model group
2.5 致病不同时间后各组大鼠残存正常神经元数量比较
致病8周后,正常对照组大鼠脑部组织可见大量正常神经元,呈现淡粉色胶质背景(图2A)。癫痫模型组大鼠脑部组织出现变性坏死,神经元肿胀,空泡变性,轮廓及核仁模糊,且可见淋巴细胞浸润(图2B~2D)。随着致病时间延长,正常对照组大鼠残存正常神经元数量无明显变化(P>0.05),癫痫模型组大鼠残存正常神经元数量逐渐降低(P<0.05)。在致病相同时间点,癫痫模型组大鼠残存正常神经元数量明显低于正常对照组(P<0.05)。见表8。
2.6 癫痫模型组大鼠脑部MRI相关参数与残存正常神经元数量相关性分析
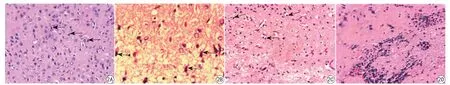
图2 致病8周后正常对照组(A)及癫痫模型组(B~D)大鼠脑部组织HE染色图片Fig. 2 HE staining images of brain tissue in normal control group (A) and epilepsy model group (B—D) after 8 weeks of disease onset.
表8 致病不同时间后各组大鼠残存正常神经元数量比较(±s,n=6)Tab. 8 Comparison on number of remaining normal neurons after different pathogenic time points between the two groups (±s, n=6)
表8 致病不同时间后各组大鼠残存正常神经元数量比较(±s,n=6)Tab. 8 Comparison on number of remaining normal neurons after different pathogenic time points between the two groups (±s, n=6)
组别 3 d 1周 3周 5周 8周 F值 P值正常对照组 116.32±6.45 112.32±6.87 115.33±7.31 118.32±6.97 120.54±6.54 1.236 0.321癫痫模型组 89.36±6.21 62.33±5.96 41.25±4.75 26.33±3.48 12.32±2.65 239.033 0.000 t值 7.376 13.463 20.815 28.924 37.566 P值 0.000 0.000 0.000 0.000 0.000
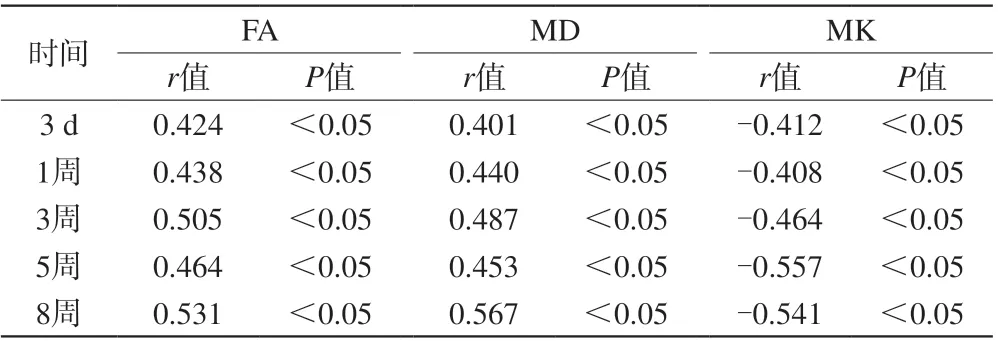
表9 癫痫模型组大鼠脑部MRI相关参数与残存正常神经元数量相关性分析Tab. 9 Correlation between rat brain MRI related parameters and number of residual normal neurons in epilepsy model group
致病后不同时间点,癫痫模型组大鼠残存正常神经元数量与其脑部FA及MD均呈正相关(P<0.05),与MK呈负相关(P<0.05)。见表9。
3 讨论
DKI作为一项新技术,是在DTI的基础上发展起来的,能够更加真实客观地反映组织的微观结构[6]。癫痫的异常信号可扩散到脑内许多细微结构中并诱导损伤,DKI可显示这种细微结构的改变[7]。在显示病灶的微结构信息中,其参数值对评价脑白质微结构的变化更为敏感也更具有特异性,且不依赖组织结构的空间方位、可避免图像中混杂效应的干扰,因而在评估癫痫进程和治疗中发挥着非常重要的作用[8]。3D-MPRAGE属于T1加权快速容积MRI扫描技术,具有较高的空间分辨率和时间分辨率,伪影小,能三维显示人脑内部精细解剖结构,对神经系统疾病(包括原发性癫痫)的诊断具有重要价值[9]。相比较于单一模式的MRI,包含DKI及3D-MPRAGE序列在内的多模态功能MRI不仅能包含DTI模型所有的影像学信息,包含FA、MD等,同时还能检测MK。相比较于FA、MD,MK的优势在于不依赖于组织结构的空间方位,脑部GM及WM区域均可采用MK加以判定。此外,DKI及3D-MPRAGE序列的联合检测可显著提升对微小病灶及病灶细节处的成像质量,利于获得更多的影像学信息。Chen等[10]研究也认为,相比较于单一模型MRI,多模态功能MRI在癫痫的诊断中具有更高的应用价值。
在本研究中,癫痫模型组大鼠在MRI影像学检查冠状面、矢状面T2WI序列,冠状面T2WI-FLAIR图像上均未出现明显异常信号。但是病理组织学检测结果显示,癫痫模型组脑部组织出现变性坏死,神经元肿胀,空泡变性,轮廓及核仁模糊,且可见淋巴细胞浸润。而上述结果在多模态功能MRI的测量结果上可体现出来,癫痫模型组大鼠脑部GM及WM区域FA、MD均低于正常对照组,而MK明显高于正常对照组,提示相比较于常规单一模式的MRI检测,多模态功能MRI诊断癫痫准确性更高,与Dupont等[11]研究结果相符。大量学者认为采用KA诱导的大鼠癫痫模型主要是引起类似于人类颞叶癫痫(temporal lobe epilepsy,TLE)的病理学改变及行为特征,但本研究多模态功能MRI结果显示,信号异常并不局限于脑部组织海马区,在基底节等GM区域及前联合、胼胝体等WM区也出现明显的参数异常[12]。而其原因可能在于海马及杏仁核是异常神经冲动的起源,当海马及杏仁核出现异常后会向周围发出异常神经冲动,而这种异常信号扩散于周围结构及皮质将导致癫痫的发作,形成“点燃”效应。也就是说由于缺氧等原因造成的脑部组织损伤将导致海马神经元的丢失及胶质增生,从而诱发癫痫,引起脑部组织海马及周围区域影像学参数的变化,而这可能是癫痫发生的机制之一[13]。
组织病理学结果显示,相比较于正常对照组,大鼠神经脑部组织损伤程度随着致病时间的延长而逐渐加重,与Wang等[14]研究结果相符。而本研究相关性研究发现,癫痫模型组大鼠残存正常神经元数量与其脑部FA及MD均呈正相关,与MK呈负相关,提示多模态功能MRI检测结果与癫痫大鼠组织病理学检测结果显著相关,而多模态功能MRI可作为临床诊断癫痫及评估其疾病严重程度的影像学方法之一。Rong等[15]研究显示,颞叶癫痫患者存在一定程度的认知功能障碍,MRI和DTI不仅能有效检出患者脑组织的损伤部位,而且能用于评估患者脑损伤程度,与本研究结果一致。
综上所述,癫痫的发病可能与脑部海马及杏仁核异常神经冲动有关,采用多模态功能MRI所检测的癫痫模型大鼠的FA、MD及MK与其脑组织病理学检测结果显著相关,多模态功能MRI可作为临床诊断癫痫及评估其疾病严重程度的影像学方法之一。
利益冲突:无。

