基于迁移学习算法对新生儿大脑3D T1WI的灰白质分割及其发育量化研究
李贤军,陈健,夏菁,王苗苗,李梦轩,王利,李刚,沈定刚*,杨健*
脑皮层的早期发育与神经行为能力的发展密切相关,新生儿期是脑皮层发育的关键时期[1],而早产是影响脑发育水平的重要因素[2]。因此,需对新生儿脑皮层发育规律进行研究,并评估早产对脑皮层发育的影响,为及时采取干预措施提供依据。MRI是新生儿脑检查的主要方法,其中3D T1加权成像(T1 weighted imaging,T1WI)对新生儿局灶性白质损伤病灶的检出率最高[3-4],在新生儿影像检查中使用广泛。但是,新生儿脑T1WI图像对比度低,偏容积效应严重,对其进行图像分割面临巨大挑战[5]。以往研究基于多种成像序列或多时间点采集的图像实现了儿童脑MRI灰白质分割[6-7];然而,由于新生儿自我控制能力差,无法长时间保持安静状态[8],以往方案不适宜于新生儿。上述技术局限性导致新生儿脑皮层发育的研究不深入[5],如何基于T1WI进行图像分割将是解决上述问题的关键。机器学习方法在图像分割中得到了有效应用[9],为新生儿T1WI图像分割提供了新思路。针对图像分割任务,密集卷积神经网络表现突出[10],在该网络中,每一层的输入是来自前面所有层的输出,同时,该层输出的特征也会传给后面各层。该模型可实现特征的重复利用进而减少特征图,具有抗过拟合的优点。基于上述特点,本研究采用密集卷积神经网络迁移学习实现新生儿T1WI图像分割模型,并基于分割结果重建大脑皮层,探讨脑皮层表面积、厚度、容积等量化指标在新生儿期的发育变化特点,分析早产儿与足月儿脑皮层发育状态的差异。
1 材料与方法
本研究获得了医院伦理委员会的批准,MRI检查前告知新生儿监护人检查注意事项,并由监护人签署了知情同意书。
1.1 研究对象
本文中研究对象是进行脑损伤筛查以及脑发育状态评估的儿童,为了尽早检测到脑损伤病灶,新生儿期(生后28 d以内)进行MRI检查是首选方案;然而,脑发育状态评估的参考是足月新生儿,为了将该部分早产儿与足月儿进行对比分析,在校正胎龄达到足月期才具备可比性。鉴于此,本文中早产儿包括了早产新生儿与校正至足月期的早产儿。
研究对象的纳入标准:早产新生儿(胎龄<37周;MRI检查日龄≤28 d)、校正至足月期的早产儿(胎龄<37周;校正胎龄≥37周,其中校正胎龄=胎龄+MRI检查日龄)、足月新生儿(胎龄≥37周;MRI检查日龄≤28 d);完整的三维T1WI图像数据;完整的出生指标。排除标准:局灶性脑白质损伤;脑出血;室管膜下囊肿;脑软化灶;临床诊断为缺血缺氧性脑病;以及其他常规MRI诊断异常。经纳入排除标准筛选,最终入组研究对象50例。根据胎龄、校正胎龄等信息,研究对象分为3组:18例早产新生儿、16例校正至足月期的早产儿、16例足月新生儿。
1.2 数据采集设备及方案
使用GE 3.0 T MRI设备(型号:Signa HDxt;GE医疗;美国)以及8通道头线圈进行三维快速扰相梯度回波T1WI序列扫描。具体参数为:重复时间=10.47 ms;回波时间=4.76 ms;反转时间=400 ms;全脑等体素采集(1 mm×1 mm×1 mm);视野=240 mm×240 mm;采集矩阵=240×240;重建矩阵=256×256;层厚=1 mm。
为了确保顺利完成MRI检查,检查前30 min由责任护士遵主管医师医嘱,通过口服或灌肠给予新生儿10%水合氯醛(25 mg/kg),操作流程严格遵循指南[11]执行。待新生儿入睡后由主管医师与监护人护送至MRI检查室,包裹在襁褓中放在扫描床上,使用耳塞对听力进行保护,同时在头部两侧放置海绵、气囊以适当固定。在整个检查过程中对心率、呼吸等生理指标进行监测。
1.3 数据预处理
在图像分割前,本研究对图像进行了预处理[5,12]。首先将图像重采样,体素大小由0.94 mm×0.94 mm×1 mm重采样为1 mm×1 mm×1 mm;为了去除磁场不均匀导致的图像灰度偏移,采用N3校正方法进行图像灰度不均匀校正;最后,去除脑外信号以提取脑实质区域,从而使图像中的信号仅包括灰质、白质、脑脊液3部分。
1.4 图像分割模型的训练与评价
在本研究中,模型训练与评价的流程包括:相似数据集初步训练、本地数据初步分割、手动修正、基于修正数据对模型进行二次训练、模型测试等环节(如图1)。
模型结构与参数设置:本文所使用的密集神经网络由下采样通路和上采样通路构成,包括7个密集模块及相应的过渡层(如图1)。在下采样通路中,过渡层包括卷积层、批量归一化层、线性整流单元、池化层;在上采样通路中,过渡层则包括反卷积层、批量归一化层、线性整流单元。为了获取局部区域特征,训练图像以图像块的形式进入网络,图像块大小设置为32×32×32。采用Xavier初始化方法对神经网络进行初始化,同时选择交叉熵作为损失函数,使用最陡下降法寻找最优解,学习率初始化为0.005。卷积层的卷积核为3×3×3、步长设为1、以0填充。为了保证特征图大小改变时运算依然可行,在两个密集模块之间使用过渡层,利用卷积、池化改变特征图的大小。模型训练和测试在NVIDIA Titan X GPU平台实现。
模型训练与参数调整:本研究对模型的训练包含初步训练与二次训练,使用外部训练集与本地训练集样本共计30例。考虑到新生儿脑部结构的手动标注复杂且耗时,本研究采用了迁移学习的策略[13]。首先引入来源于外部数据库(http://iseg2017.web.unc.edu/babyconnectome-project/)具有标签的相似数据集(样本量:5例)进行模型初步训练,得到初步训练的分割模型,然后将该模型应用于本地数据集。虽然两个新生儿数据集在参数上相似,但两个数据集的图像在灰度分布、空间分辨率、图像质量等方面仍有差别。在初步分割结果的基础上,由专家(从事新生儿MRI诊断工作时间大于5年的影像科医师)对分割结果进行手动修正,从而得到修正后的分割结果。最后,随机抽取25例本地修正后的数据作为训练集对模型进行二次训练;通过独立验证(验证集样本量:10例)实现参数优化并得到最终的图像分割模型。
模型评价:将训练好的模型应用于测试集(样本量:15例),进行灰质、白质、脑脊液等区域Dice系数的计算。该参数取值范围为0~1,越接近于1表明分割效果越好,计算方式如下:
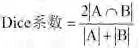
上式中,A代表使用模型得到的分割结果,B代表专家标注的结果。
在图像分割的基础上进行拓扑结构校正、脑皮层重建[12,14]。全脑被分为左侧、右侧大脑半球,并分别计算双侧大脑半球的皮层表面积、厚度以及容积。
1.5 统计学分析
采用SPSS 17.0中的Mann-Whitney U检验方法进行组间差异分析;性别比例的组间比较采用χ2检验。脑皮层表面积、厚度、容积与校正胎龄的相关性采用Spearman偏相关(早产因素作为控制变量),P<0.05被认为差异有统计学意义。针对多重比较,采用Bonferroni校正(总的比较次数为3),即P<0.017(0.05/3)被认为具有统计学意义。
2 结果
2.1 研究对象基本信息比较
早产新生儿与校正至足月期的早产儿的胎龄、性别差异无统计学意义;MRI检查日龄、校正胎龄差异有统计学意义。早产新生儿与足月新生儿的检查日龄、性别的组间差异无统计学意义;胎龄、校正胎龄的组间差异有统计学意义。校正至足月期的早产儿与足月新生儿的校正胎龄、性别差异无统计学意义;胎龄、检查日龄差异有统计学意义。见表1。
2.2 卷积神经网络图像分割效果评估
图像分割模型可有效地分割新生儿脑灰质、白质、脑脊液(图2)。由图2中各典型层面的分割结果可见,该模型适用于早产新生儿、校正至足月期的早产儿、足月新生儿等人群。并且各区域分割具有较高的准确性,灰质、白质、脑脊液Dice系数最小值分别为0.93、0.97、0.96,最高可达0.99(表2)。
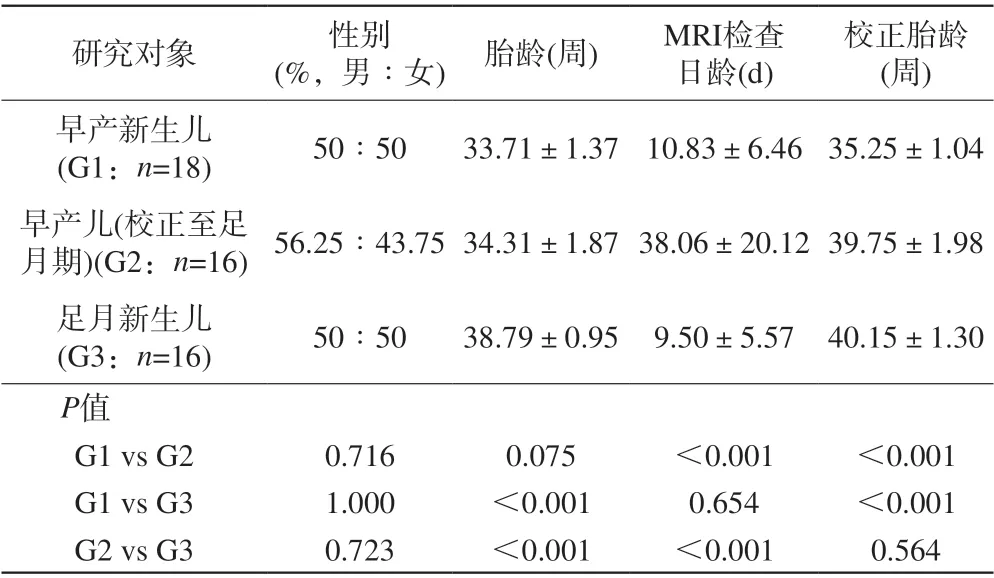
表1 研究对象的人口统计学资料Tab. 1 Demographics of the participants
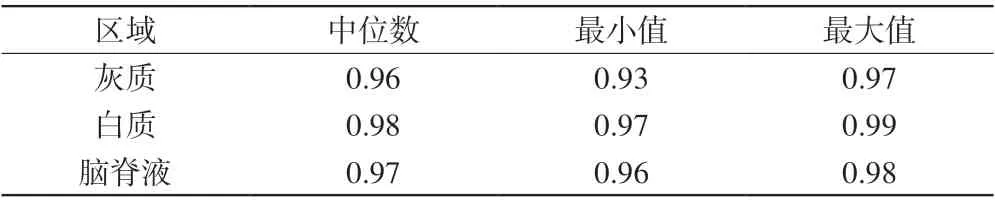
表2 脑灰质、白质、脑脊液区域分割的Dice系数Tab. 2 Dice ratios for the segmentation of gray matter, white matter, and cerebrospinal fluid regions

图1 图像分割模型训练与测试流程图Fig. 1 Flow chart of the training and testing of the image segmentation model.

图2 脑T1WI图像的灰质、白质、脑脊液分割结果。A:T1WI图像典型层面;B:对应T1WI图像的分割结果Fig. 2 Segmentation of gray matter, white matter, and cerebrospinal fluid on brain T1WI. A: Representative slices of T1WI; B: Segmented results corresponding to the T1WI slices.
2.3 脑皮层形态学指标与校正胎龄的相关性
通过形态学指标与校正胎龄的相关性分析(图3)发现,双侧大脑半球皮层表面积、容积随着校正胎龄的增加而显著增大(P<0.001);左侧大脑半球皮层厚度与校正胎龄呈弱正相关(r=0.31,P=0.029),而右侧大脑半球皮层厚度与校正胎龄的相关性无统计学意义(r=0.23,P=0.110)。
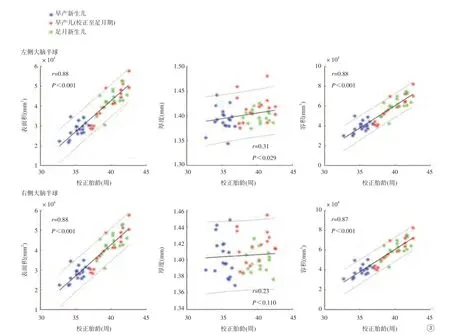
图3 脑皮层表面积、厚度、容积与校正胎龄的相关性Fig. 3 Correlations between surface area, cortical thickness, volume and the postmenstrual age.
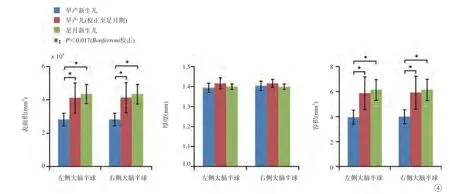
图4 早产儿与足月儿脑皮层表面积、厚度、容积的组间比较Fig. 4 Inter-group comparisons of surface area, cortical thickness, and volume on preterm and term infants.
2.4 早产儿与足月儿脑皮层形态学指标组间比较
与早产新生儿相比,校正至足月期的早产儿以及足月新生儿的双侧大脑半球皮层表面积、容积显著增高(P<0.001),皮层厚度的差异无统计学意义;校正至足月期的早产儿与足月新生儿相比,双侧大脑半球皮层表面积、厚度以及容积的差异无统计学意义(图4)。
3 讨论
为满足早产儿脑发育状态评估的临床需求,本文通过密集卷积神经网络实现了新生儿脑灰质、白质、脑脊液的图像分割,并获得了脑皮层形态学指标。结果表明,新生儿期脑皮层表面积、容积与校正胎龄呈显著正相关,皮层厚度与校正胎龄的相关性较弱,且左右脑存在差异。早产与足月新生儿的脑皮层形态存在显著差异。
3.1 新生儿脑皮层形态发育变化特点
脑皮层在新生儿期快速发育[1],具体而言,皮层容积成倍增加[15]。本研究结果表明,校正胎龄从32周至42周,左、右大脑半球皮层容积分别增加了2.73、2.66倍。通常皮层容积取决于皮层表面积与厚度[16]。本研究发现,新生儿期脑皮层的快速变化主要体现为皮层表面积的增加,而皮层厚度与校正胎龄的相关性则较弱。该结果反映出皮层表面积不断延展,并伴随脑沟回折叠程度增加,这与脑沟回发育水平的视觉评估结果一致[17]。皮层表面积的快速增加与神经元向皮层迁移、生长以及突触形成有关[16]。尽管神经元的增殖迁移主要发生在胎儿期,出生后仍可观察到神经元向额叶迁移[18]。此外,左右大脑半球结构发育特点存在差异。脑功能研究[19]表明,出生后3个月的婴儿脑功能已经体现出左侧大脑半球优势。本文结果中左侧皮层厚度与校正胎龄的相关性强于右侧,从脑结构发育的角度说明了双侧大脑半球的不对称性。
3.2 早产对新生儿脑皮层发育的影响
早产是影响新生儿脑发育的重要因素[20],本研究发现,早产新生儿双侧大脑半球皮层表面积与容积均低于足月新生儿,这表明早产儿较同时期足月儿脑发育成熟度低。尽管在校正至足月期时早产儿存在赶上足月儿的趋势,但早产儿组内各项指标的标准差仍大于足月儿。可见早产以及过早的外界刺激改变了脑结构的发育轨迹[2],从而影响儿童行为能力[21]。这种影响甚至持续到青少年时期,进而影响高级认知功能的发展[22-23]。新生儿期脑皮层形态学指标不仅对于量化评估早产儿发育水平具有重要价值,对于认识早产儿后天行为的结构基础亦至关重要[24]。虽然早产引起脑皮层结构改变的机制尚不明确,可能与孕晚期、新生儿期的神经元的生长、分化以及迁移受到干扰有关[23]。同时,脑结构的发育受遗传、外界因素双重影响[16,25],早期干预有助于改善早产儿的预后。本文结果提示,与皮层厚度相比,皮层表面积对于监测早产因素的影响更为敏感,从影像学角度为新生儿期及时采取干预措施提供了客观依据。
3.3 本研究对方法的改进与局限性
新生儿脑MRI图像分割是研究脑发育的关键环节,也是图像处理领域的难点[5]。围绕脑图像分割,基于脑模板及其组织概率图的常规分割方法在成年人数据中取得了良好效果,并在公开工具中集成[26]。然而,常规方法对图像对比度要求较高。而新生儿图像灰白质对比度低,仍需借助2岁儿童分割结果引导才能完成分割任务[27]。同时,常规方法对模板及其组织概率图依赖性强,目前仍缺乏适宜于中国新生儿的脑模板及其组织概率图。此外,常规方法的参数针对成年人设置而无法直接应用于新生儿。鉴于此,已有研究采用多信息融合的策略进行方法改进[6-7],但增加了图像采集的难度以及计算复杂度。与以往方法相比,本文主要从以下方面对其进行了改进:首先,基于T1WI单一序列完成分割,T1WI是影像诊断中常用的成像方法,检查时间短,易获取,与依赖多序列图像或多时间点数据的方法[6-7]相比,本文所采用的方法更适用于新生儿人群。此外,以往基于深度学习的方法常耗费大量时间进行数据标注[24],为了提高图像标注的效率,本研究借鉴迁移学习的策略[13],利用相似数据集进行模型初步训练,并进行人工修正,可减少人工标注的工作量。经评价,本文的方法适用于新生儿,进一步验证了密集卷积神经网络分割模型是一种有效的图像分割方法。
本研究仍存在一定的局限性。首先,本文用于训练模型的数据在样本量与多样性方面仍存在不足,仍需采用多中心数据进行模型的再次训练,进一步提高模型的泛化能力。本研究是一项断面研究,所描述的脑发育规律仍待纵向数据验证。由于缺乏中国新生儿脑图谱,本文未能就各脑区的发育规律展开研究,计划通过构建新生儿脑分区图谱克服上述不足。
综上所述,通过对密集卷积神经网络训练,可有效地实现新生儿脑T1WI图像分割;基于图像分割与皮层重建可量化评估新生儿脑皮层的发育水平,早产儿双侧大脑半球皮层发育落后于足月儿。
利益冲突:无。

