水通道蛋白磁共振分子成像在缺血性脑卒中的可视化研究
彭晓澜,翁烨,黄立东,余波,陈秋雁,魏鼎泰
水通道蛋白(aquaporins,AQPs)是1993年Peter Agre发现的细胞膜上可以快速输送水分子的物质[1]。研究表明[2],AQPs的表达水平和分布情况与许多疾病的发生、发展密切相关,是疾病过程中的关键分子靶点。多b值磁共振扩散加权成像(MR diffusion weighted imaging,MR-DWI)水通道蛋白分子成像是近年来脑卒中研究领域中的新兴技术。AQPs作为DWI-MR序列的报告基因已在Mukherjee等[3]的研究中得到证实,研究发现AQPs过表达可增加水的扩散从而在MRI中产生信号对比而被检测到,并观察到AQP-MRI具有以下优点:无创、实时、动态、高敏感性、安全。近年来研究[4]认为b值越高,MR成像检测的对象越接近AQPs内转运的水分子,这样就可对AQPs的表达情况进行定量评价。目前已有研究应用AQP-MRI对离体组织[4]及肝脏纤维化动物模型进行评估[5],课题组前期应用AQP-MRI对肢体远端缺血预处理(limb remote preconditioning,LRP)动脉模型作了较深入的研究[6-7],但AQP-MRI在脑卒中领域中的可视化研究尚未见报道。为此,本研究将AQP-MRI用于缺血性脑卒中的可视化成像评价,试图将脑缺血病程中微观信息通过AQP-MRI作直观展示。
1 材料与方法
1.1 实验动物
实验动物由福建医科大学动物中心提供,健康成年雄性SD大鼠共25只,体重230~260 g,术前大鼠被安置在温度、湿度可控的动物房里,允许自由摄食,不限制饮水。将25只大鼠随机分为5组:1、3、6、24、48 h,每组各5只。本实验通过动物伦理审查委员会批准。
1.2 大鼠短暂性脑缺血模型(middle cerebral artery occlusion,MCAo)的建立
线栓法制备大鼠脑缺血再灌注模型:用4%异氟烷吸入麻醉大鼠,麻醉成功后,用1.5%~2.5%异氟烷维持麻醉,分离出右侧颈总、颈外、颈内动脉,夹闭颈内动脉、颈总动脉,在颈外动脉远端分别结扎动脉,距离约1 cm,在两处结扎中央剪断颈外动脉,选择直径约0.26 mm的线栓自颈外动脉插入颈内动脉约2 cm,60 min后退出线栓恢复再灌注。整个手术过程监测直肠体温,维持在36.2℃~37.2℃。应用激光多普勒血流仪检测大鼠脑血流灌注量,下降75%以上为建模有效。
假手术组:仅分离出右侧颈部血管、剪断颈外动脉,不做任何夹闭,暴露与上述手术所需相同时间后缝合切口。
1.3 MR扫描
采用3.0 T GE Discovery 750磁共振扫描仪,从退出线栓开始分别于1、3、6、24 h行MR扫描,使用4通道小动物头部线圈(WK602,Magtron Tnc),异氟烷麻醉成功后,将大鼠俯卧位固定于扫描支架上,头置于线圈中央,整个扫描过程中保持1.5%~2.5%异氟烷持续吸入麻醉。扫描序列包括:①多b值DWI,共18个b值,分别为b=30、50、80、100、150、200、300、500、800、1000、1300、1700、2000、2500、3000、3500、4000、4500 s/mm2。扫描参数:FOV 10.0 cm×0.5 cm,层厚2.0 mm,TR 3300.0 ms,TE选最小单位,矩阵128×128,带宽166.7,扫描时间6 min 43 s。②T2-FLAIR,采用快速自旋回波(fast spin echo,FSE)序列,扫描参数:FOV 10.0 cm×10.0 cm,层厚2.0 mm,TR 8450.0 ms,TE 145.0 ms,矩阵256×256,激励次数1.00,带宽62.50,翻转角111°,扫描时间2 min 50 s。③常规DWI,扫描参数:FOV 6.0 cm×0.70 cm,层厚2.0 mm,TR 3300.0 ms,TE选最小单位,b=1000 s/mm2,矩阵128×128,带宽125.0,扫描时间2 min 45 s。
1.4 MR数据分析
扫描完成后将原始图像传送至图像存档与传输系统(picture archiving and communication systems,PACS)及GE Aw Volume Share 5 后处理工作站,应用Functool软件进行后处理,AQP-MR序列取b阈值为>2000 s/mm2,即b=2000、2500、3000、3500、4000、4500 s/mm2,共6个b值拟合得到AQP-MR伪彩图,测量各个序列每一层面病灶的相对面积,用病灶面积/同层面总面积百分比(%)表示,并且取连续5个层面,最后将所测得总面积除以5,用ra-T2-FLAIR、ra-DWI、ra-AQP表示。在T2-FLAIR及DWI序列高信号区画感兴趣区(region of interest,ROI),并采用镜像法取对侧相同区域ROI值,结果用rT2-FLAIR、rADC表示,为患侧ROI值/对侧镜像ROI值(%)。分别测量24 h患侧基底节区和同侧远端皮层水通道蛋白表观扩散系数(AQP-apparent diffusivity coefficient,AQP-ADC)的ROI相对比值,用rAQP-ADC表示,为患侧ROI值/对侧镜像ROI值(%)。以上测量均采取每个层面测量3次取平均值的方法。
1.5 梗死面积的测量
大鼠在恢复再灌注24 h行MRI检查完毕后,麻醉,PBS (PH7.4)心脏灌注,断头,取脑,自额叶由前向后作冠状切片(厚2 mm),共计5片;切片随后放入2% 2,3,5-氯化三苯基四氮唑(triphenyltetrazolium chloride,TTC)染色染液室温孵育20 min,4%多聚甲醛过夜;采用扫描仪采集图像来测量梗死面积。应用Image pro plus图像分析软件(Version 6.0,Media Cybernetics)对5张TTC染片扫描图像描边采集,分别测量梗死面积及该层面大脑总面积,取其平均值,结果以梗死面积/该层面总面积的百分比(%)来表示。
1.6 统计学方法
所有计数资料均采用均数±标准差(x ±s)表示,使用SPSS 17.0统计软件进行分析,采用配对样本t检验。TTC染色结果与MRI检查结果相关性采用Pearson相关分析法,P<0.05表示差异具有统计学意义。
2 结果
2.1 不同时间点AQP-MRI对缺血病灶显示情况
本研究展示再灌注后1、3、6、24 h,AQP-MRI、DWI及T2-FLAIR各序列缺血病灶情况(图1)。与T2-FLAIR及DWI比较,AQP-MRI可更加敏感地显示病灶,尤其在缺血早期,再灌注1 h,T2-FLAIR未见异常信号,DWI、AQP-MRI就可清晰显示缺血灶;再灌注3 h,AQP-MRI显示病灶面积较DWI大,且更多层次,AQP-ADC伪彩图直观显示多层次色带,不同色带AQPADC值有差异,提示AQP-ADC可展示病灶内部的微观信息。
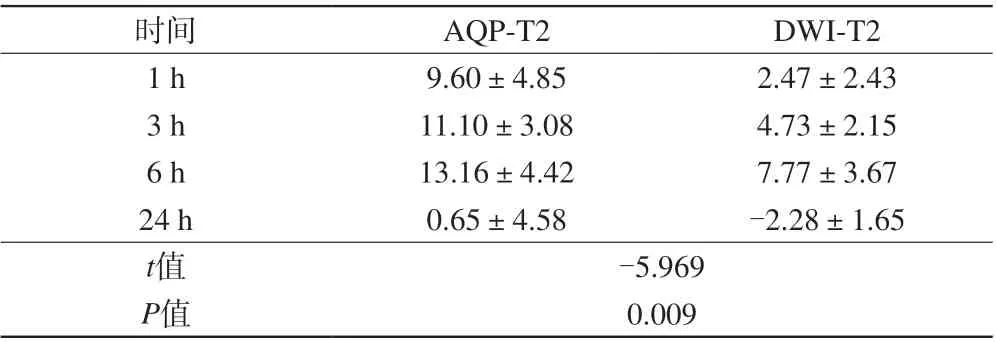
表1 不同时间点AQP-MRI与T2-FLAIR、DWI与T2-FLAIR不匹配面积比较Tab. 1 Comparison AQP-MRI/T2-FLAIR mismatch with DWI/T2-FLAIR mismatch areas in different time points after stroke
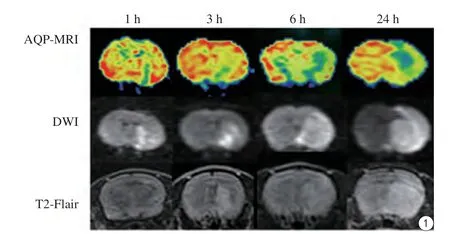
图1 不同时间点AQP-MRI显示缺血灶情况,与T2-FLAIR及DWI序列比较,AQP-MRI可更加敏感、多层次展示缺血灶,AQP-MRI伪彩图还可显示病灶内微观信息Fig. 1 AQP-MRI showed ischemic lesions in different time points. AQPMRI displayed ischemic stroke with multi-layer and more sensitively, compared with T2-FLAIR and DWI. AQP-MR pseudo-color images visualized microscopic information of the lesions.
2.2 24 h以内,AQP-MRI与T2-FLAIR、DWI与T2-FLAIR不匹配面积比较
1、3、6、24 h时间点,ra-AQP与ra-T2-FLAIR面积差和ra-DWI与ra-T2-FLAIR面积差显著不同(t=-5.969,P<0.01),并且6 h后,两者面积差都迅速减小,至24 h相差无几(表1、图2、3)。本研究将AQPMRI与T2-FLAIR面积差定义为“水通道蛋白分子半暗带”,与传统定义的半暗带,即DWI/T2-FLAIR不匹配面积作比较。结果表明,大鼠在MCAo后再灌注24 h内都存在半暗带,无论是AQP-MRI/T2-FLAIR不匹配还是DWI/T2-FLAIR不匹配都可显示半暗带。AQP-MRI/T2-FLAIR不匹配区域显示的半暗带比DWI/T2-FLAIR不匹配显示的半暗带范围大。
2.3 1~6 h,AQP-MRI显示病灶外周AQP-ADC值较对侧相同区域增高
本研究观察到大鼠取栓再灌注24 h,病灶几乎累及大脑皮层。在1、3、6 h时间点, AQP-MRI显示在病灶周围正常脑实质可检测到AQP-ADC值较对侧相同区域增高(图4)。两者间差异具有统计学意义(t=8.227,P=0.014)(图5)。
2.4 24 h,AQP-MRI直观显示患侧基底节区与同侧远端皮层有差异
取栓后24 h,DWI及T2-FLAIR患侧均呈大面积高信号,灰白质缺乏对比,肉眼看不出信号的差别,但皮层及基底节区相对比值rADC与rT2-FLAIR却存在差异(t=5.292,P=0.034;t=-50.909,P=0.000)。AQP-MR伪彩图可清晰显示皮层和基底节区存在差异,这一差异具有可视化特点(图6),计算AQP-ADC相对比值在皮层和基底节区分别为(67.67±1.53)%和(47±0)%,两者之间的差异具有统计学意义(t=23.434,P=0.002)。
2.5 梗死面积与MRI检查结果的相关性分析
取栓后24 h,TTC染色显示梗死面积与MRI检查结果一致(图7)。TTC显示梗死面积与AQP-MRI、DWI、T2-FLAIR测量梗死面积均无显著性差异(t=1.208,P>0.05;t=-0.413,P>0.05;t=1.757,P>0.05)。将TTC显示的梗死面积分别与AQP-MRI、DWI、T2-FLAIR测量的梗死面积作相关性分析,结果显示两者间均有显著相关性(r=0.903,P=0.004;r=0.935,P=0.02;r=0.872,P=0.054)(图8)。
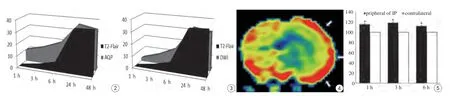
图2 24 h内AQP/T2-FLAIR不匹配区域面积变化图 图3 24 h内DWI/T2-FLAIR不匹配区域面积变化图 图4 AQP-MRI显示病灶周围脑组织AQP-ADC值较对侧相同区域增高(箭) 图5 1~6 h,患侧病灶周围与对侧相应部位AQP-ADC值比较Fig. 2 Area change diagram of AQP/T2-FLAIR mismatch within 24 h after stroke. Fig. 3 Area change diagram of DWI/T2-FLAIR mismatch within 24 h after stroke. Fig. 4 The AQP-ADC values of peripheral to the lesion in the ipsilateral areas were much higher than that of in the contralateral areas (arrow). Fig. 5 Comparison AQP-ADC values of peripheral to the lesion in the ipsilateral areas with the contralateral side in 1—6 h after stroke.
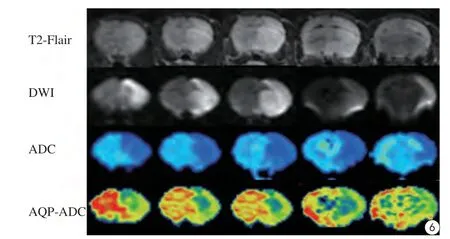
图6 取栓后24 h,T2-FLAIR及DWI显示患侧均呈大面积高信号,ADC图显示病灶扩散受限、ADC值减低,但灰白质缺乏对比。AQP-ADC可清晰显示基底节区和同侧远端皮层存在差异,具有可视化优点Fig. 6 T2-FLAIR and DWI showed a large area of hyperintensity on affected side in 24 h after stroke. The ADC map showed restricted diffusion and the ADC value reduced. But the differences between white matter and gray matter lacked of contrast. The microscopic differences between the basal ganglia and ipsilateral distal cortex could be displayed visually in AQP-MR pseudo-color images.
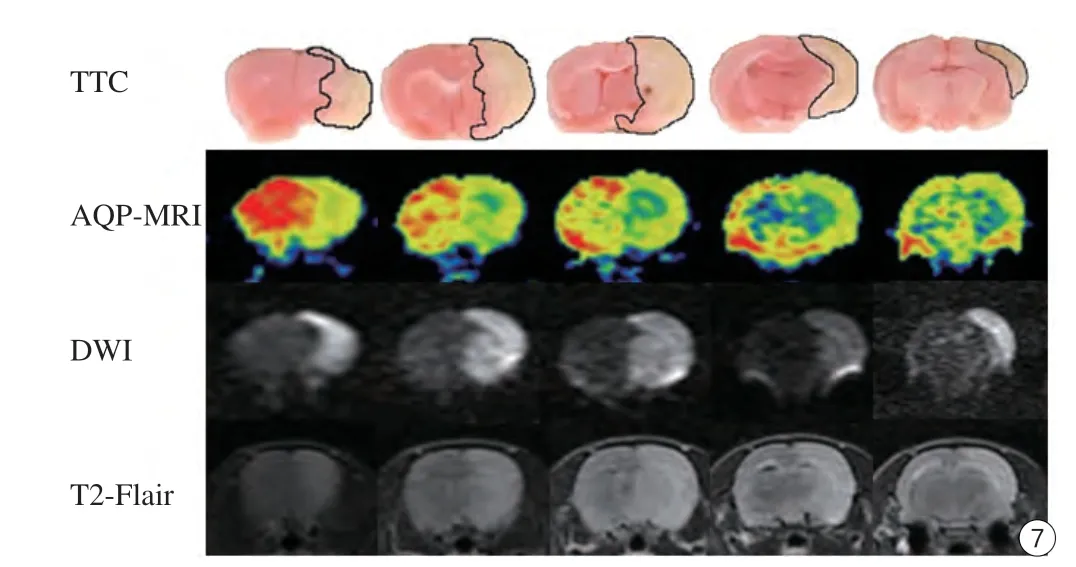
图7 取栓后24 h,TTC染色显示的梗死面积与MRI结果对照Fig. 7 Comparison TTC staining with MR imagings of infarct size in 24 h after stroke.
3 讨论
缺血性脑卒中致残、致死率极高,严重危害人类健康。近年来,脑卒中死亡率有所下降,但发病率仍在上升[8]。对缺血性脑卒中成像以便临床采取适合的治疗措施,特别是早期识别缺血半暗带对于筛选适合的患者行血管内取栓治疗是近年来关注的焦点[9]。多b值DWI-MR水通道蛋白分子成像技术是近年来新兴的MR分子成像技术,是在DWI基础上引入连续的、多个不同梯度b值获得反映水分子在组织细胞中不同扩散运动的分子谱[10],b值越高,检测的对象越接近AQPs内转运的水分子。本研究采用从30~4500 s/mm2共18个b值,后处理选用2000 s/mm2以上6个高b值拟合得到的AQP-ADC值,b值越高,MR检测的对象越接近AQPs内转运的水分子微观信息。
3.1 AQP-MRI对脑梗死病灶的可视化成像
本实验再灌注24 h,DWI及T2-FLAIR患侧均呈大面积高信号,肉眼看不出有信号的差别,因为灰白质缺乏对比,但皮层与基底节区统计结果却存在差异(P<0.05和P<0.001)。AQP-MRI可清晰显示皮层和基底节区信号差异(P<0.01),这一差异具有可视化优点。AQP-MRI后处理伪彩图不仅可显示病变范围,还可以快速判断组织的损伤程度和大致解剖部位,并可通过AQP-ADC值的测量来定量验证,比T2-FLAIR、DWI更能反映缺血组织的实际生理情况而更具优越性。以往对缺血性脑卒中,特别是缺血半暗带的研究在很大程度上忽略了神经解剖位置对预后的重要影响。常规的DWI序列对于脑灰白质缺乏对比,而AQPMRI可以区分解剖部位,解剖定位可能在帮助进一步细化缺血半暗带和改善功能结局方面发挥作用[11]。在MCAo中梗死风险最高的区域是纹状体区[12],由于侧枝血液供应不足,这一区域通常在MCAo中首先受到损害[13]。本研究观察结果与以往文献报道一致,即MCAo后首先出现的病灶都在基底节纹状体区,随时间的延长,范围逐渐扩大至皮层,并且纹状体区AQP-ADC值降低幅度相对其他部位是最明显的。

图8 取栓后24 h,AQP-MRI、DWI及T2-FLAIR测量的梗死面积与TTC染色显示的梗死面积相关性分析散点图Fig. 8 Correlation analysis scatter plot of AQP-MRI, DWI, T2-FLAIR with TTC staining of infarct size in 24 h after stroke.
3.2 脑缺血早期,AQP-MRI对缺血半暗带的显示较DWI序列更具敏感性
缺血半暗带最早由Astrup通过对狒狒的研究于1981年明确定义的,后来有学者将它定义为如果不能在有效时间窗内改善脑血流灌注就可能发展为梗死的可逆性损伤区[14]。本研究把AQP-ADC值降低区域与T2-FLAIR高信号不匹配的区域近似地认为是缺血半暗带,并命名为“水通道蛋白分子半暗带”。结果显示在24 h内,AQP/T2-FLAIR不匹配面积与DWI/T2-FLAIR不匹配面积之间差异显著(P<0.01),面积图显示前者比后者显示的面积大。AQP-MRI是在双指数模型的基础上成像的,比DWI单指数模型能更好地反映生物体内复杂的信号衰减[15],b值越高,MR检测的对象越接近AQPs内转运的水分子微观信息。AQP-MRI伪彩图显示病灶内的色带跨度大,较DWI序列有层次,测量不同色带的AQP-ADC值,能体现出值的差异,而不论是DWI序列还是T2-FLAIR序列都无法实现这一可视化特点。AQP-MRI作为半暗带外边界,能可视化观察脑梗死外带区域的AQP-ADC值变化,而DWI则是综合的表现。特别是在脑缺血早期,AQP-MRI对缺血半暗带的显示较DWI序列更具敏感性。
3.3 AQP-MRI可视化显示半暗带外周AQP-ADC值较对侧相同区域增高
本研究观察到再灌注24 h,病灶几乎累及大脑皮层,24 h以内存在缺血半暗带,在1、3、6 h时间点,AQP-MRI显示半暗带周围正常脑实质可检测到AQPADC值较对侧相同区域增高(P<0.05)。笔者推测这与再灌注后侧枝血流的形成有一定关联。半暗带的演变取决于半暗带的位置、卒中发生的时间、侧枝循环、再灌注及灰质与白质间梗死阈值的变化[16]。早在1953年,Vander Eecken 和Adams等解剖学家就强调了侧枝循环在脑缺血病程中的重要性,指出动脉闭塞后,侧枝血流将动态地补充血供到缺血半暗带区以维持血流灌注。在脑卒中进展过程中,梗死周围区脑血流恢复和葡萄糖利用情况明显优于梗死核心区[11]。
3.4 AQP-MRI与TTC测量的脑梗死面积的相关性分析
本研究取栓后24 h,TTC染色显示梗死面积与MRI检查结果一致。TTC显示梗死面积与AQP-MRI、DWI、T2-FLAIR测量梗死面积均无显著性差异(P>0.05),且两者间均有显著相关性(r=0.903、0.935、0.872)。TTC染色被认为是标记脑梗死面积的可靠方法[17]。本实验TTC用来表示脑组织存活力。在缺血性脑卒中早期,由于脑组织的脆性,TTC染色不能清晰地显示脑梗死[18]。因此,本研究采用再灌注24 h后标本行TTC染色,与MRI结果对照。T2-FLAIR、DWI显示的脑梗死体积与组织学相关性已是毋庸置疑,T2-FLAIR高信号提示组织已发生坏死[19],DWI异常信号区与动物脑卒中模型病理证实的脑梗死灶的部位和体积密切相关[20]。本研究结果与此前研究相一致,此外,本研究结果还显示AQP-MRI与TTC染色结果也具有显著相关性(r=0.903),这说明AQP-MRI同DWI、T2-FLAIR序列一样,可以反映脑梗死的组织存活能力。
本研究存在的不足:采用的动物模型为短暂性脑缺血模型,尚不能完全模拟人类脑卒中。虽然采用统一的建模标准,但由于存在个体差异,结果存在一定的偏倚。1 h以内的超急性期AQP-MRI变化无法观察到。AQP-MRI可视化成像展示的微观信息,其病理生理机制需进一步深入研究。
综上,本研究观察到大鼠MCAo后,应用AQPMRI技术可以直观显示梗死病灶的空间分布、病变范围及严重程度,并可视化病变内部微观信息;特别在脑缺血早期,AQP-MRI对缺血半暗带的显示较DWI序列更具敏感性;半暗带周围的AQP-ADC值可能从侧面反映侧枝循环的情况。因此,AQP-MRI作为一种全新的可视化分子成像技术,可多层次、多角度实时动态评价缺血性脑卒中,为个体化诊疗提供了坚实保障,在脑卒中诊断领域中具有广阔的应用前景。
利益冲突:无。

