氮对巨菌草内生固氮菌Klebsiella variicola GN02 nifH基因表达的影响
林标声, 吕正阳, 罗茂春, 何玉琴, 林占熺
(1.龙岩学院生命科学学院 福建 龙岩 364012;2.福建农林大学生命科学学院 福建 福州 350002; 3.国家菌草工程技术研究中心,福建 福州 350002)
nifH基因是固氮微生物中最保守的功能基因之一,是许多固氮微生物的主要固氮基因;作为编码固氮酶的结构基因,nifH基因在生物固氮过程中发挥着重要作用[1].nifH基因在不同微生物菌株中广泛存在,如克雷伯氏菌属(Klebsiella)[2]、芽孢杆菌属(Bacillus)[3]的细菌,是学者研究微生物固氮功能基因的主要对象,常用于研究不同类型来源固氮微生物的系统发育和多样性[4].
氮元素是构成生命体的最重要基本成分之一,是影响植物生长发育的重要影响因子.生物固氮是许多植物获得氮素的重要途径,其经济、无污染,是近年来农业生物技术领域研究的热点[5].一些禾本科植物的内生固氮菌可以为植物提供超过60%的氮素,但其固氮效率与植物所处的氮水平具有一定的关联性,如有些基因会随着植物土壤环境中氮的输入而发生固氮水平的变化[6].因此,了解这些内生固氮菌主要固氮基因nifH在不同氮水平条件下的差异表达,对认识植物响应不同土壤氮源环境条件下的分子调控机制具有十分重要的意义[7].
实时荧光定量PCR技术(real-time quantitative reverse transcription PCR, qRT-PCR)效率高、灵敏度高、定量准确,近年来广泛应用在基因表达分析领域[8].蛋白质印迹(Western blot)是一种在凝胶电泳和固相免疫测定技术基础上发展起来的免疫生化技术,其根据抗原抗体的特异性结合,可对目的蛋白进行定性和半定量分析,是蛋白组学领域的一项关键技术[9].Western blot技术与实时荧光定量PCR技术的联合使用常用于特定目的基因的表达与分析,是近年来研究应用的热点技术[10-11].
巨菌草(Pennisetumgiganteum)为多年生禾本科牧草,隶属于狼尾草属,根系发达,抗旱性极强,具有较强的防风固沙的生态治理功能,是一种具有良好应用潜力的能源草、生态草[12].本实验室前期通过对巨菌草内生固氮菌群的高通量测序分析,已探明巨菌草种植成熟期的根部具有丰富的内生固氮菌群,其种类及丰度均超过了其他时期的茎部和叶部,是重要的内生固氮菌群分离资源[13],现已从中分离得到一株具有较强固氮能力、促生性能的菌株GN02,经鉴定为变栖克雷伯氏菌(KlebsiellavariicolaRosenblueth).本试验采用qRT-PCR技术及Western blot技术研究氮源对巨菌草内生固氮菌K.variicolaGN02nifH基因表达的影响,可为进一步探究巨菌草及其他禾本科植物内生固氮菌固氮酶基因的分子结构、固氮酶变化及在不同氮条件下的分子调控、氮代谢及与作物互作的机制等研究提供理论基础.
1 材料与方法
1.1 菌株和培养基
菌株K.variicolaGN02为本实验室前期从巨菌草成熟期根部分离出的一类菌株,经菌落形态分析、基因组测序和促生性能鉴定后认定为K.variicolaGN02,现保管于中国普通微生物菌种保藏管理中心(保藏编号CGMCC 1.13619);Ashby无氮培养基成分如下:甘露醇10 g·L-1,KH2PO40.2 g·L-1,MgSO4·7H2O 0.2 g·L-1,NaCl 0.2 g·L-1,CaSO4·2H2O 0.1 g·L-1,CaCO35.0 g·L-1,pH值7.0~7.2;LB液体培养基干粉购自北京索莱宝科技有限公司,按说明书配置.
1.2 主要试剂
细菌DNA提取试剂盒(Q5822)购自天根生化科技(北京)有限公司,细菌RNA提取试剂盒(R101-01)和RNA反转录试剂盒(AH101-02)购自北京全式金生物技术有限公司,各DNA marker、限制性内切酶、RNA提取及反转录试剂、各限制性内切酶、Tag酶均购自宝生物工程(大连)有限公司,其他试剂均为国产分析纯,引物由铂尚生物技术(上海)有限公司合成.细菌总蛋白提取试剂盒(C600596)购自生工生物工程(上海)股份有限公司,一抗AS01-021鸡抗固氮酶(nifH)多克隆抗体购自艾美捷科技(武汉)有限公司,二抗辣根过氧化物酶标记山羊抗兔Ig(HS131-01)购自北京全式金生物技术有限公司,BCA蛋测定试剂盒(PC0020)购自北京索莱宝科技有限公司.
1.3 不同氮源条件下的菌株培养
将保存的GN02菌株分别培养于Ashby无氮液体培养基和LB含氮液体培养基中,培养至对数生长期;取菌液,4 000 r·min-1离心得菌体.无氮培养基和含氮培养基样品各取3组,共6个样品.
1.4 nifH基因的克隆及同源进化分析
取6个培养的GN02菌株样本提取DNA,根据细菌DNA提取试剂盒说明操作,参考文献[2]设计nifH基因扩增的核苷酸序列引物,其中F:5′-TTATACTACAGGAGCTTCAG-3′,R:5′-ATGACAGACGAAAACATTAG-3′.PCR反应总体系20 μL,其中核糖核酸酶游离水6.4 μL、DNA模板1.2 μL、Primer F(10 μmoL·L-1) 1.2 μL、Primer R(10 μmoL·L-1)1.2 μL、2×Taq dye PCR master mix 10.0 μL.PCR程序为:94 ℃ 8 min,94 ℃1 min,60 ℃ 1 min,72 ℃ 90 s,35个循环后72 ℃延伸10 min.琼脂糖凝胶电泳检测扩增产物片段大小,经凝胶回收纯化后送至铂尚生物技术(上海)有限公司进行测序.将测序的结果在NCBI登录,并进行BLAST比对.采用MEGA6软件邻接法(NJ法)构建nifH基因同源进化树.
1.5 总RNA提取及cDNA的合成
取6个培养的GN02菌株样本提取总RNA,按细菌RNA提取试剂盒说明操作,1.2%琼脂糖凝胶电泳检测提取样本的完整性,紫外分光光度计测定其浓度和D260nm/D280nm.
各样品的总RNA经检测合格并定量后,各取2.5 μg用于反转录成cDNA,具体操作参考提取试剂盒说明.反转录总体系20 μL,其中RNA 5.0 μL、3′端引物 2.0 μL、10 mmoL·L-1DNTP 1.0 μL、10×TS Ⅱ RT Buffer 2.0 μL、 核糖核酸酶抑制剂0.5 μL、TransScript Ⅱ RT 1.0 μL、核糖核酸酶游离水8.5 μL.将无氮培养基和含氮培养基样品各取一个反转录产物作为模板,参考文献[14]设计16S及nifH两对引物分别做PCR.引物序列分别为:16S-F:5′-AGGAAGGTGGGGATGACGTC-3′、16S-R:5′-CTAGCGATTCCGACTTCATGC-3′,nifH-F:5′-TTATACTACAGGAGCTTCAG-3′、nifH-R:5′-ATGACAGACGAAAACATTAG-3′.
PCR反应总体系30 μL,其中pfu Tag mix 15.0 μL、Primer F(10 μmoL·L-1)1.5 μL、Primer R(10 μmoL·L-1)1.5 μL、ddH2O 11.0 μL、DNA模板1.0 μL.PCR程序为:94 ℃120 s,94 ℃ 30 s,58 ℃ 20 s,72 ℃ 20 s,33个循环后72 ℃延伸300 s.PCR结束后,琼脂糖凝胶电泳检测扩增产物片段大小.
1.6 nifH基因的qRT-PCR分析
将6个样品cDNA合成产物作为模板,再用16S及nifH两对引物分别做qRT-PCR,按上述的PCR反应体系和程序进行,试验重复3次.溶解曲线的分析参考仪器说明:65 ℃上升至95 ℃,每个梯度0.5 ℃,保温10 s,自动采集荧光.基因表达量以相对荧光单位(relative fluorescence unit, RFU)表示.溶解曲线中荧光强度随温度的改变以RFU对温度进行一次求导的负数-d(RFU)/dT表示.
1.7 Western blot检测nifH蛋白的表达
根据细菌总蛋白提取试剂盒说明操作,将培养结束后的6个GN02菌株样本分别转移至1.5 mL EP管中,6 000 r·min-1离心1 min后收集菌体细胞;用预冷至4 ℃的PBS溶液洗涤2~3遍,去除洗液后,轻微波动菌体,分散菌体细胞;将含菌体细胞的EP管放入碎冰中预冷,加入100 μL RIPA细胞裂解液,冰上裂解3 min,再于4 ℃ 12 000 r·min-1离心20 min;将离心后的上清液转至1.5 mL的EP管中,BCA法测定各样本的蛋白浓度,按李佳慧[10]等的方法进行Western blot检测,其中内参为nifH多克隆抗体、ECL显色液显色,用ChemiDoc MP成像仪系统(Bio-Rad, USA)观察;采用Quantiyone软件对所获得的Western blot条带进行灰度分析值计算,以目的蛋白灰度值/内参蛋白灰度值计算各样品的nifH蛋白相对表达量.
2 结果与分析
2.1 nifH基因的克隆及同源性分析
由图1可得,6个样本的GN02菌株扩增产物在880 bp左右,与预期的nifH基因片段长度一致,表明GN02菌株在无氮和含氮条件下均可扩增出nifH条带;回收纯化后克隆测序并通过NCBI-BLAST分析,结果显示该序列与Genbank多个物种的nifH基因序列高度相似,表明克隆得到的序列为的固氮细菌的nifH基因.将获得的序列提交NCBI,登录号为MK131264,经BLAST比对,NJ法构建GN02菌株的同源进化树,结果如图2所示.结果表明,巨菌草内生固氮菌K.variicolaGN02的nifH基因与甘蔗来源的nifH基因(CP009274.2KlebsiellavariicolStrain_DX120E)亲缘关系最近(ident 99.94%),可能是由于巨菌草和甘蔗均同属于禾本科属植物,其内生固氮菌的菌群组成、定殖部位及定殖方式更为接近,所以两者固氮基因也更为相近[9].
2.2 基因组总RNA提取
6个样品总提取的RNA浓度约为400 ng·μL-1,D260nm/D280nm均在2.0左右.由图3可得,各样本电泳条带清晰,23S RNA的亮度是16S RNA亮度的2倍,表明各样品总RNA提取质量较高,可用于后续的cDNA合成.两组样品的反转录产物经16S及nifH两对引物分别做PCR后的电泳图如图4所示,结果表明,所用两对引物均能在PCR中特异性扩增各样本的目的片段,可进行下一步的qRT-PCR分析.
2.3 氮对nifH基因的表达影响
GN02菌株nifH基因的qRT-PCR表达水平分析结果如图5~7所示,各样本扩增曲线平滑,扩增曲线CT值范围为14~26;各样本的16S引物扩增的溶解温度为87 ℃,nifH引物扩增的溶解温度为82 ℃;溶解曲线均为单一尖锐峰,表明各扩增产物单一、稳定、复性好,结果准确可靠,所得数据可用于下一步的分析.
图1 GN02菌株nifH基因PCR电泳图
Fig.1 PCR electrophoretogram of thenifH gene from strain GN02
图2 GN02菌株nifH基因系统发育树
Fig.2 Phylogenetic tree of thenifH gene from strain GN02
M:Marker DL2000;1~3 :无氮培养基的菌株培养样本; 4~6:含氮培养基的菌株培养样本.
图3 GN02菌株两类培养基上培养提取样本的RNA电泳图
Fig.3 Electrophoretogram of RNA extracted fromK.variicolaGN02 cultivated under different medium
M: Marker DL2000;1、3:16S引物扩增;2、4:nifH引物扩增.
图4 反转录产物经16S及nifH扩增的电泳图
Fig.4 Electrophoretogram of reverse transcription products amplified by 16S andnifH
图6 16S引物扩增的溶解曲线
Fig.6 Dissolution curve of the amplificated 16S primer
图7nifH引物扩增的溶解曲线
Fig.7 Dissolution curve of the amplificatednifH primer
根据扩增曲线,计算各样本16S引物扩增和nifH引物扩增的CT值,再根据CT值计算GN02菌株nifH基因的表达量,结果如表1所示.结果表明,在无氮培养基中,GN02菌株nifH基因的相对表达量为16S基因相对表达量的0.901 3倍,在含氮培养基中为0.054 4倍,说明nifH基因在无氮培养基中的表达显著高于在含氮培养基的表达量,且差异达到极显著水平(P<0.01).
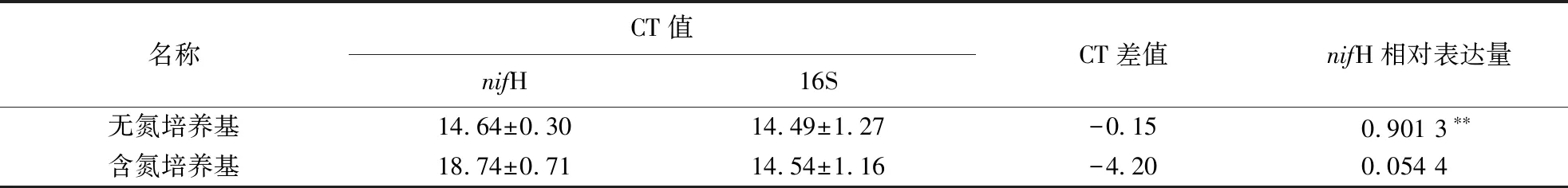
表1 两类氮水平培养基中nifH基因的表达分析1)Table 1 Expression analysis of nifH gene under media with divergent nitrogen contents
1)相对表达量=log2(CT差值), **表示差异极显著(P<0.01).
2.4 氮对nifH蛋白表达的影响
由图8可得,各样本nifH目的蛋白及内参基因的表达量稳定,nifH目的蛋白的相对表达量在无氮培养基中为3.28±0.15,显著高于含氮培养基中的表达量(P<0.05).nifH蛋白表达结果与其基因的表达结果一致.表明含氮条件下,nifH基因的表达确实受到了抑制.
3 讨论
迄今为止,nifH基因的固氮机制尚未清楚,其固氮酶活性的作用机理也有待进一步分析研究.许多研究表明,外界条件因素特别是环境中氮(铵)对固氮菌株的固氮酶活性或nifH基因的表达影响显著,如严君[15]等的研究表明,添加任何形式的氮肥均会抑制大豆根瘤菌的活性;Dedysh et al[16]的研究表明,嗜酸型甲烷营养细菌在有氧无氮培养基中生长活跃,nifH基因表达水平活跃.总之,氮(铵)对活体固氮微生物酶活性具有抑制作用,其抑制活性的大小与固氮菌株所处的各种内外在因素有关,如固氮菌株的类型、体内外的营养因素、菌株细胞膜受影响的程度等,至于这种抑制的机理、是否可逆、作用的时效性等还有待进一步探讨[17].
本试验表明,GN02菌株在无氮和含氮条件下培养均有nifH基因表达,克隆得到的nifH基因与同为禾本科植物甘蔗来源nifH基因亲缘关系较近;但在无氮培养条件下,其nifH基因及蛋白的表达量明显高于含氮条件下的表达量,且差异均达到显著水平(P<0.05).表明无氮条件能诱导GN02菌株nifH基因表达量的增加,而含氮源条件下nifH基因的表达受到抑制,与前人对其他禾本科植物固氮菌的研究结论一致;也因而验证了在农业生产中对含固氮菌的一些作物施肥时,过量的氮肥对固氮菌固氮酶活性有一定的抑制作用(如影响根瘤的形成及侵染),氮肥的施用应综合考虑、合理安排[18].

