不同冻结方式对金鲳鱼水分、组织结构与品质变化的影响
巩涛硕,蓝蔚青,2,,王 蒙,谢 晶,2,
(1.上海海洋大学食品学院,上海 201306;2.上海水产品加工及贮藏工程技术研究中心,上海冷链装备性能与节能评价专业技术服务平台,食品科学与工程国家级实验教学示范中心(上海海洋大学),上海 201306)
金鲳鱼(Trachinotus ovatus)又名卵形鲳鲹,属鯵科鲳鲹属海水养殖经济鱼类[1]。在我国广西、广东与海南等地分布较广,其肉质细嫩、味道鲜美,富含不饱和脂肪酸、必需氨基酸等多种营养成分,深受消费者喜爱[2]。然而,与其他水产品一样,金鲳鱼由于其鱼肉中含有较多水分与营养物质,导致微生物快速繁殖,易发生腐败变质。目前,水产品主要采用低温方式进行保藏,此法可使其货架期明显延长[3]。但传统冷冻处理方式会使水产品产生蛋白质变性、组织干耗与脂肪氧化等现象,解冻后又因汁液流失会降低其鲜味,影响口感,导致营养损失[4-5]。针对于此,国内外研究人员开展了液氮浸渍冻结、鼓风冻结与平板冻结(plate freezer,PF)等低温方式处理水产品的研究,如宋敏等[6]研究了液氮浸渍冻结、静止空气冻结与鼓风冻结等冻结处理对鮰鱼-18 ℃贮藏期间品质变化的影响。向迎春等[7]采用液氮、平板与冰柜冻结(ordinary freezer,OF)结合-20 ℃贮藏处理研究其对凡纳滨对虾品质变化的影响。而对螺旋式冻结与超低温冻结等不同冻结方式研究很少,且方法相对单一,因此研究不同冻结方式对金鲳鱼贮藏品质变化的影响具有重要的现实意义。本实验以金鲳鱼为原料,分别研究了PF、螺旋式冻结(spiral freezer,SF)、超低温冻结(cryogenic freezer,CF)与OF等方式,通过比较pH值、挥发性盐基氮(total volatile basis nitrogen,TVB-N)含量、质构特性、色泽、保水性(持水率、蒸煮损失率和汁液损失率)等指标的变化,并结合低场核磁共振(low-field nuclear magnetic resonance,LF-NMR)仪与光学显微镜,分别从宏观与微观角度分析不同冻结处理方式对金鲳鱼的水分、组织结构与品质变化的影响,以期为深入研究冻结方式对水产品品质影响提供理论依据。
1 材料与方法
1.1 材料与试剂
鲜活金鲳鱼购自上海芦潮港自发渔业合作社,选取大小均一的个体,样品质量为(500±50)g,体长为(30±5)cm,将其放在盛有水的聚乙烯泡沫箱中,30 min内运回实验室。
乙醇、苏木精、盐酸、戊二醛、轻质氧化镁、磷酸缓冲液、叔丁醇、伊红染液等购自国药集团化学试剂有限公司,且均为国产分析纯。
1.2 仪器与设备
PF-500型平板速冻机 南通星诺冷冻设备有限公司;LSSG120-1606型螺旋式速冻装置 烟台冰轮股份有限公司;CZLZ-5型超低温速冻冷藏装置 江苏兆胜空调有限公司;Kjeltec8400型凯氏定氮仪 丹麦FOSS集团(中国)有限公司;TA.XT Plus型质构仪 英国Stable Micro Systems公司;CR-400色彩色差计 日本柯尼卡美能达有限公司;H-2050R型台式高速低温离心机湖南湘仪实验室仪器开发有限公司;AUW320型分析天平 日本岛津公司;DHG-9053A型电热鼓风干燥箱上海一恒科学仪器有限公司;2640A网络型多点温度采集仪 美国福禄克电子仪器仪表公司;DS-5M型数码相机 日本Nikon公司;Meso MR23-060H-I型NMR分析及成像系统 上海纽迈电子科技有限公司;BX41型光学显微镜 日本Olympus光学仪器有限公司。
1.3 方法
1.3.1 原料处理
将鲜活金鲳鱼样品分别采用PF(温度-30 ℃)、SF(温度-35 ℃,风机频率40 Hz)、CF(温度-50 ℃,风机电机功率0.25 kW)与OF(温度-20 ℃)4 种方式进行冻结处理。
当鱼体中心温度≤-20 ℃时即结束冻结,取出样品后即置于-20 ℃冰箱中保存(24 h以内),在冻结过程中测定冻结曲线,以新鲜样品为对照组(CK),4 ℃冷藏解冻后测定相关理化指标测定。
1.3.2 冻结曲线
将多点温度采集仪插入样品中心位置,以其放入4 种冻结装置中为起始冻结时间点,对鱼体中心温度随冻结时间的变化进行记录。以冻结时间为横坐标、温度为纵坐标绘制4 种方式处理组金鲳鱼的冻结曲线。
1.3.3 pH值测定
pH值参考GB 5009.237—2016《食品安全国家标准食品pH值的测定》[8],利用pH计进行测定。准确称取不同冻结方式处理鱼样5 g,充分研磨捣碎,加入45 mL蒸馏水并混匀,静置30 min,将探头插入到肉样中,使电极与肌肉组织充分接触,待pH计读数稳定后记录,平行测定3 次。
1.3.4 TVB-N含量测定
根据GB 5009.228—2016《食品安全国家标准 食品中挥发性盐基氮的测定》[9]半微量定氮法,利用全自动凯氏定氮仪测定样品TVB-N含量,平行测定3 次。
1.3.5 质构分析
质构分析参考Tan Mingqian等[10]的方法,并稍作修改。从金鲳鱼背部肌肉中取20 mm×20 mm×10 mm大小的鱼块,吸除表面水分后,采用TPA模式对不同冻结处理样品的硬度、黏着性、弹性、咀嚼性与回复性进行测定,每个样品经历2 次压缩分析,测定条件为:探头型号为P/50平底柱状探头,测试前速率为3 mm/s,测试速率和测试后返回速率均为1 mm/s,二次压缩间隔时间5 s,压缩程度50%,弛豫时间5 s。平行测定6 次。
1.3.6 L*值测定
参考Xu Xianglian[11]和常海军[12]等的方法,采用色差计反射法测定样品的L*值,选择10 mm透镜,对6 个样品的外表面与正反两面进行测定。
1.3.7 持水率测定
持水率的测定参考Zheng Haibo等[13]的方法并稍作修改,称取(5.0±0.5)g鱼肉置于带滤纸筒的离心管中,4 ℃、5 000 r/min离心10 min后称质量,每组样品3 个平行。持水率的计算如公式(1)所示。

式中:m1为离心前鱼肉质量/g;m2为离心后鱼肉质量/g。
参考李婉竹等[14]的方法测定蒸煮损失率。准确称取20 mm×20 mm×30 mm肉样,装入蒸煮袋中封好,在恒温水浴中加热至肉样中心温度至75 ℃,取出冷却至室温。再用吸水纸吸干表面汁液后进行称量,每组样品3 个平行。蒸煮损失率的计算如公式(2)所示。
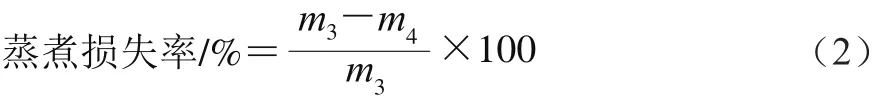
式中:m3为蒸煮前鱼肉质量/g;m4为蒸煮后鱼肉质量/g。
1.3.9 汁液损失率测定
汁液损失率的测定参考Utrera等[15]的方法,分别记录冻结前和冻结后除去表面水分后的质量。汁液损失率的计算如公式(3)所示。

式中:m5为冻结前鱼肉质量/g;m6为冻结后鱼肉质量/g。
1.3.10 LF-NMR测定水分分布
水分分布的测定参考Cao Minjie等[16]的方法,略作修改。将鱼肉切成2 mm×2 mm×1 mm大小的立方体。擦干样品表面水分,称质量,保鲜膜包裹后,将其放入核磁管中并置于LF-NMR分析仪中。该测试在100 kHz的共振频率下进行。重复扫描次数NS=4,回波个数EC=8 000,通过Carr-Purcell-Meiboom-Gill(CPMG)脉冲序列采集样品横向弛豫时间T2。两次连续扫描间的重复时间为3.5 s,脉冲间的τ值为150 μs。T2分布通过MultiExp Inv分析软件获得。
IMT(内中膜)大于等于1mm评定为IMT增厚;IMT局限性增厚大于等于1.5cm,突出管腔,评定为斑块形成。
CPMG测试后的样品进行多层面自旋回波脉冲序列成像测试,运用核磁成像分析(magnetic resonance imaging,MRI)成像软件及MSE多层自旋回波序列采集样品冠状面质子密度像。
1.3.11 光学显微镜观察
微观结构的测定参考Zhang Mingcheng等[17]的方法,略作修改。5 mm×5 mm×10 mm大小的冷冻样品在CM1850低温恒温器中切成与肌纤维取向垂直或平行的4 μm厚切片。随后,将切片置于载玻片上并在苏木精染色溶液中染色15 min,移至体积分数1%盐酸乙醇溶液中,使其色泽均匀。通过流动的自来水洗涤切片15 min,再用伊红染色10 min。然后将切片样品分别用体积分数70%、80%、90%和100%乙醇溶液依次梯度脱水,每次2 min。最后,将其放入二甲苯中脱色,置于树脂介质中。样品用装有数码相机的光学显微镜观察,冰晶直径采用Image-Pro Plus软件分析。
1.4 数据处理分析
数据为3 次平行实验的结果,以平均值±标准差表示,采用Origin Pro 8.5软件绘制曲线,采用SPSS 19.0中的Duncan新复极差法进行方差分析与多重比较。
2 结果与分析
2.1 不同冻结方式处理金鲳鱼的冻结曲线
速冻通过最大冰晶生成区域的时间与样品种类、个体大小、冻结温度与处理方式等密切相关。鱼类的冻结温度曲线可分为3 个阶段:第一阶段是鱼体温度迅速下降,降至冻结温度,放出的热量为显热;第二阶段为最大冰晶生成区域,曲线平缓,此时80%以上的水结成冰,放出潜热巨大,所需时间较长;第三阶段是从鱼肉冻结点温度冻结至规定终温。研究表明,样品冻结速率越快,其通过最大冰晶生成区域的时间越短,冰晶形成越细小,样品品质越好[18]。
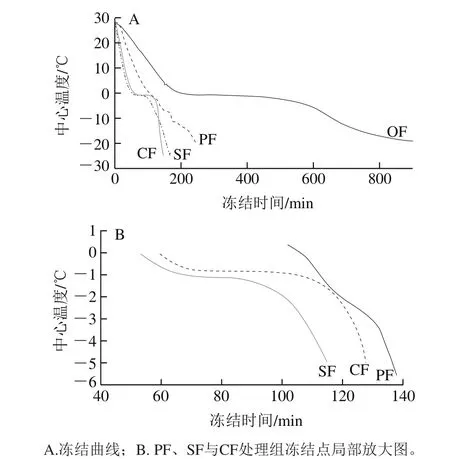
图1 不同冻结方式下金鲳鱼的冻结曲线Fig. 1 Freezing curves of Trachinotus ovatus using different freezing methods
从图1可见,CF与SF样品通过最大冰晶生成区域速率最快,其次是PF样品,OF处理样品的通过速率最慢。OF样品中心温度从室温降至-20 ℃的时间超过13 h,远长于其他3 种冻结方式。可见,与OF相比,采用PF、SF与CF可明显缩短样品的冻结时间,提高其冻结效率。
2.2 不同冻结方式对金鲳鱼pH值的影响

图2 不同冻结方式对金鲳鱼pH值的影响Fig. 2 Effects of different freezing methods on pH of Trachinotus ovatus
水产品在其僵直期结束后,在酶与腐败菌共同作用下,其蛋白质、氨基酸与含氮物质等会降解生成一些氨、胺类碱性物质,使其pH值升高[19]。如图2所示,对照组样品的初始pH值为6.49±0.07,样品经不同冻结方式处理后,所有冻结处理组样品的pH值均较对照组有所升高,以OF组样品上升最快,SF组样品上升最缓,CF样品组的pH值较PF和OF样品低。可能由于金鲳鱼经冻结处理后,其蛋白质变性,细胞部分破裂,使内容物外流,部分碱性氨基酸基团暴露,中和其中的酸性基团,导致样品的pH值升高[20]。
2.3 不同冻结方式对金鲳鱼TVB-N含量的影响
TVB-N含量对鱼类鲜度评价具有重要指导作用,其是判断样品腐败的标准之一。根据SC/T 3103-2010《鲜、冻鲳鱼》[21]规定:TVB-N含量<18 mg/100 g为一级鲜度,18 mg/100 g≤TVB-N含量<30 mg/100 g为二级鲜度。当TVB-N含量超过二级鲜度时,一般认为不可食用。鱼肉的TVB-N含量越高,则代表鱼肉腐败越严重[22]。

图3 不同冻结方式对金鲳鱼TVB-N含量的影响Fig. 3 Effects of different freezing methods on TVB-N content of Trachinotus ovatus
如图3所示,对照组样品的TVB-N含量为(11.89±0.56)mg/100 g。与对照组相比,不同冻结处理组样品的TVB-N含量均有所上升。与其他速冻方式相比,SF组样品的TVB-N含量最低,其次是CF组,可能由于速冻速率相对较快,对鱼肉肌肉组织影响小,且SF组和CF组样品中的微生物尚未适应低温环境,使样品中的微生物生长得到一定抑制[23],可见SF和CF处理能较好抑制金鲳鱼TVB-N含量的升高。
2.4 不同冻结方式对金鲳鱼质构特性的影响
水产品死后会发生自溶现象,鱼肉在微生物和酶的作用下,肌肉变得柔软,质构发生改变,弹性更小[24]。样品在冻藏过程中,由于鱼肉中水的重新分布与肌纤维蛋白的变性,其质构也会发生相应变化,最终导致其品质劣变[25]。因此,质构特性可作为反映水产品品质变化的重要指标,用于表征肌肉品质变化。
由表1可知,不同冻结方式处理的金鲳鱼弹性无显著差异,其中以OF组样品的黏着性更高。可能由于OF组样品内应力升高引起鱼肉组织间隙或薄弱部位断裂,形成低温断裂,使其蛋白质二级结构受到破坏,导致细胞间的结合力降低[26]。不同冻结方式处理样品的咀嚼性与硬度由高至低均为:SF>CF>PF>OF,回复性由高至低为:SF>CF>OF>PF,这与廖媛媛等[26]的研究结果一致。结果表明,SF组和CF组快速冻结鱼肉在抵抗硬物压入或在受压状态下快速回复变形方面更接近CK组新鲜样品。

表1 不同冻结方式对金鲳鱼质构特性的影响Table 1 Effects of different freezing methods on texture of Trachinotus ovatus
2.5 不同冻结方式对金鲳鱼保水性的影响
保水性是衡量食品品质变化的重要指标,对其食用与感官品质都会有直接影响[27]。鱼肉在冻结再解冻过程中由于冰晶的形成,解冻后肌肉细胞膜和细胞器会受到损伤,其自由水含量增多,由细胞内向细胞外扩散,水分流失增大,导致其持水能力降低。由表2可以看出,SF、PF、CF和OF组样品的持水率依次降低,CF、SF、PF和OF组样品汁液损失率依次上升;而蒸煮损失率OF组最高,但与其他组无显著性差异。综上所述,OF组样品的持水力降低最明显,可能其冻结速率最慢,冰晶大对样品组织破坏显著所致,该结果与胡亚芹等[4]的研究结果类似。

表2 不同冻结方式对金鲳鱼保水性的影响Table 2 Effects of different freezing methods on water retention capacity of Trachinotus ovatus
2.6 不同冻结方式对金鲳鱼色泽的影响

图4 不同冻结方式对金鲳鱼色泽的影响Fig. 4 Effects of different freezing methods on color difference of Trachinotus ovatus
鱼肉的色泽是影响消费者是否愿意购买的重要因素,也是评价鱼肉品质的间接指标。由图4可知,不同冻结处理后的金鲳鱼L*值均比CK组高,表明各冻结组鱼肉的颜色更亮,可能是冻融后样品的肌球蛋白逐渐变性造成的[28],其中SF组与CK组的L*值最为接近,SF组和CF组L*值较其他两组低。
2.7 不同冻结处理组金鲳鱼的LF-NMR结果
LF-NMR技术中多以氢核(1H)为研究对象,弛豫是指1H核以非辐射的形式从高能态转变为低能态的过程,在肉与肉制品中用横向弛豫时间T2来表征水分状态。鱼肉中不同的水分状态根据其流动性强弱可分为结合水(T2b与T21)、不可流动水(T22)和自由水(T23)[29]。其中大分子结构中存在的水用T2b(<1 ms)表示,与大分子结合的水用T21(1~10 ms)表示,不可移动水用T22(30~100 ms)表示,自由水用T23(>100 ms)表示[30]。一般情况下,T2越大,表明水分流动性越强。

图5 不同冻结方式对金鲳鱼弛豫时间(T2)值变化的影响Fig. 5 Effect of different freezing methods on change in relaxation time (T2)value of Trachinotus ovatus
由图5可知,不同冻结处理样品的结合水含量均无明显差异,可见冻结处理对样品内部的结合水含量影响不明显,可能是由于冻结状态下水分子与大分子间结合较牢固,束缚作用较强[31]。同时,各处理组样品T22区间的积分面积所占总积分面积比A22相对于CK组均有所降低。冻结处理导致样品肌肉组织结构受到破坏,肌肉纤维保水性降低,不可流动水向自由水转化,自由水的比例增加,可能是由于速冻后肌原纤维蛋白分子空间结构发生改变,即高级构象发生改变,从而影响其与水分子的结合能力。SF处理组样品A22与CK组最为接近,说明SF处理对样品水分流失影响最小。
2.8 不同冻结方式金鲳鱼的水分分布
一般情况下,MRI图像中的亮度越强(由加权像转化的伪彩图越趋红色),即此部位的水质子信号越强,该部位的水分含量就越高。
由图6可发现,质子密度加权像的亮度由高到低依次为SF>CF>PF>OF。李侠等[32]研究发现,伪彩图中蓝色程度越高,其自由水含量越高。由图6可知,OF组样品蓝色趋势变化最明显,表明其自由水含量最高,水分流失严重。

图6 不同冻结方式金鲳鱼的MRI图Fig. 6 Effects of different freezing methods on pseudo color of 1H MRI of Trachinotus ovatus
2.9 不同冻结方式对样品微观组织结构的影响
鱼肉肌肉组织的微观结构变化可反映其品质,通常可采用光学显微镜直接观察样品肌肉微观结构的变化。由图7可知,CK组新鲜金鲳鱼肌肉表面结构排列紧密、间隙小。样品经冻结处理后,其肌肉表面结构变得疏松,肌纤维间隙逐渐增大,这与鲁珺等[33]的研究结果一致。样品在冻结过程中,其肌原纤维与内部结缔组织的降解使鱼肉的肌原纤维与肌节分离,肌原纤维间缝隙增大。而CF组与SF组样品的肌纤维间隙小,分散均匀,形成的冰晶较小,其次是PF组。而OF组样品组织中的间隙大,碎片数量多,可能由于该冻结方式形成的冰晶较大,对样品的机械损伤作用更明显,品质下降也最严重。

图7 不同冻结方式对金鲳鱼横断面微观结构变化的影响(×100)Fig. 7 Effects of different freezing methods on cross-sectional microstructure of Trachinotus ovatus (× 100)
3 结 论
样品经PF、SF与CF处理后,其pH值、TVB-N含量、质构特性(硬度、黏着性、弹性、咀嚼性)、色泽、保水性与肌肉组织微观结构均优于OF。其中,CF与SF组样品的pH值与TVB-N含量较PF和OF样品低;其质构、L*值与保水性的下降速率也缓于其余两组处理组样品。由LFNMR结果分析可知,冻结后样品的不可流动水向自由水转化,自由水的比例增加,速冻可在一定程度上减缓水分流失的速率,OF处理对样品水分流失影响最小。由肌肉组织的微观结构观察可知,CF组与SF组样品的肌原纤维间隙小、分散均匀,组织冰晶细小,样品的综合品质更好。综上所述,4 种冻结处理方式中,以SF处理的综合效果最佳,该研究结果能为后期金鲳鱼等水产品的速冻保藏提供理论参考。

