湿热处理和发酵对小米营养素生物可给性及淀粉消化性的影响
靳志强 陈艳彬 王 玺
(长治学院生物科学与技术系 山西长治 046011)
谷子(Setaria italica),也被称为印度粟,是一种最古老的栽培谷物,脱壳后称为小米[1]。小米含有多种维生素、矿物质和植物性化学成分,其中酚类和类胡萝卜素是最重要的抗氧化剂成分,因此小米被认为是一种潜在的功能食品。小米可制作为米饭、稀粥或磨制粉后制作面包、饼干、面条、蒸制食品、饮料或点心等,在我国最普遍和最简单的食用方式是小米粥[2]。
小米虽然具有很高的营养价值,但其中含有的植酸、酚类等抗营养因子可以阻碍营养物质的有效利用、吸收或消化,从而降低了营养物质的生物利用度。生物利用度是指消化后的化合物或营养物质可以通过胃肠道上皮细胞膜被吸收利用的量。植酸作为一种金属离子的螯合剂降低了矿物质的生物利用度,其主要存在于小米的麸质层。酚类由于在预防自由基引发的癌症、动脉硬化等疾病方面具有潜在的保健功能,所以其日益被人们所关注。食物中的大部分酚类化合物与各种生物大分子结合变得不可溶,这些不溶的酚类化合物在消化道内不能被吸收,使其难以发挥生物活性。此外,酚类-蛋白质复合物降低了蛋白质的溶解性和对蛋白水解的敏感性,可以作用于蛋白酶并抑制其活性。抗营养因子在谷物中呈不均匀分布,其含量可以通过脱壳和进一步的加工来降低[3]。发酵是粟类谷物加工最常用的方法之一,可进一步增加营养素含量和降低抗营养因子水平,而且会引起产品理化性质的改变[3]。例如,珍珠粟面团的自然发酵降低了多酚和植酸的含量,增加了蛋白质的消化率,而对单宁含量没有影响[4]。酸面团发酵可以降低烘焙制品的血糖反应,提高膳食纤维复合物和植物性化学成分的生物利用度,增加矿物质的吸收[5]。
流行病学研究表明,胆固醇代谢失调、2型糖尿病等慢性病风险的降低与小米及其产品消费的增加有相关关系[6]。为了促进小米的降糖特性,A-madou等[2]对小米粉进行湿热处理,显著提高了慢消化淀粉(SDS)和抗性淀粉(RS)的含量。湿热处理是将淀粉或谷物粉在温度高于糊化温度,水分含量低于35%状态下加热一定时间(15 min~16 h)的物理改性技术,可用于调节食品中淀粉的消化速率[7]。根据体外消化的速率和程度,淀粉可分为快消化淀粉(RDS)、SDS和RS。SDS具有控制糖尿病、产生饱腹感等健康益处。RS作为益生菌的生长基质在结肠内发酵,可降低大肠相关疾病的风险,有助于降低血糖和血脂。湿热处理引起淀粉颗粒的非结晶区或结晶区中结构性分子重排,改变了淀粉颗粒的溶胀性、结晶性、直链淀粉的沥出、胶凝化和糊化行为,从而影响淀粉颗粒对消化酶的敏感性[7]。目前,湿热处理相关文献大多数侧重于淀粉理化特性和可消化性的研究[8-9]。
本研究通过湿热处理和发酵方法研究其对小米中营养成分的生物利用度及淀粉消化性的影响。由于测量某一化合物真实的生物利用度是困难的,所以食品科学领域常通过生物可给性(bioaccessibility)来评价营养物潜在的生物利用度[10]。本研究将湿热处理的小米磨粉后制作面团,经过发酵或不发酵制备小米饼,并通过体外模拟胃、肠道消化研究湿热处理和发酵对小米饼中氨基酸、矿物质、多酚的生物可给性和淀粉消化性的影响,为营养健康的小米基食品的深加工提供理论借鉴。
1 材料与方法
1.1 试验材料
小米购自山西沁州黄小米集团,水分含量为12.4%;牛胆酸钠、福林酚试剂购自北京索莱宝科技有限公司;胰α-淀粉酶Sigma A3176、胃蛋白酶Sigma P6887、胰酶Sigma P1750、淀粉葡糖苷酶A7095、2,2-偶氮二 (2-甲基丙基咪) 二盐酸盐(AAPH)、水溶性维生素 E(Trolox)、荧光素钠(FL)购自Sigma-Aldrich公司;96孔黑色底部透明微孔板购自美国Corning公司;D-葡萄糖 [GOPOD法]检测试剂盒K-GLUC和总淀粉检测试剂盒KTSTA购自爱尔兰Megazyme公司;其它试剂均为国产分析纯。
1.2 试验仪器
ALPHA 1-2 LD plus冷冻干燥机,德国Christ公司;Optima 8000电感耦合等离子体发射光谱仪(ICP-OES),美国PE公司;L-8900全自动氨基酸分析仪,日本日立公司;SpectraMax M2多功能酶标仪,美国Molecular Devices公司;TU-1901双光束紫外可见分光光度计,北京普析通用仪器有限责任公司。
1.3 试验方法
1.3.1 湿热处理 参照Amadou等[2]的方法并略有修改。将适量的蒸馏水加入400 g小米样品中,装于三角瓶中密封并充分混匀,4℃下平衡过夜,使样品中的水分含量调节至约26%。将密封样品在干燥箱中加热至100℃,处理8 h,然后冷却至室温。
1.3.2 磨粉 将原小米和湿热处理的小米样品进行磨粉,并通过80目筛子。
1.3.3 面团和制与发酵 普通面团的制备。小米粉和湿热处理的小米粉分别和制面团。30 mL沸水缓慢加入50 g小米粉中混合搅拌2 min,面团静置待温度降至28℃后,将剩余的50 g小米粉、2.5 g盐、50 mL水加入,用手混合搅拌揉制成面团[11]。
发酵面团的制备。小米粉和湿热处理的小米粉分别和制面团并进行发酵。30 mL沸水缓慢加入50 g小米粉中混合搅拌2 min,面团静置待温度降至28℃后,将剩余的50 g小米粉、2 g干酵母、2.5 g盐、50 mL水加入,用手混合搅拌揉制成面团。将和好的面团用保鲜膜包好在35℃的恒温培养箱中静置发酵60 min。
1.3.4 小米饼制备 每种面团切分成4等份。每个小面团用擀面杖擀成厚3 mm、直径15 cm左右的面饼,然后在电饼铛中将薄饼熟化。将小米饼冷冻干燥,然后磨粉,置于-20℃下保存备用。
1.3.5 模拟体外消化 参照Chandrasekara等[12]的方法并略有修改。取1 g磨碎的小米饼粉,放入50 mL的三角瓶中。将15 mL去离子水加入到样品中,于37℃、100 r/min的水浴恒温振荡器中振荡培养10 min;样品温度达到37℃后,加入1 mL α-淀粉酶溶液(50 U/mL),孵育 5 min。
模拟胃消化阶段:加入4.5 mL 0.15 mol/L HCl,pH保持在2.5以下。加入5 mL胃蛋白酶溶液(1 mg/mL)和样品混合,继续孵育2 h。
模拟肠消化阶段:加入4 mL胆盐溶液(150 mg/mL),调节消化液pH至6.9,加入4 mL胰酶溶液(18.75 mg/mL),继续孵育3 h。所得消化液用于后续试验中氨基酸、矿物质、抗氧化物质和淀粉消化性的测定。
1.3.6 矿物质的测定 参照Xia等[13]的方法测定矿物质生物可给性。1 g小米饼粉溶解在6 mL 65%硝酸和2 mL 30%过氧化氢混合液中,130℃消解4 h。过滤残渣,滤液用去离子水稀释到10 mL,用ICP-OES法测定小米饼中钙、铁、锌等矿物质的含量。体外消化得到的消化液在4 400 g,4℃下离心30 min两次,合并上清液,收集消化液中的可溶性物质,用ICP-OES测定体外消化所释放的矿物质。矿物质的生物可给性表示为溶解百分率。溶解性(%)=A/B×100%,其中A表示体外消化所释放的矿物质,B表示相应小米饼中矿物质的含量。
1.3.7 游离氨基酸的测定 参照Xia等[13]的方法测定消化液中的游离氨基酸含量。体外消化得到的消化液4 400 g,4℃下离心30 min两次,合并上清液,加入等量的10%磺基水杨酸沉淀蛋白质,然后4℃下 10 500 g离心15 min。取 20 μL上清液注入全自动氨基酸分析仪进行测定。
1.3.8 总酚的提取与测定 总酚的提取。参照Chandrasekara等[12]的方法,消化前总酚的提取:将1 g的小米饼粉溶于33.5 mL的去离子水中,于37℃、100 r/min的水浴恒温振荡器中振荡孵育5 h 15 min。将提取液于4 400 g离心30 min,倒出上清液。沉淀中加入25 mL蒸馏水混合后再离心,合并上清液,再将上述上清液合并贮藏于-20℃,随后冷冻干燥48 h;模拟胃消化阶段和肠消化阶段样品总酚的提取:将模拟胃消化和肠消化分别得到的消化液,同上述步骤进行离心和冷冻干燥。
总酚的测定。采用Folin-Ciocalteu法[14]测定不同消化阶段小米饼样品的总酚含量。冻干物样品溶解于10 mL的去离子水中,取1 mL溶液到50 mL容量瓶中,加入30 mL去离子水和2.5 mL福林酚试剂混合,避光保存6 min,再加入7.5 mL 20%碳酸钠溶液,混合定容。上述溶液在25℃下避光放置2 h后,在760 nm波长下测定吸光值。配制不同溶度梯度的没食子酸标准品制作标准曲线。总酚含量以每g小米饼(干基)中所含没食子酸当量表示,简写为mg GAE/g DW。
1.3.9 抗氧化活性的测定 抗氧化活性采用氧自由基清除能力(ORAC)来表示,其测定参照Chandrasekara等[12]的方法并稍有改动。向96孔黑色荧光酶标板各微孔中分别加入20 μL不同浓度的抗氧化标准物质Trolox或按一定比例稀释的消化液,样品、标准品和试剂的溶解均以75 mmol/L磷酸钾缓冲液(pH 7.0)为工作液,对照孔中加入20 μL磷酸钾缓冲液;向每孔中加入200 μL 0.11 μmol/L的荧光物质FL作为探针,37℃孵育20 min;迅速向各孔中加入75 μL 63.4 mmol/L的自由基产生剂AAPH。启动多功能酶标仪,在37℃下以激发波长485 nm,发射波长538 nm连续测定各孔的荧光强度,每2 min测一次,总测定时间2 h。将消化液的自由基作用下荧光衰退曲线的延缓部分面积(Net AUC)代入 6.25,12.5,25,50和 100 μmol/L标准抗氧化物质Trolox的Net AUC与Trolox浓度所做标准曲线,得到各消化液的氧自由基清除能力ORAC值,以每g小米饼(干基)中所含Trolox当量表示,简写为μmol TE/g DW。
1.3.10 淀粉体外消化的测定 淀粉体外可消化性的测定参照Cornejo等[15]的方法并稍有改动。在1.3.5节的模拟肠消化阶段,于0,20,120 min分别吸取0.2 mL消化液与0.2 mL 96%的乙醇溶液混合使酶失活。然后,混合液在10 000 g,4℃下离心5 min。沉淀用0.2 mL 50%的乙醇溶液清洗2次,合并上清液。取100 μL上清液用 0.85 mL 0.1 mol/L pH 4.5乙酸钠缓冲盐溶液稀释,然后加入0.5 mL 淀粉葡糖苷酶(33 U/mL),在 37℃,85 r/min水浴摇床中孵育30 min。水解液在2 000 g离心10 min,上清液保留用于葡萄糖测定。
游离葡萄糖(Gf=G0)、消化葡萄糖(G20和 G120)含量用D-葡萄糖检测试剂盒K-GLUC测定。总淀粉(TS)用总淀粉检测试剂盒K-TSTA测定[16]。通过下列公式分别计算快消化淀粉、慢消化淀粉、抗性淀粉的含量。
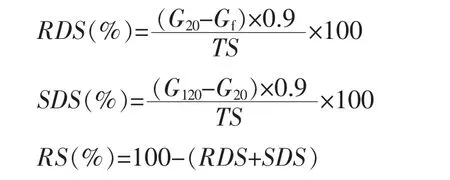
1.4 数据处理
采用SPSS19.0进行数据分析以及使用Origin 8.5绘图。
2 结果与分析
2.1 湿热与发酵对氨基酸生物可给性的影响
氨基酸是非常重要的功能性成分,尤其是必需氨基酸。食品加工技术可以影响氨基酸的生物可给性[13]。本文中氨基酸生物可给性是通过小米饼样品在体外消化过程中释放的游离氨基酸来衡量的,结果如表1所示。由表1可知,湿热处理增加了小米饼中必需氨基酸和总氨基酸的生物可给性(P>0.05)。植酸、缩合单宁和多酚与蛋白交互作用形成复合物,可降低蛋白的溶解性,从而影响蛋白酶对不稳定肽键的作用。湿热处理后氨基酸生物可给性的提高可能归因于上述抗营养因子的减少或去除,因此提高了蛋白质的消化率。Embaby[17]研究发现,煮制、高压蒸煮、微波蒸煮和烘烤可以显著降低花生中植酸、胰蛋白酶抑制剂、α-淀粉酶抑制剂、凝集素和单宁的含量,并提高了花生的蛋白消化率。此外,热处理也可能促进了蛋白(如球蛋白)的结构改变,因而增加了肽链的柔韧性和蛋白酶的可接近性[17]。不过也有研究表明,蒸煮和挤压处理降低了小米的蛋白消化率[18];加热处理使肉制品中蛋白质发生变性,从而降低了蛋白的消化率[19]。因此,热处理样品中氨基酸生物可给性的提高或降低,取决于受热材料与加热工艺的不同。
许多研究表明,发酵可以降低抗营养因子含量并提高蛋白质的消化率。例如,珍珠粟发酵显著降低了总酚和植酸含量,显著提高了蛋白的体外消化率[20];高粱粉自然发酵和乳酸菌发酵36 h使蛋白消化率分别提高了46.89%和92.08%[21];乳酸菌发酵降低了蚕豆粉中胰蛋白酶抑制剂活性和缩合单宁含量,从而提高了蛋白质的消化率[22]。然而,本文中发酵处理显著降低了小米饼中氨基酸的生物可给性(P<0.05)。Rui等[23]研究发现,与豆乳相比,植物乳杆菌发酵制备的豆奶凝乳在体外模拟胃肠道消化环境中阻碍了蛋白质的酶解,这与本文的研究结果相似。关于发酵降低氨基酸生物可给性的内在机理,有待进一步研究。
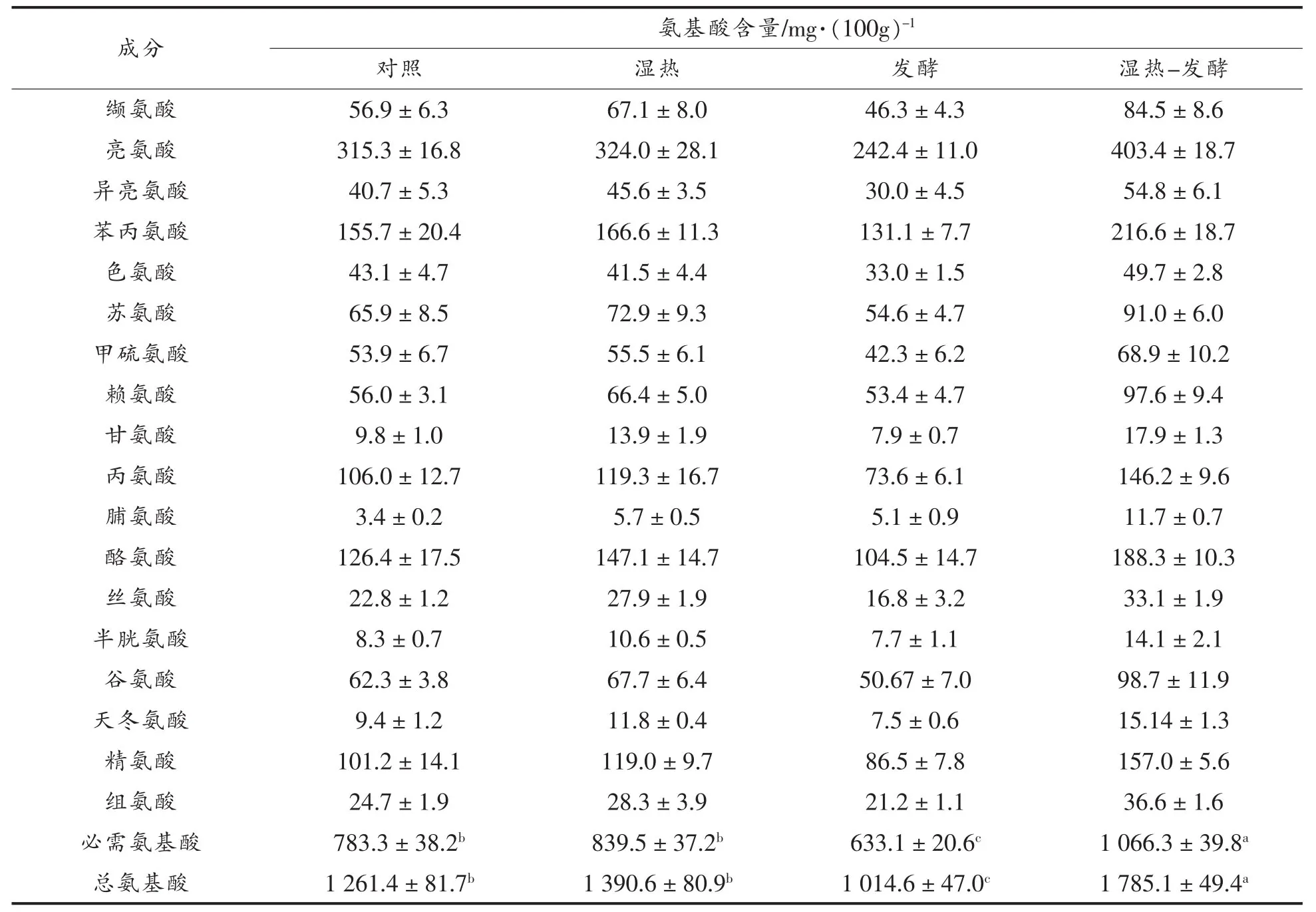
表1 湿热处理和发酵对小米在体外消化中释放氨基酸的影响Table1 Effects of heat-moisture treatment and fermentation on the release of different amino acids (AAs) from the treated foxtail millet samples during in vitro digestion process
此外,本文中一个有趣且有利的现象是,与湿热处理相比,湿热-发酵处理显著提高了小米饼的蛋白质消化率。也就是说,小米经过湿热预处理后,发酵提高了小米饼中氨基酸的生物可给性。湿热处理使小米粉的微观结构和理化特性发生改变[2],这些改变可能有利于后期发酵过程中蛋白的水解或者抗营养因子的减少,因而提高了氨基酸的含量。与对照相比,湿热-发酵样品使赖氨酸和总氨基酸的生物可给性分别提高74.4%和41.5%,这说明湿热-发酵处理在赖氨酸含量很低的小米的加工中具有积极的意义。
2.2 湿热与发酵对矿物质生物可给性的影响
矿物质与植酸、膳食纤维的结合会降低其生物可给性,而难消化的多糖则可以提高其生物可给性。矿物质生物可给性的抑制物和促进物在含量分布和结构特性方面因植物原料和加工技术的不同会发生很大的变化,因此有必要评估湿热处理和发酵后小米中矿物质的生物可给性[13]。4种样品中钙、铁、锌在消化过程中的释放量及其生物可给性如图1所示,生物可给性通过矿物质释放率来表示。由图1可知,钙含量为14.86~15.76 mg/100g,是小米样品经体外消化释放量最多的矿物质,湿热处理与发酵对钙的生物可给性无显著影响。4种样品虽然在消化过程中铁释放量高于锌,但铁的生物可给性低于锌,这说明矿物质的释放量并不能直接反映生物可给性。
图1b表明湿热处理显著降低了样品中铁的生物可给性,但显著增加了锌的生物可给性。热处理对不同矿物质的生物可给性表现出的影响差异,可能是由于矿物质和抗营养因子在食物中的亚细胞分布不同,也可能是由于矿物质在氧化还原态上的差异[24]。热处理通常对抗营养因子的影响相当有限,抗营养因子的减少不足以对矿物质生物可给性产生严重影响[24]。Menezes等[19]通过傅里叶红外光谱表明加热引起肉制品蛋白变性等物理改变可能是矿物质生物可给性降低的原因。
由图1b可知,发酵显著提高了小米饼中铁和锌的生物可给性。植酸、酚类化合物和缩合单宁等矿物质螯合剂影响矿物质的生物利用度。发酵过程中可以产生微生物植酸酶,基质pH值的下降则可以激活内源植酸酶的活性,植酸酶将植酸降解为低磷酸肌醇,从而可提高矿物质的生物利用度[24]。不过小米的内源植酸酶活性较低[25],因此本文中铁和锌生物可给性的提高可能主要取决于微生物植酸酶的产生。
此外,与对照相比,湿热-发酵处理没有引起钙锌生物可给性的显著改变(P>0.05),但铁的生物可给性出现了下降(P<0.05)。传统的发酵由于诸多参数的可变性,使其具有高度不可预测性,Gabaza等[26]在制备龙爪稷(finger millet)酸粥过程中发现发酵意外地升高了米浆中的植酸含量。因此,尚需优化发酵条件,以发挥发酵在提高矿物质生物利用度方面的有利影响。
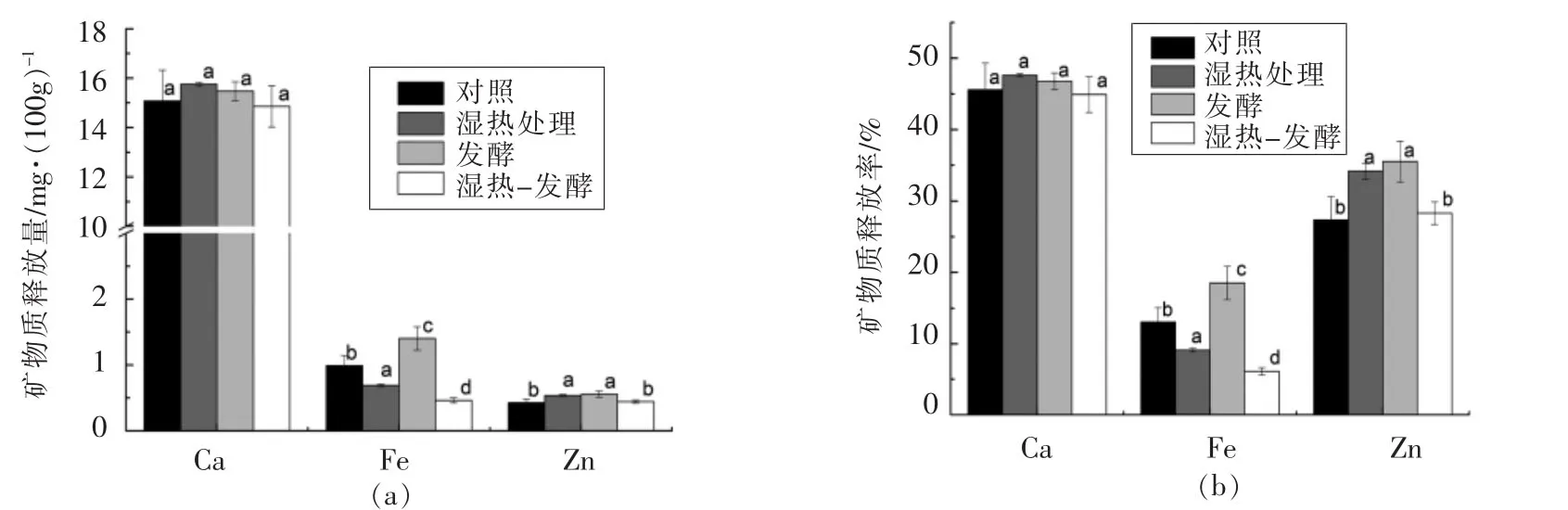
图1 湿热处理和发酵对小米在体外消化中释放矿物质的影响Fig.1 Effects of heat-moisture treatment and fermentation on the release of mineral elements from the treated foxtail millet samples during in vitro digestion process
2.3 湿热与发酵对酚类生物可给性的影响
4种小米饼通过体外消化所测得的总酚含量如图2所示。从图2可看出,与消化前相比,4种小米饼的总酚含量在胃消化后显著升高,而且在肠消化后进一步增强,总酚含量是消化前的19~22倍,这与前人的研究结果一致。Chandrasekara等[12]报道,煮制的小米经过胃肠消化后,总酚含量升高13.6倍。许多谷物中的酚类化合物属于羟基肉桂酸,这些酚酸大多数相对稳定,与细胞壁中的复合大分子共价结合形成了不可溶的结合态酚类[27]。这些不可溶的酚酸在胃肠消化过程中被水解酶所释放,导致总酚含量的升高[12]。
另外,4种小米饼消化前总酚含量的排序为:发酵>湿热+发酵>对照>湿热,其中发酵和湿热处理相比差异显著。湿热处理降低了酚类物质的含量(P>0.05),这与 Leenhadt等[28]研究烘烤对酚类的影响结果相似。发酵样品具有最高的酚类含量,这可能是因为面团和制过程中加入的水分会激活谷物粉中氧化酶和过氧化物酶的活性可使酚含量降低,但发酵过程中酵母菌消耗氧气阻止氧化酶的氧化,减弱酚类物质的降低,从而增加了酚类的可提取量[29]。此外,食物中的大部分酚类与蛋白质、纤维素等生物大分子结合变得不可溶,发酵过程中微生物产生的水解酶可能释放了复合物中的酚类,这也可以部分解释发酵样品酚类升高的现象[10]。湿热+发酵样品的酚类含量居中,则可能是发酵弥补了湿热处理过程中酚类热损失的缘故。
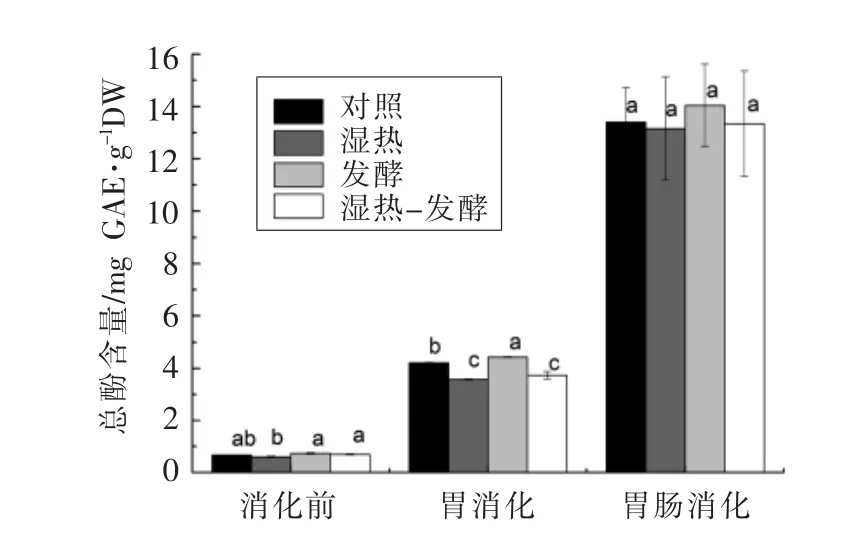
图2 湿热处理和发酵对小米在体外消化中释放酚类的影响Fig.2 Effects of heat-moisture treatment and fermentation on the release of phenolic compounds from the treated foxtail millet samples during in vitro digestion process
在胃消化阶段,发酵样品的总酚含量显著高于对照,而湿热样品和湿热-发酵样品的总酚含量显著低于对照;在肠消化阶段,4种样品酚含量变得无显著差异。不同消化阶段总酚含量的差异与消化酶密切相关,胃消化阶段主要是胃蛋白酶释放与蛋白质结合的酚类,而肠消化阶段中胰酶含有淀粉酶、脂肪酶和蛋白酶等,可以释放不同聚合物中的酚类[10]。发酵样品酚类的生物可给性具有最高值,这与Huang等[10]研究发酵对青刺果中总酚影响的结果一致,其内在机制可能归因于微生物产生的各种水解酶软化和分解谷物的细胞壁基质,使其中的结合态酚类在消化过程中更易被酶所催化[10]。
2.4 湿热与发酵对体外消化过程中抗氧化活性的影响
4种小米样品通过体外消化所测得的抗氧化活性见图3。从图3可看出,消化前,各处理的氧自由基清除能力(ORAC)与对照无显著差异;胃消化阶段,4种样品的ORAC较消化前有很大提高,发酵样品显著高于对照,湿热处理样品与湿热-发酵样品较对照显著降低;肠消化阶段,4种样品的ORAC较胃消化阶段进一步显著增强,湿热-发酵样品表现出最高的抗氧化活性。本文中不同样品酚类物质含量的变化与这些样品在ORAC试验中表现出的抗氧化活性非常相似,通过 Pearson相关性分析,发现不同样品的总酚含量与ORAC活性呈正相关(r=0.993),这表明不同样品中的酚类化合物可能对抗氧化活性发挥了主导作用,这与部分研究者的试验报道结果相一致[10,30]。
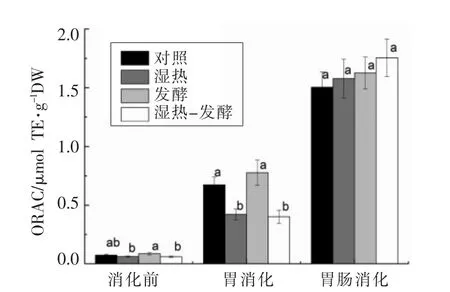
图3 湿热处理和发酵对小米在体外消化中抗氧化活性的影响Fig.3 Effects of heat-moisture treatment and fermentation on antioxidant activity of the treated foxtail millet samples during in vitro digestion process
人体内过量的自由基,尤其是活性氧自由基,可以攻击低密度脂蛋白胆固醇 (LDL-胆固醇)、DNA或蛋白,导致心血管疾病、癌症或其它疾病的发生。酚类化合物可以有效清除不同类型的自由基,防止机体的氧化损伤。已有研究表明,小米的酚类提取物可以显著猝灭单线态氧,抑制脂质过氧化、DNA断裂和细胞增殖[30]。此外,发酵、γ射线照射诱导等预处理方法可以显著增加植物原料中的总酚含量,从而增加自由基的清除能力[10,31]。本文中湿热处理和发酵虽然没有显著提高小米的酚含量,但它们在胃肠消化过程中使大量的结合酚变为游离酚,表现出良好的活性氧自由基清除能力,因此可能会提高保护LDL-胆固醇和DNA免遭氧化损伤的能力,这还需进一步的试验予以验证。
2.5 湿热与发酵对淀粉体外消化性的影响
湿热处理和发酵对小米淀粉消化性的影响如表2所示。与对照相比,湿热处理显著降低了样品中RDS含量和增加了SDS与RS含量。湿热处理通常可以提高晶体结构的精美程度,使直链淀粉在冷却过程中回生,并在非结晶区形成物理交联。上述结构改变使淀粉颗粒和分子固定化,从而降低了对消化酶的敏感性[32]。另外,湿热处理引起淀粉颗粒团聚和蛋白变性,变性蛋白分散粘附在淀粉颗粒团块的表面,阻止了淀粉酶的接近从而降低了淀粉的可消化性[8]。湿热处理后RDS含量的降低和SDS和RS含量的增加证实了淀粉可消化性的降低。
与对照相比,发酵样品的SDS含量从20.1%显著增加到26.2%,但RDS和RS的变化并不显著。Coda等[33]发现,发酵可以显著降低蚕豆粉中淀粉的水解指数,认为发酵使蚕豆粉中的蛋白和淀粉更为紧密的相互作用降低了淀粉的可消化性,这可以部分解释本文中小米发酵样品淀粉可消化性降低的现象,因为该样品中蛋白的体外消化性也出现了减小。此外,淀粉结构的变化也与淀粉消化性的改变有关。Zhang等[34]研究表明,在糯米酒糟60 d的发酵过程中,SDS从 6.84%增加到43.85%,RDS从78.88%降低到53.26%,发酵早期A型晶体结晶度增加和分子螺旋结构增多降低了淀粉的消化性,发酵后期片状结晶结构增厚和淀粉分子团聚结构增多有助于糯米淀粉中SDS含量的升高。小米面团发酵引起淀粉结构的改变有待于进一步深入研究。
此外,与湿热处理相比,湿热-发酵处理进一步提高了样品中RS含量,表明湿热处理和发酵在降低小米样品的体外消化性方面具有协同增效作用,这与Amadou等[2]将发酵-湿热处理作用于小米粉的研究结果一致。

表2 湿热处理和发酵对小米淀粉体外消化性的影响Table2 Effects of heat-moisture treatment and fermentation on starch digestibility of the treated foxtail millet samples during in vitro digestion process
3 结论
本文通过体外消化模型,研究了湿热处理和发酵对小米中营养成分生物可给性的影响。对湿热处理的小米样品进行发酵,可显著提高必需氨基酸和总氨基酸的生物可给性,降低淀粉的消化速率,提高SDS和RS的含量,但铁元素在消化过程中的释放量出现了降低。此外,体外模拟胃肠道消化可极大提高小米中游离酚的含量,湿热-发酵样品表现出最高的自由基清除能力。
在无麸质(gulten-free)小米食品的加工中,湿热处理与发酵的组合应用在改善营养成分生物可及性方面有望成为一项有前景的技术方案,但该影响的内在机制有待阐明,工艺参数也需进一步优化,例如调整发酵条件以提高矿物质的生物利用度。

