莲子壳多酚的抗氧化活性和稳定性
颜 征 张海晖 李亚群 段玉清* 陆玉洪 孙冀平
(1 江苏大学食品与生物工程学院 江苏镇江 212013
2 江苏怡味莲朗伯食品有限公司 江苏宝应 225800)
莲子壳是睡莲科植物莲种子的壳,莲子壳作为莲子加工的副产物,通常被焚烧而未被充分利用,造成资源浪费。有文献报道新鲜莲子壳富含单宁、黄酮[1]、花青素[2]等多酚类物质,具有很高的利用价值。植物多酚又称植物单宁或鞣质,是一种植物体内多元酚类次生代谢物,广泛存在于植物的皮、根、叶和果实中[3]。植物多酚具有良好的抗氧化、抑菌、抗肿瘤等生物活性[4-8]。亚临界水是介于其沸点和临界温度(100~374℃)之间,维持在适当压力下的水[9]。常温常压下,水的极性较强,在亚临界条件下,随着温度的升高,水的氢键被打开或减弱,对中性或非极性有机物的溶解能力也会增加[10],从而可以连续提取天然产物中的水溶性成分和脂溶性成分。亚临界水对多糖类、皂甙类、黄酮类大分子化合物的提取效果较优[11]。亚临界水萃取技术以价廉、无污染的水作为溶剂,被视为绿色环保、前景广阔的一项变革性技术[12]。本文采用亚临界水萃取技术和大孔树脂联用制备莲子壳多酚,并对多酚的抗氧化活性和储藏稳定性进行研究,以期提高莲子壳多酚的利用率,为后期产品开发提供理论基础[13]。
1 材料与方法
1.1 材料与试剂
新鲜莲子壳购于江苏省镇江市农贸市场。AB-8型大孔树脂购于沧州宝恩吸附材料科技有限公司。没食子酸、福林-酚试剂、亚硫酸氢钠、无水碳酸钠、三氯化铁、DPPH、ABTS、VC、乙醇等均为分析纯。
1.2 仪器与设备
SGH型亚临界水反应釜,镇江丹徒环球机电配件厂生产;UV-1601紫外-可见分光光度计,北京瑞利分析仪器公司;ALPHAI-4/2-4冷冻干燥机,德国CHRIST公司;DL-5C离心机,上海安亭科学仪器厂;DHG-9015A电热鼓风干燥箱,上海一恒科学仪器有限公司;JA2003分析天平,北京赛多利斯科学仪器有限公司;GFB型中药粉碎机,上海一恒科学仪器有限公司;HH-S4数显恒温水浴锅,江苏金坛市医疗仪器厂。
1.3 方法
1.3.1 莲子壳多酚的制备 将莲子壳烘干后粉碎,过100目筛。称取一定量的莲子壳粉末,按水料比 30∶1(mL/g)加入萃取釜中,并加入溶剂量1‰的NaHSO3作为辅助萃取剂,控制萃取温度160℃下萃取15 min。将萃取液经4 000 r/min离心8 min,并抽滤得到莲子壳多酚粗提液,粗提液过AB-8大孔吸附树脂柱分离/富集,用体积分数70%乙醇水溶液洗脱(流速2 mL/min),收集洗脱液,45℃下减压浓缩,将浓缩液真空冷冻干燥,即为莲子壳多酚粉末。
1.3.2 多酚含量的测定 采用福林-酚法[14]稍作修改。取一定体积的Folin试剂稀释10倍,取该稀释液4 mL加入到1 mL样液中,然后加入7.5%的碳酸钠溶液5 mL,25℃静置2 h后,于765 nm测定吸光度。以没食子酸为标准物质,配成浓度梯度为 12.5,25,50,100,150,200μg/mL 的样液,建立标准曲线,求得没食子酸浓度与吸光度的回归方程。
1.3.3 莲子壳多酚的抗氧化性测定
1.3.3.1 还原能力测定 还原能力测定,参照李金凤等[15]的方法。取25~200 μg/mL的莲子壳多酚样品1 mL分别加入pH值为6.6的磷酸盐缓冲液2.5 mL和10 mg/mL的铁氰化钾溶液2.5 mL,摇匀,50℃保温20 min后取出,加入10%的三氯乙酸溶液2.5 mL,混匀后于700 nm处测定吸光度。以不加多酚样品为空白对照。与VC比较。吸光度越大,表明样品还原能力越强。
1.3.3.2 DPPH自由基清除能力测定 参照Choe等[16]的方法。将莲子壳多酚样品配成25~200 μg/mL的溶液(无水乙醇配制),取2 mL于试管中,加入 2 mL DPPH·无水乙醇溶液(200 μmol/L)。混匀后在室温下避光反应30 min,于517 nm处测定吸光度,记为Ax。空白组:2 mL无水乙醇和2 mL多酚样品溶液(不同浓度);对照组:2 mL的DPPH·溶液和2 mL无水乙醇,在517 nm波长下测定吸光度,记为Ao。与VC比较。DPPH·清除率的计算见公式(1):
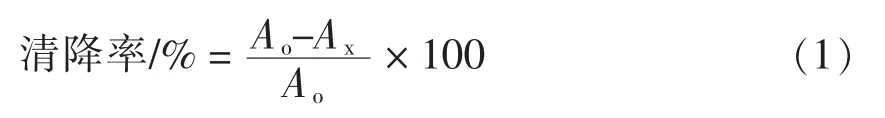
1.3.3.3 ABTS自由基清除能力测定 参照Akkarih等[17]的方法,稍作改进。
(1) ABTS+·溶液的配制:7 mmol/L ABTS 溶液与 4.9 mmol/L过硫酸钾溶液以 1∶1(V/V)充分混匀,室温避光放置 12~16 h(避光),形成 ABTS+·储备液,备用。使用时稀释,使得稀释液734 nm处的吸光值0.7±0.02,现用现配。
(2)试验方法:用无水乙醇配制质量浓度分别为25~200 μg/mL的莲子壳多酚样液,各取200 μL于试管中,加入4 mL的ABTS+·溶液,充分振摇30 s,室温下反应6 min(避光),于724 nm处测定反应后样液的吸光值,记为Ai。对照管:200 μL无水乙醇和4 mL ABTS+·溶液,于724 nm处测定反应后样液的吸光值,记为Ao;标准管:200 μL样液和4 mL无水乙醇,于724 nm处测定反应后样液的吸光值,记为Aj。与VC比较。ABTS+·清除率的计算见公式(2):
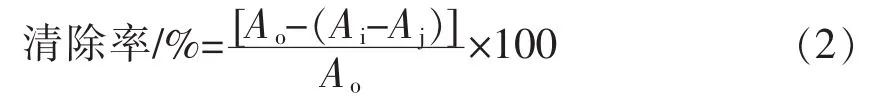
1.3.3.4 O·2-清除能力测定 参照Zhang等[18]的方法,稍作改进。配制质量浓度分别为25~200 μg/mL的莲子壳多酚样液。取4.5 mL Tris-Hcl缓冲液于10 mL具塞比色管中,在20℃水浴预热20 min后,分别加入不同浓度的多酚样品溶液1 mL和25 mmol/L邻苯三酚溶液0.4 mL,摇匀后用蒸馏水稀释至刻度。置于25℃水浴反应5 min,取出后立即加入8 mol/L HCl溶液1 mL,终止反应。于299 nm处的吸光度Ai。空白以蒸馏水代替样品溶液,测定吸光度Ao;考虑到样品液本底的影响,同时测定不加邻苯三酚溶液的相同浓度的样品溶液的吸光度Aj,并与VC做比较。O·2-清除率的计算见公式(3):
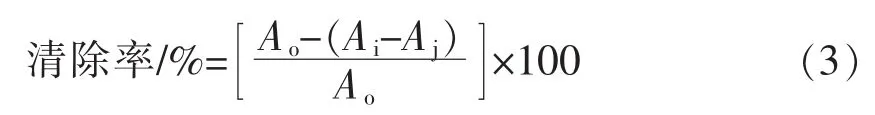
1.3.3.5 NO2-清除能力测定 参照龚明贵等[19]的方法。配制质量浓度分别为25~200 μg/mL的莲子壳多酚样液。准确吸取5 mg/L的NaNO2溶液2 mL置于25 mL比色管中,分别加入2 mL不同浓度的多酚样品溶液,25℃下水浴30 min,取出后立即加入1 mL对氨基苯磺酸溶液(4 g/L),摇匀后于25℃下水浴5 min,再分别加入1 mL盐酸萘乙二胺溶液(2 g/L),用蒸馏水定容至刻度,摇匀,于25℃水浴15 min后于538 nm处测定吸光度。以蒸馏水为参比,并于VC比较。NO2-清除率的计算见公式(4):

式中:Ao——空白对照液的吸光度;Ax——加入样品后的吸光度;Axo——样品本底的吸光度。
1.3.4 莲子壳多酚的稳定性研究
1.3.4.1 pH值对莲子壳多酚稳定性的影响 用1 mol/L的盐酸和1 mol/L的氢氧化钠配成pH分别为 2,4,6,8,10,12 的溶液,加入适量多酚样品,每隔3 d取样1 mL,并稀释4倍,在280 nm下测其吸光度。
1.3.4.2 光照对莲子壳多酚稳定性的影响 配制一定浓度的多酚水溶液,摇匀,将其分别放置于避光和自然光的条件下,每隔3 d取样1 mL,并稀释4倍,在280 nm波长下测其吸光度。
1.3.4.3 温度对莲子壳多酚稳定性的影响 配制一定浓度的多酚水溶液,摇匀,将其分别放置于37℃、室温(25℃)、4℃的条件下,每隔3 d取样1 mL,并稀释3倍,在280 nm波长下测其吸光度。
1.3.4.4 食盐对莲子壳多酚稳定性的影响 配制浓度分别为0.02,0.04,0.06 g/mL的食盐溶液,加入适量多酚样品,每隔3 d取样1 mL,并稀释4倍,在280 nm下测其吸光度。以蒸馏水加入适量多酚样品作为对照。
1.3.4.5 糖对莲子壳多酚稳定性的影响 配制质量浓度为0.1 g/mL的葡萄糖溶液和0.1 g/mL的蔗糖溶液,加入适量多酚样品,每隔3 d取样1 mL,并稀释4倍,在280 nm下测其吸光度。以蒸馏水加入适量多酚样品作为对照。
2 结果与分析
2.1 总多酚测定标准曲线和多酚含量
通过没食子酸浓度和吸光度建立标准曲线,得到回归方程为:y=0.005 x-0.0274,R2=0.992,表明没食子酸浓度与吸光度间具有良好的线性关系。通过该方程,求得莲子壳多酚粉末得率为4.03%,其粉末中多酚纯度为99.50%。
2.2 莲子壳多酚的抗氧化性
2.2.1 莲子壳多酚的还原能力 抗氧化物在酸性条件下,将Fe3+还原成显蓝色的Fe2+,测定其吸光度,就能得到被测液体的还原力[20]。由图1可知,莲子壳多酚和VC均有较强的还原能力,且随样品浓度增大,吸光度不断增大,说明样品质量浓度越高,还原能力越强。
2.2.2 莲子壳多酚清除DPPH自由基的能力 当溶液中存在抗氧化剂时,抗氧化剂能够给DPPH自由基提供氢原子和电子使其发生褪色,吸光值变小,其颜色变得越浅表明抗氧化剂的抗氧化能力越强[21]。从图2中可以得出,莲子壳多酚和VC均有较好的清除DPPH自由基效果。随着样品溶液浓度增大,DPPH自由基清除率增大,当样品溶液质量浓度为100 μg/mL时,莲子壳多酚对DPPH自由基的清除率达到95.45%。
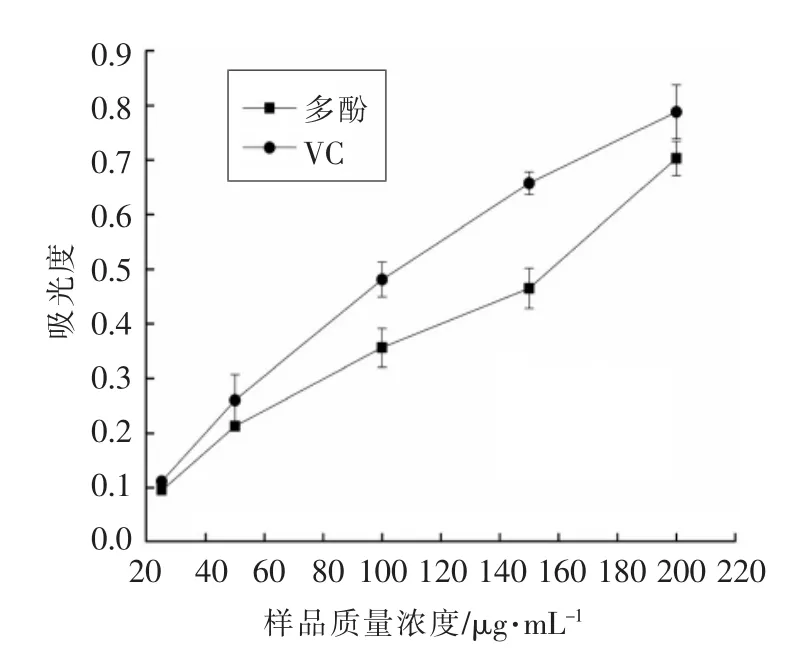
图1 莲子壳多酚的还原能力Fig.1 Reducing power of polyphenols in lotus seeds hull
2.2.3 莲子壳多酚清除ABTS+·的能力 抗氧化剂会将蓝绿色的ABTS+·还原成无色的ABTS,在734 nm波长处测定吸光度,吸光度变化越大,其清除能力越强[22]。莲子壳多酚和VC的清除ABTS+·能力如图3所示,随着样品浓度的增大,清除ABTS+·的能力增强。莲子壳多酚和VC均有较强的ABTS+·清除能力,当样品浓度低于100 μg/mL时,莲子壳多酚清除ABTS+·的能力强于VC;当样品质量浓度达到100 μg/mL以上时,莲子壳多酚和VC对ABTS+·的清除率均接近100%。
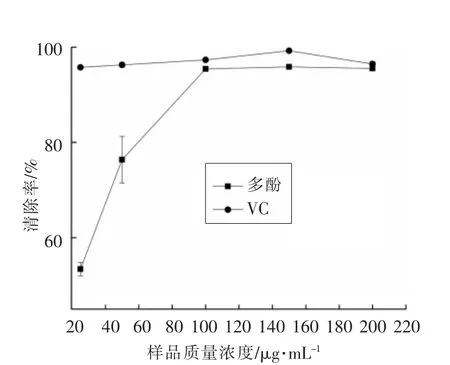
图2 莲子壳多酚清除DPPH自由基的能力Fig.2 DPPH free radicals scavenging ability of lotus seeds hull polyphenols
2.2.4 莲子壳多酚清除O·2-的能力 超氧阴离子自由基是反应性氧中间物的一种,其与羟基结合后的产物会对细胞DNA造成损坏,清除超氧阴离子自由基在抗氧化过程中起着重要作用[23]。由图4可知,莲子壳多酚和VC对超氧阴离子均有一定的清除效果,且随样品浓度增大,清除能力增强。
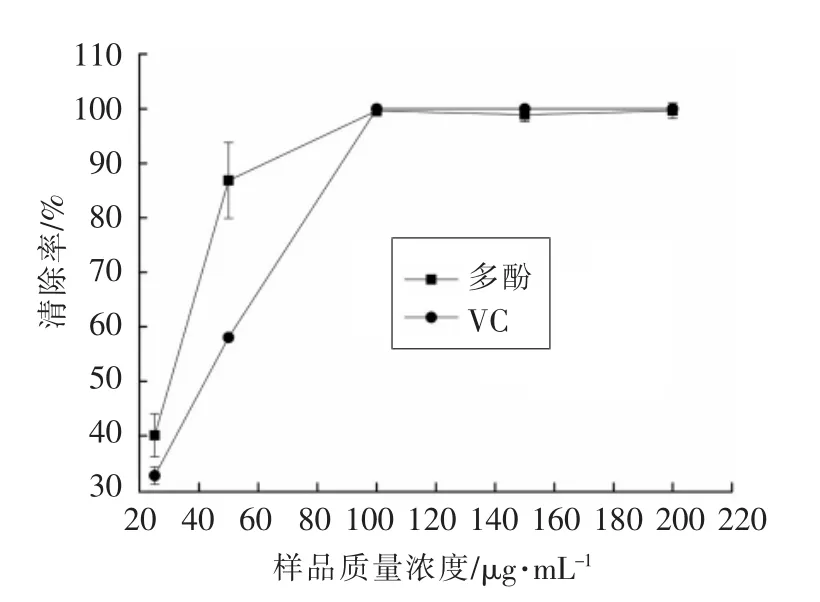
图3 莲子壳多酚清除ABTS+ ·的能力Fig.3 ABTS+ ·scavenging ability of lotus seeds hull polyphenols
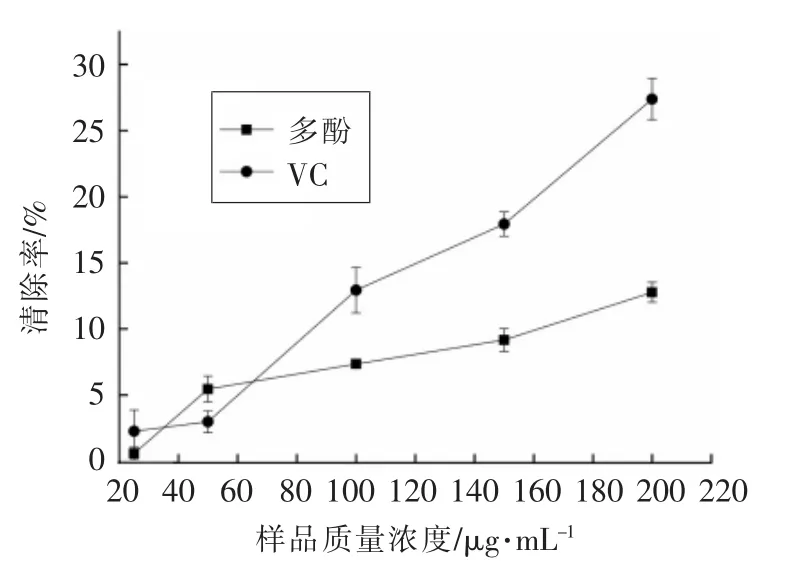
图4 莲子壳多酚清除O·2- 的能力Fig.4 O·2- scavenging ability of lotus seeds hull polyphenols
2.2.5 莲子壳多酚清除NO2-的能力 莲子壳多酚和VC对亚硝酸根离子的清除能力如图5所示,莲子壳多酚和VC对亚硝酸根离子均有较好的清除效果,随着样品浓度的增大,清除NO2-的能力增强。当样品溶液质量浓度为100 μg/mL时,莲子壳多酚对NO2-的清除率达到41.20%。
2.3 莲子壳多酚的稳定性
2.3.1 pH对莲子壳多酚稳定性的影响 由图6可知,在pH 2~6之间时,莲子壳多酚较稳定,吸光值变化较小;在pH 8~12条件下,莲子壳多酚吸光值变化较大,表明在碱性条件下莲子壳多酚不稳定。这是因为多酚富含酚羟基,在酸性或中性条件下,多酚性质较为稳定;在碱性条件下,破坏了多酚的结构,生成其它物质[24],在pH为12时,尤其明显。因此,应在酸性条件下保存莲子壳多酚。
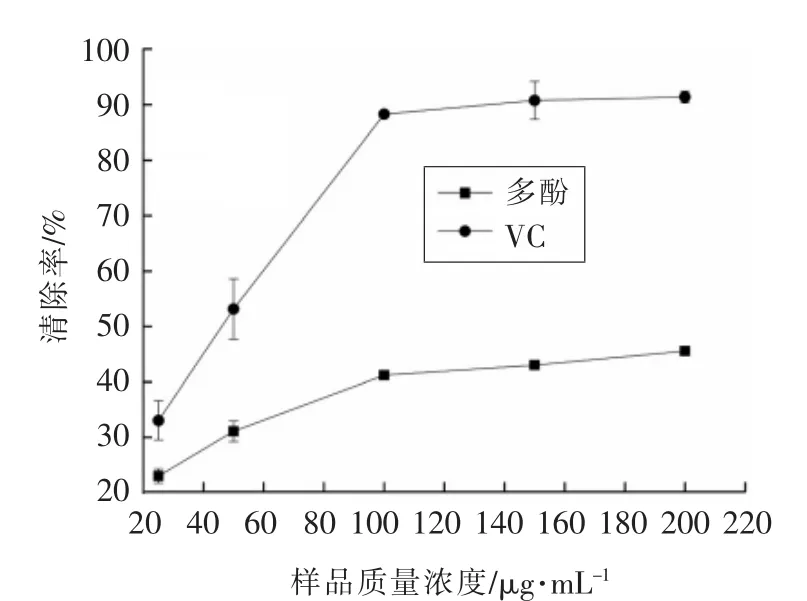
图5 莲子壳多酚清除NO2- 的能力Fig.5 NO2- scavenging ability of lotus seeds hull polyphenols

图6 pH对莲子壳多酚稳定性的影响Fig.6 Effect of pH the stability of polyphenols from lotus seeds hull
2.3.2 光照对莲子壳多酚稳定性的影响 从图7可以看出,莲子壳多酚对光较敏感。在避光和自然光条件下,密封保存的0~3 d和9~15 d,莲子壳多酚的吸光度均略有增大,密封保存的3~9 d,莲子壳多酚的吸光度均略有减小,说明多酚类物质在贮存过程中可能发生部分聚合或降解,但两者具有相同趋势。
2.3.3 温度对莲子壳多酚稳定性的影响 由图8可以看出,在4℃条件下保存,莲子壳多酚溶液吸光值变化很小;在室温和37℃条件下,莲子壳多酚溶液吸光值均有明显变化,说明莲子壳多酚结构发生变化,高温下莲子壳结构发生变化,故应在低温条件下保存莲子壳多酚。
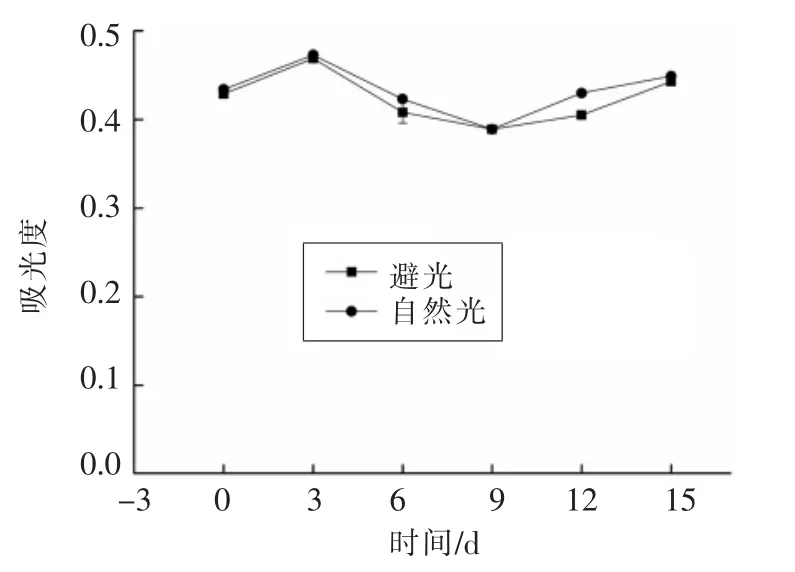
图7 光照对莲子壳多酚稳定性的影响Fig.7 Effect of light on the stability of polyphenols from lotus seeds hull
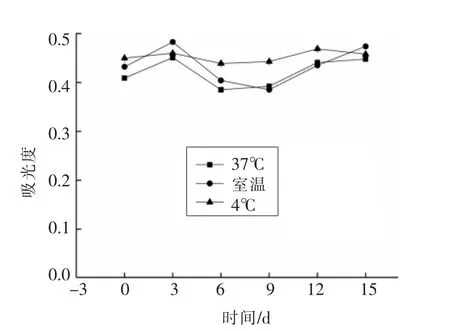
图8 温度对莲子壳多酚稳定性的影响Fig.8 Effect of temperature on the stability of polyphenols from lotus seeds hull
2.3.4 食盐对莲子壳多酚稳定性的影响 不同浓度食盐对莲子壳多酚稳定性的影响如图9所示,无食盐、0.02 g/mL食盐、0.04 g/mL食盐和0.06 g/mL食盐条件下,莲子壳多酚溶液吸光度变化相似,说明食盐既不会破坏莲子壳多酚,也不能保护莲子壳多酚。因此生产加工过程中,添加食盐不会影响莲子壳多酚的稳定性。

图9 食盐对莲子壳多酚稳定性的影响Fig.9 Effect of salt on the stability of polyphenols from lotus seeds hull
2.3.5 糖对莲子壳多酚稳定性的影响 由图10可以得出,在无糖条件下,莲子壳多酚吸光度变化较明显,在0.1 g/mL葡萄糖和蔗糖溶液中,莲子壳多酚吸光变化较小,说明莲子壳多酚比较稳定,葡萄糖和蔗糖对莲子壳多酚均有一定的保护作用。这是因为糖的添加降低了溶液水分活度,从而减少了多酚的破坏[25]。
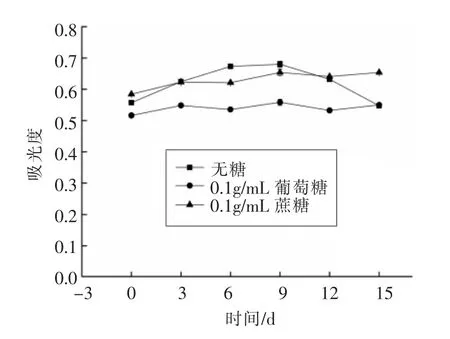
图10 糖对莲子壳多酚稳定性的影响Fig.10 Effect of sugar on the stability of polyphenols from lotus seeds hull
3 结论
1)经亚临界水萃取和AB-8大孔吸附树脂联用制备莲子壳多酚,其得率为4.03%,多酚纯度为99.50%。
2) 莲子壳多酚对DPPH·、ABTS+·、O·2-、NO2-均有较好的清除效果。莲子壳多酚在4℃、避光、pH 2~6条件下储存较稳定,食盐对莲子壳多酚的稳定性没有影响,蔗糖和葡萄糖均对莲子壳多酚有一定的保护作用,可以为多酚产品的加工提供理论基础。

