IGF-1对兔脂肪干细胞增殖和成骨分化的影响
朱思斌,张 雪,江 飞,许易诚,尹宗生
传统上,治疗骨折创伤主要有手术治疗和复位外固定保守治疗,骨组织工程是近期提出和快速发展的新的治疗手段[1],相比旧的治疗方法,骨组织工程治疗过程中创伤的骨组织可以更快恢复,骨组织修复过程加快,骨折预后功能可以更快接近之前的水平。不同种子细胞的增殖能力和多功能分化潜力各不相同,在不同骨科疾病中的治疗效果差异巨大。现在常用的种子细胞有骨髓间充质干细胞(bone marrow mesenchymal stem cells,BMSCs)和脂肪干细胞(adipose-derived stem cells,ADSCs)。ADSCs于2001年第一次被发现,是从脂肪组织中提取的成体干细胞[2]。ADSCs起源于胚胎的中胚层,可以向多种细胞方向分化[3-4],最终分化成成骨、成脂、成软骨细胞。胰岛素样生长因子1(insulin like growth factor 1,IGF-1)是一种结构类似于胰岛素的生长因子,在调节细胞生长、促进细胞分化、促进骨与软骨的合成代谢、创伤修复过程中起着重要的作用[5]。研究[6]表明IGF-1可以促进 BMSCs的增殖和成骨分化。目前,ADSCs在体外培养下仍有生长增殖较慢,成骨分化所需时间较长的缺陷,为研究培养方法,该实验通过在培养基中加入不同浓度的IGF-1,探寻IGF-1对体外培养下ADSCs的增殖和成骨分化能力的生物学影响。
1 材料与方法
1.1 实验动物6月龄SPF级健康新西兰白兔9只,雌雄不限,体质量2.0~3.0 kg,由安徽医科大学实验动物中心提供。饲养环境温度18~29 ℃,相对湿度达40%~70%,新鲜空气换气次数10次/h,气流速度≤0.18 m/s,压差25 Pa,洁净度一万级,氨浓度15 mg/m3,噪音≤60 dB,照度150~300 Lux。
1.2 主要试剂与仪器低糖DMEM培养基购自美国Hyclone公司;兔脂肪干细胞成骨诱导培养基、兔脂肪干细胞成脂诱导培养基购自美国Cyagen公司;胎牛血清购自美国Gibco公司;人重组IGF-1粉剂购自美国R&D公司;CCK-8细胞增殖试剂盒为南京诺唯赞生物科技有限公司产品;Ⅰ型胶原酶、胰蛋白酶购自美国Sigma公司;CD90单克隆抗体为北京博奥森生物技术有限公司产品;碱性磷酸酶(alkaline phosphatase,ALP)活性测定试剂盒为南京建成公司产品。CO2细胞恒温培养箱、超速离心机为美国Thermofisher公司产品;倒置荧光显微镜为日本Olympus公司生产;酶标仪为美国BIO-TEK公司产品。
1.3 兔ADSCs的分离与培养取兔1只,戊巴比妥钠麻醉,颈后术区剃毛备皮,俯卧位固定于手术台上,消毒,铺单,在无菌手术间,沿颈后正中切口逐层切开,分离出皮下脂肪,用添加1%含量双抗的PBS冲洗3次,在超净工作台中,仔细剔除组织中的小血管,外包膜和其他组织。使用眼科剪将脂肪剪碎至乳糜状,加入两倍脂肪体积的0.1%Ⅰ型胶原酶,搅拌均匀,将离心管放置于37 ℃水浴中振荡消化60 min,1 200 r/min 离心 10 min,去除上层油脂、残余脂肪组织。沉淀重悬细胞后,放入200目细胞筛过滤,滤液1 200 r/min离心5 min。使用含10%胎牛血清的低糖DMEM重悬细胞沉淀,接种至细胞瓶,放入恒温细胞箱中培养,首次换液于24 h后,漂洗去除未贴壁细胞,每日镜下观察细胞形态和生长情况,待细胞长满80%左右时,用胰酶在37 ℃恒温细胞培养箱中消化2 min左右,加入血清L-DMEM中和胰酶,设置离心机转速为1 200 r/min,时间5 min,将细胞离心,离心后弃去上清液,将细胞按1 ∶3传代。
1.4 ADSCs表面抗体的检测初代ADSCs传代至P2,细胞在培养皿增殖至80%融合时,用胰酶消化细胞,再用含血清的低糖DMEM终止消化反应,消化后放入离心机1 200 r/min离心5 min,弃去上清液,用细胞培养基重悬, 调整细胞浓度为3×105/ml,接种于铺好细胞爬片的24孔板上,每孔0.5 ml。待细胞贴壁后,用4%多聚甲醛固定,用PBS浸洗3次,加山羊血清等待30 min。再滴加山羊抗兔CD90一抗,放入湿盒,在4 ℃环境下过夜。第2天用PBST冲洗爬片,重复3次,滴加荧光二抗,湿盒孵育1 h,PBST冲洗爬片3次。滴加DAPI,孵育5 min对ADSCs细胞核染色。染色后在荧光显微镜下观察并拍照。
1.5 兔ADSCs向脂肪细胞诱导分化取P2代ADSCs,细胞生长至80%~90%融合时,用0.25%胰酶消化细胞,调整细胞密度为5×104/ml,以每孔2 ml接种于6孔板中,2 d后,待细胞生长完全融合,依照兔ADSCs成脂诱导培养基说明书,使用兔成脂诱导培养基A液培养3 d,3 d后换为兔成脂诱导培养基B液培养1 d,A液和B液相互交替培养3~5次,每日镜下观察细胞形态,待脂滴足够大,足够圆,用油红O染色,在倒置显微镜下观察并拍照。
1.6 兔ADSCs向成骨细胞诱导分化取80%融合的P2代ADSCs,加入浓度为0.25%的胰酶消化,调整细胞密度为5×104/ml,以每孔2 ml接种于6孔板中,传代后第2天,待细胞贴壁,换用兔成骨诱导培养基培养4周,镜下观察细胞形态转变后,用茜素红染色,在倒置显微镜下观察并拍照。
1.7 CCK-8法检测IGF-1对ADSCs增殖活性的影响取P2代ADSCs,以2×104/cm2的密度分别接种于96孔板中培养,每孔加入100 μl培养基。依据说明书,将重组人IGF-1粉剂溶于无菌PBS中,加入成骨诱导培养基,配置成0、5、10、20 ng/ml四种浓度。设置为A组(对照组,0 ng/ml IGF-1)、B组(5 ng/ml IGF-1)、C组(10 ng/ml IGF-1)、D组(20 ng/ml IGF-1),每组设置3个复孔,培养24 h后加入100 μl含10% CCK-8的低糖培养基,在37 ℃、5% CO2下反应4 h,酶标仪检测450 nm波长处各孔的吸收值。每日重复CCK-8增殖实验,重复3次,检测7 d。
1.8 茜素红染色检测钙结节及定性分析取P2代ADSCs,以 5×104/cm2的密度分别接种于24孔板中培养,每孔1 ml。细胞贴壁后,换用加入IGF-1的兔成骨诱导培养基,按每培养基IGF-1的浓度将24孔板设置为4组,A组(对照组,0 ng/ml IGF-1)、B组(5 ng/ml IGF-1)、C组(10 ng/ml IGF-1)、D组(20 ng/ml IGF-1),在培养21 d后,每组对钙结节茜素红染色,定性检测钙结节。
1.9 ALP与钙离子含量的检测及定量分析按上述实验分组在24孔板中培养ADSCs, 在第14天和第24天时,每组取3个孔进行钙离子定量检测,每孔加入1%氯化十六烷基吡啶500 μl,在常温下反应10 min,选择560 nm波长,用酶标仪检测钙离子的含量。每组另外3个孔用胰酶消化后,用含血清的低糖DMEM中和反应,离心去除残余的胰酶,用PBS冲洗细胞两次,加入0.1% Trizon X-100裂解细胞后收集裂解液,在高速离心机中20 000 r/min离心10 min后取上清液,依据ALP检测试剂盒说明书的步骤进行ALP定量检测。
1.10 统计学处理使用SPSS 17.0软件分析数据,组内比较采用独立样本t检验,组间比较使用单因素方差分析。P<0.05为差异有统计学意义。
2 结果
2.1 兔ADSCs的形态原代培养后,兔ADSCs于48 h内贴壁,原代细胞呈短梭形或小多角形,72 h后观察,细胞增殖后密度增高时为长梭形成纤维细胞样外观。见图1A。原代培养7 d左右,细胞铺满围绕各中心呈集落样生长。见图1B。
2.2 ADSCs免疫荧光鉴定结果免疫荧光鉴定P2代脂肪干细胞,显示结果为DAPI细胞核染色阳性,见图2A;FITC标记的CD90染色阳性,见图2B。
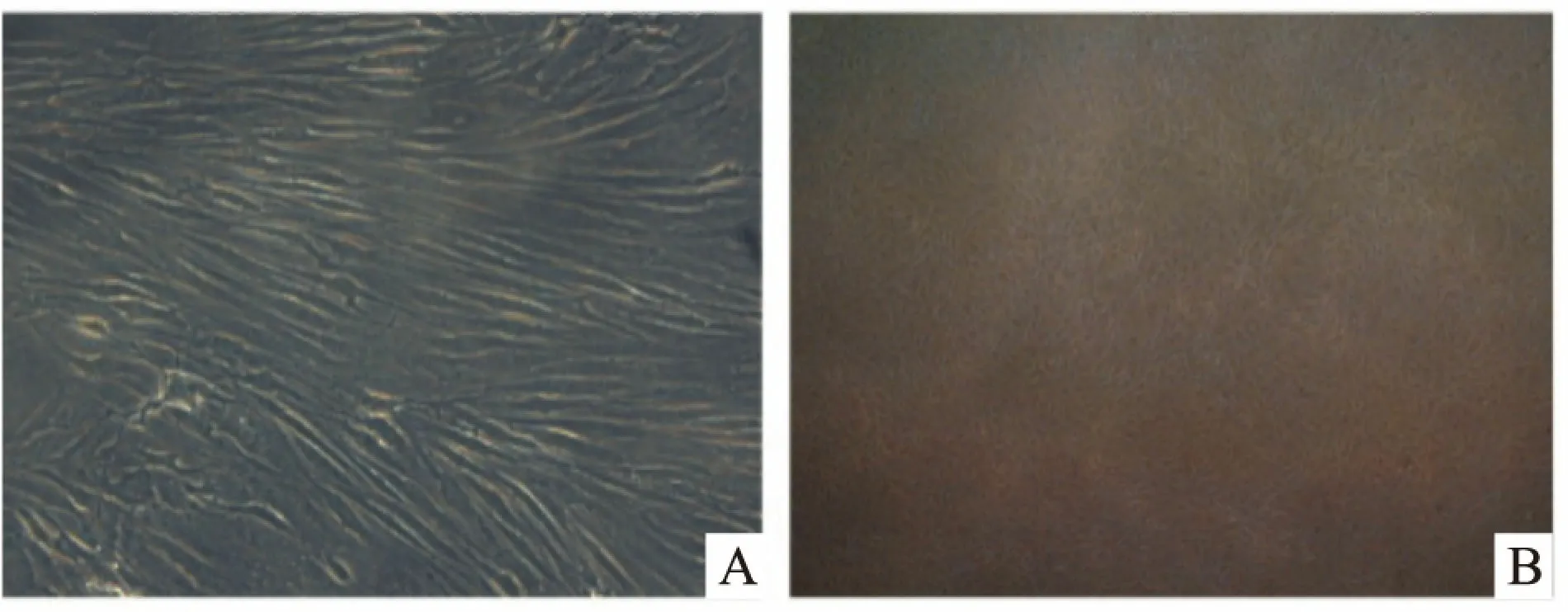
图1 倒置显微镜下兔脂肪干细胞的形态
A:ADSCs原代培养3 d,呈长梭形成纤维样外观 ×200;B:ADSCs原代培养7 d,细胞铺满围绕各中心呈集落样生长 ×100
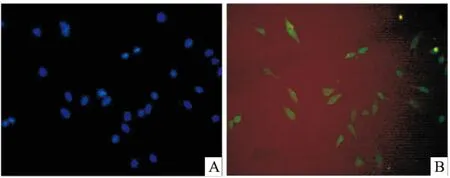
图2 ADSCs免疫荧光染色 ×200
A:DAPI细胞核染色阳性;B:FITC标记的CD90染色阳性
2.3 ADSCs成脂诱导分化结果P3代ADSCs成脂诱导后,培养皿中的细胞结构变得不规则,细胞内可见球形透亮脂肪滴,逐渐变大变圆,诱导培养3周后,进行油红 O染色,染色结果为阳性,可见红色球形脂肪滴,见图3A,证明ADSCs成脂分化。
2.4 ADSCs成骨诱导分化结果P3代ADSCs成骨诱导后,细胞形态由细长的梭形结构逐渐变宽大,变成不规则的多角形或多边形。诱导14 d后,可见细胞周围分布小褐色结节。诱导28 d后,形成大量钙结节,茜素红染色后可见钙结节被染成深红色,茜素红染色阳性,见图3B,证明了体外培养的ADSCs有成骨分化的能力。
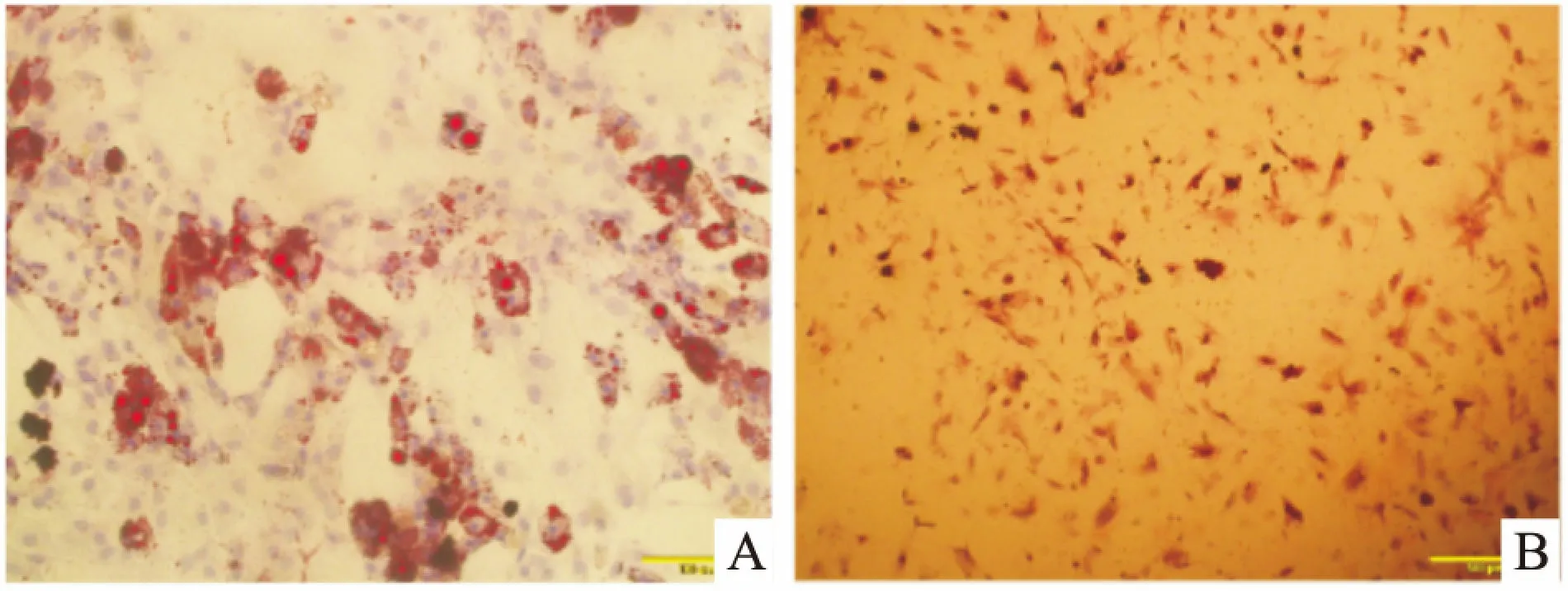
图3 ADSCs的功能鉴定 ×100
A:ADSCs成脂分化后油红O染色阳性;B:ADSCs成骨分化后茜素红染色阳性
2.5 ADSCs的增殖活性曲线CCK-8法检测结果:随着培养基内IGF-1浓度的增高,ADSCs增殖活性逐渐增强,从第2天开始,5、10、20 ng/ml IGF-1组的增殖活性均高于对照组,其中20 ng/ml IGF-1组高于10 ng/ml IGF-1组和5 ng/ml IGF-1组,10 ng/ml IGF-1组高于5 ng/ml IGF-1组,差异有统计学意义(F=141.675,P<0.05)。见图4。
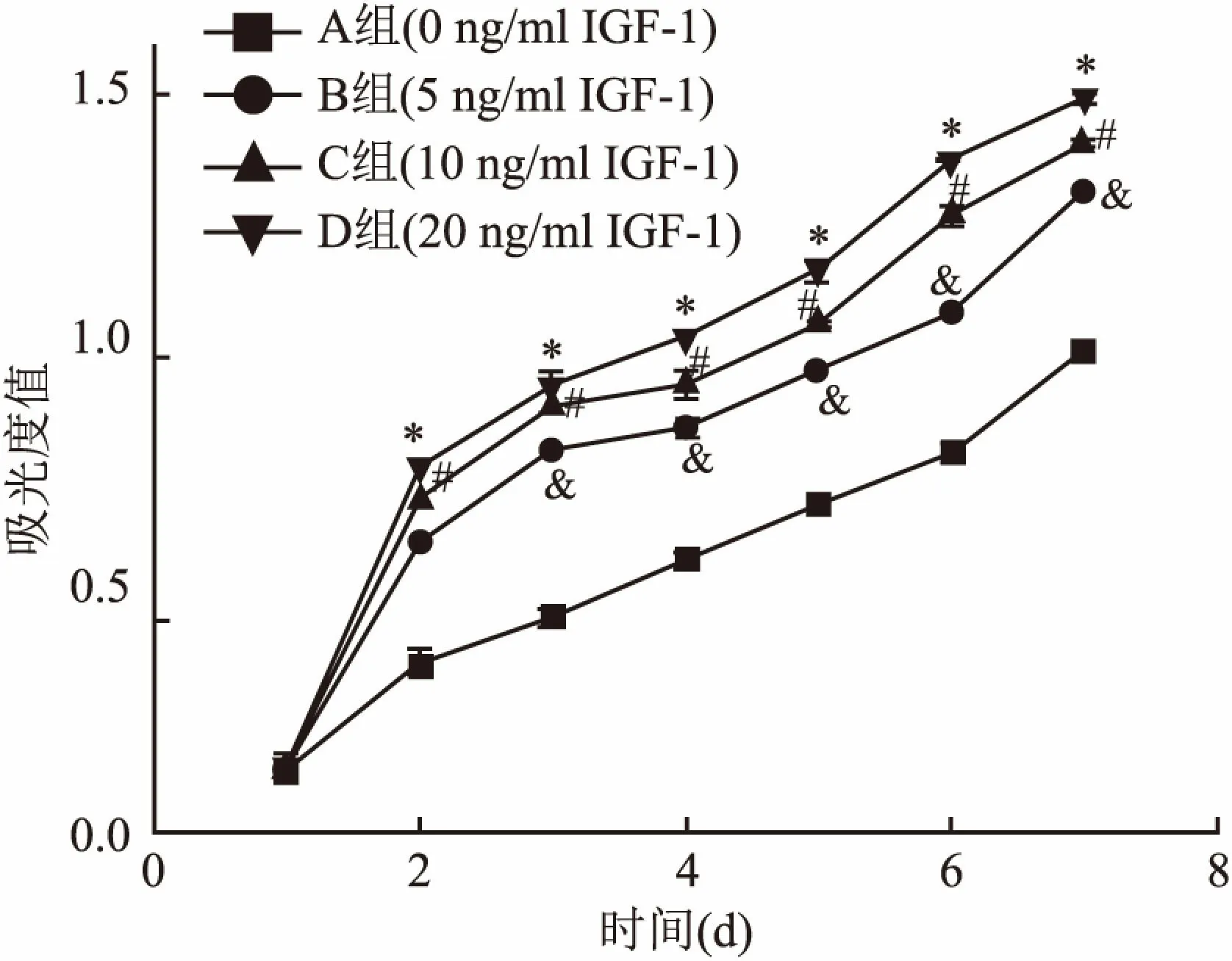
图4 ADSCs增殖曲线
与A组比较:*P<0.05;与B组比较:#P<0.05;与C组比较:&P<0.05
2.6 钙离子茜素红染色的检测结果成骨诱导分化3周后,ADSCs的茜素红染色结果为阳性,4组细胞镜下均可见红色钙结节。见图5。在镜下观察钙结节密度,密度从大到小排列依次为D组、C组、B组和A组,A组密度最低。证明了IGF-1对ADSCs钙离子的生成的促进作用。
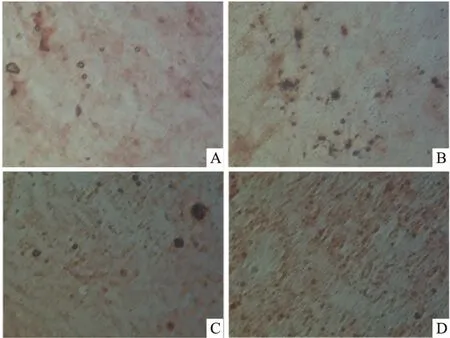
图5 ADSCs钙结节的定型鉴定 ×200
A:A组(0 ng/ml IGF-1)茜素红染色;B:B组(5 ng/ml IGF-1)茜素红染色;C:C组(10 ng/ml IGF-1)茜素红染色;D:D组(20 ng/ml IGF-1)茜素红染色
2.7 ALP和钙离子的定量检测ALP定量检测: ADSCs诱导培养14 d时,D组、C组、B组中ALP活性均高于A组,且D组活性高于C组和B组,C组高于B组,差异有统计学意义(F=60.619,P<0.05)。培养21 d时,D组、C组、B组中ALP活性均高于A组,且D组活性高于C组和B组,C组高于B组,差异有统计学意义(F=162.816,P<0.05),见图6。钙离子定量检测:诱导培养14 d时,D组、C组、B组的钙离子含量均高于A组,D组高于B组,C组高于B组,差异有统计学意义(F=142.931,P<0.05),而D组和C组钙离子含量差异无统计学意义,诱导培养21 d时,D组、C组、B组的钙离子含量均高于A组,而且D组高于C组,D组高于B组,C组高于B组,差异有统计学意义(F=71.286,P<0.05),见图7。
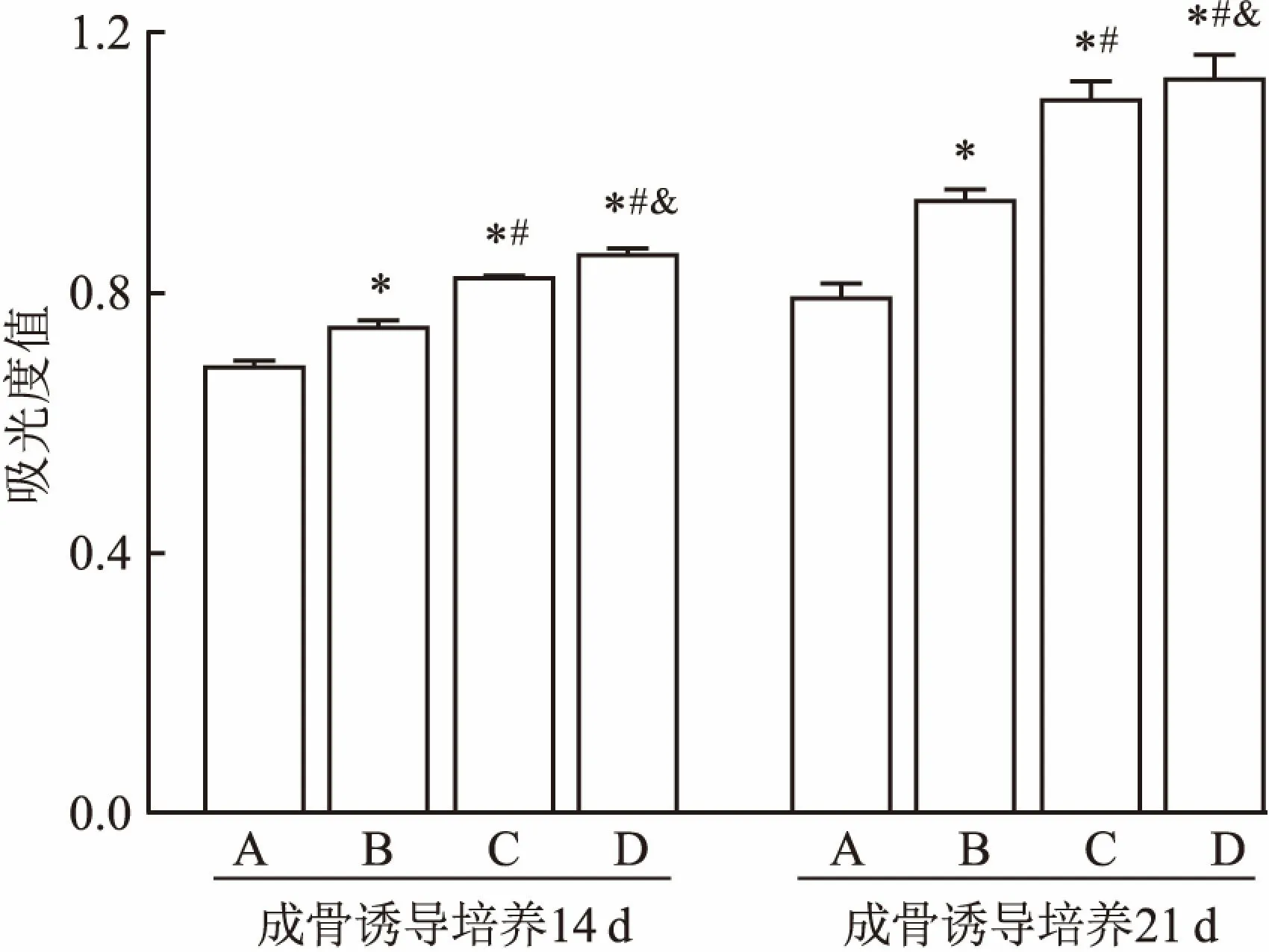
图6 ALP定量检测
与A组比较:*P<0.05;与B组比较:#P<0.05;与C组比较:&P<0.05
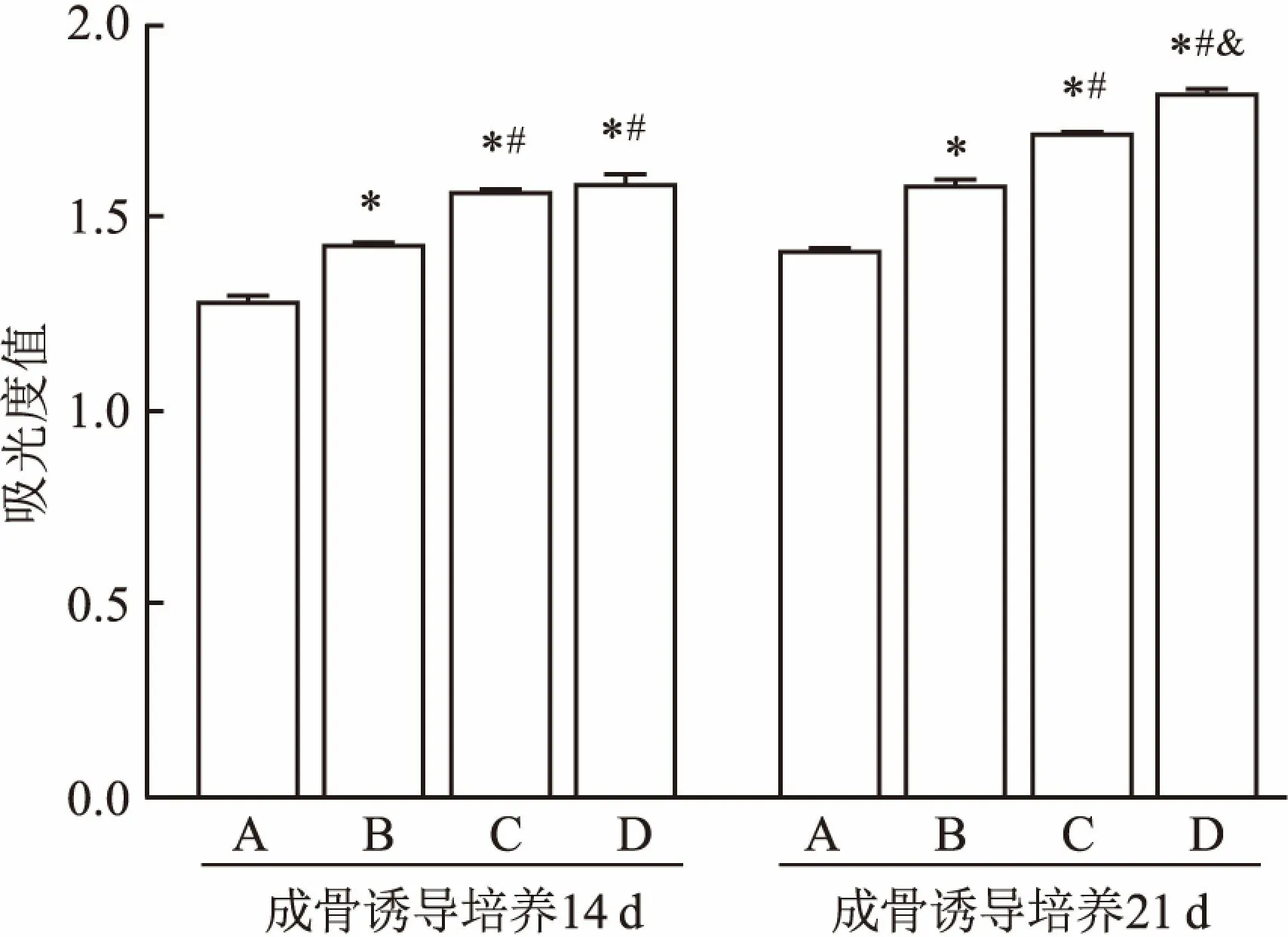
图7 钙离子定量检测
与A组比较:*P<0.05;与B组比较:#P<0.05;与C组比较:&P<0.05
3 讨论
骨科临床上,股骨头坏死是最常见的一种疾病,患病年龄多发于35~50岁,发病病因和机制非常复杂,受多种因素影响[7],在近年的研究中,利用BMSCs等干细胞治疗早期股骨头坏死是热门的研究对象。BMSCs可在体外培养,并向成骨方向和成软骨方向分化,广泛应用于治疗骨坏死等骨科疾病实验研究中[8]。但BMSCs体外培养需要从动物的骨髓腔中取材,其来源少,取材困难,细胞增殖速度较慢。与BMSCs相比,ADSCs来源广泛,取材和培养过程简单,细胞增殖和分化速度快[9]。有研究[10]表明,在体外环境下,ADSCs的增殖能力和向成骨细胞分化潜力强于BMSCs,是骨组织工程中更优秀的种子细胞。
生长因子是一种活性多功能肽物质,由特定细胞分泌,通过与靶细胞结合,可以调节细胞增殖和促进细胞分化。IGF-1是一种生长因子,来源于体内肝细胞、肾细胞、脾细胞等十几种细胞自分泌和旁分泌作用于周围组织,但大部分来自于肝细胞。受垂体分泌的生长激素调控,参与调节绝大部分器官的生长和功能,对细胞的增殖、分化具有非常重要的作用[11-12]。骨质疏松患者中,血清IGF-1水平下降,IGF-1可以促进骨形成、抑制骨破坏、减少骨的吸收,对骨质疏松具有改善作用[13]。IGF-1的结构与胰岛素相似,主要存在血液中,可以降低血糖、促进糖异生、抑制脂肪分解、促进组织利用葡萄糖,对糖尿病继发骨质疏松有着良好的治疗效果。有研究[14]表明,IGF-1会影响骨细胞代谢,是骨形成和骨重建过程中的关键蛋白,又有研究[15]表明,IGF-1可以增强胰岛素生长因子结合蛋白5在成骨细胞中的表达,对成骨细胞的增殖有促进作用。本实验通过在培养基中加入不同浓度的IGF-1,观察其对ADSCs的增殖和成骨分化的影响。本次实验证明,含有5~20 ng/ml IGF-1的成骨培养基,可以增加ADSCs的增殖活性和ALP及钙离子含量,培养基中的IGF-1含量越高,ADSCs的增殖和成骨分化能力越强,具有剂量反应关系,IGF-1对ADSCs的生长增殖和成骨分化具有促进作用。有研究[16]表明,IGF-1通过efn-Eph信号通路和其他多种通路作用于ADSCs,刺激ADSCs的增殖和成骨分化。本实验在成骨培养基中加入的IGF-1最大浓度为20 ng/ml,但增强细胞成骨分化能力的最佳IGF-1浓度仍不能确定,有待进一步实验。

