miRNA在异丙肾上腺素诱导大鼠心肌肥厚中的表达及生物信息学分析*
伍学翠, 赵 云, 李 聪, 熊海容, 郑智维, 周 军, 刘 蓉, 龚 威, 刘朝奇Δ
(1. 三峡大学医学院, 湖北 宜昌 443002; 2. 宜昌市中心人民医院, 湖北 宜昌 443003)
2018年,美国心脏协会(American Heart Association,AHA)的统计结果显示,心血管疾病仍是全球疾病病死率的主要原因,成为人类主要的公共卫生问题[1]。其中心肌肥厚是众多心血管疾病的共同病理变化,是心衰、脑卒中、猝死等的独立危险因素[1]。病理性心肌肥厚发生机制尚未阐明。因此,建立模拟人类自然疾病过程的心室肌肥厚实验动物模型,用于疾病发生机制及药物干预的研究至关重要。目前,国内外有关心肌肥厚模型制备方法主要有压力超负荷法、容量负荷法、激素诱导法等。本实验采用异丙肾上腺素(IsoProterenol,ISO)诱导实验性大鼠心肌肥厚动物模型。
微小RNA(MicroRNA,miRNA)是长度为21-25nt的内源性小的非编码RNA分子,主要通过基因表达转录后水平发挥生物学功能,诱导mRNA切割或抑制蛋白翻译来调控基因表达[2]。越来越多的研究证据表明,特定的miRNA失调可能会改变心肌细胞和非心肌细胞对病理性血流动力学超负荷的特异性信号传导的细胞反应,导致心肌肥厚和心力衰竭,miRNA在心肌肥厚的发展过程中发挥重要的调节作用[3-4]。miRNA的特异性表达谱可作为识别疾病的生物指标。因此,本研究探讨心肌组织表达量高的miRNA在ISO诱导大鼠心肌肥厚的表达情况,以及miRNA在心肌肥厚调控中的机制,以期为心肌肥厚疾病的防治和靶向治疗提供基础,有望成为一种新的治疗思路[5-6]。
1 材料与方法
1.1 实验动物
SPF级健康雄性SD大鼠16只,体重280~300 g,8~9周龄,由湖北三峡大学实验动物中心提供[动物生产许可证号:(SYXK)(鄂)(2017-0061)]。所有动物实验均遵循相关动物使用和保护规定。
1.2 主要药物、试剂与仪器
ISO购自Sigma公司,货号:I5627-5G;PCR引物由生工生物工程(上海)股份有限公司合成;RNAiso Plus和反转录试剂盒购自大连宝生物科技有限公司;Step One Plus RT-qPCR仪:德国Applied Biosysterms公司;超声仪器:Philips-EPIQ7C,探头:L12-3。
1.3 生物信息学研究工具
本实验中应用miRNA靶基因预测数据库:Targetscan(http://www.targetscan.org/)、miRDB(http://www.mirdb.org/)、miRWalk(http://mirwalk.umm.uni-heidelberg.de/)。靶基因相关信号通路预测软件(FunRich)。
1.4 动物分组、模型制备
将16只大鼠随机分为2组:对照组、模型组,每组8只,实验开始前一周进行适应性饲养,使大鼠适应实验环境,自由进食水。
ISO构建大鼠心肌肥厚模型:ISO粉剂与生理盐水配制比为每毫升生理盐水含0.5 mg ISO,即浓度0.5 mg/ml,模型组ISO给药剂量1 mg/kg,经背部皮下多点注射,连续10 d,对照组同样方法给予同体积生理盐水。
1.5 超声检查
给药第10日结束后,大鼠隔夜禁食,次日称重,用10%水合氯醛以0.4 ml/100 g腹腔注射麻醉,前胸壁剃毛,充分暴露前胸壁,涂抹超声耦合剂后进行超声心动图检查,测得大鼠舒张期心室壁厚度、心腔大小及左心收缩功能。
1.6 心脏组织HE染色
心脏取材,给药第10日结束后,大鼠隔夜禁食,次日称重,用10%水合氯醛以0.4 ml/100 g腹腔注射麻醉,仰卧位固定四肢,开腹通过腹主动脉取血,取尽后打开胸腔,取下心脏,挤去心腔内残余血液,称量并记录,将心脏分为心尖段、中间段和心底段三部分,心尖段和心底段-80℃保存。中间段浸泡于4%多聚甲醛溶液中保存固定,24 h后换75%酒精浸泡24 h,包块,经常规脱水、石蜡包埋、切片,行HE染色,观察左心室心肌细胞病理学改变。
1.7 RT-qPCR检测
取大鼠心脏组织用RNAiso Plus提取心脏组织总RNA,采用RT-qPCR法,用SYBR®Premix Ex TaqTM(TliRNaseH Plus)试剂盒,以U6 small nuclear RNA为内参,对心肌组织miRNAs(miR199a-5P、miR206、miR133a-3P、miR499-5P)水平进行相对定量检测,采用2-△△Ct法计算结果,以倍数表示。引物序列见表1。
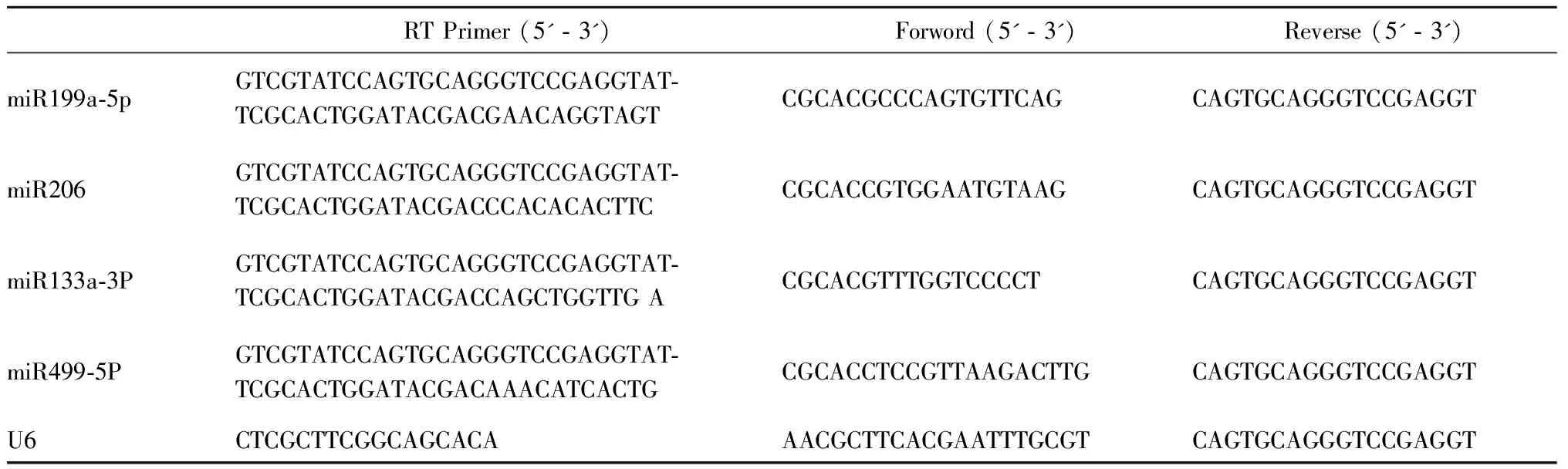
Tab. 1 Primer sequences of miR199a-5P, miR206, miR133a-3P and miR499-5P for real-time quantitative PCR
1.8 miRNAs的靶基因预测及生物信息学分析
运用Targetscan、miRDB、miRwalk 数据库预测大鼠上述4种miRNAs可能的全部靶基因,运用FunRich软件分析预测相关信号通路。
1.9 统计学处理

2 结果
2.1 ISO诱导大鼠心肌肥厚模型
本实验通过多次预实验剂量摸索,最后确定ISO实验剂量为1 mg/(kg·d),经背部皮下多点注射建立大鼠心肌肥厚模型。在造模过程中,模型组死亡1只。
2.2 心肌肥厚心脏重量、心脏重量指数及超声参数变化
建模结束后,超声心动图检测结果显示,与对照组相比,模型组心室壁(IVSd、LVPWd)增厚,心室腔变大(LV),心功能降低(EF%),差异具有统计学意义(P<0.05);心脏取材,称量大鼠心脏重量及体重,并计算心脏/体重比,结果发现模型组大鼠与对照组大鼠相比,模型组HW、HW/BW测量值明显升高,差异具有明显统计学意义(P<0.01,表2,图1);提示心肌肥厚模型构建成功。
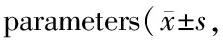
Tab. 2 Rat heart weight, heart/body weight ratio and echocardiographic detection of ultrasound n=8)
IVSd: Interventricular septal thickness; LV: Left ventricle; LVPWd: Left ventricular posterior wall thickness; EF: Ejection fraction; HW: Heart weight; HW/BW: Heart/Body weight ratio
*P<0.05,**P<0.01vscontrol group
Fig.1Rat heart ultrasound M-shaped graph
A: Control group; B: Model group
2.3 心肌肥厚的心脏组织病理学变化
经过组织切片HE染色结果发现,对照组心肌细胞形态正常,心肌细胞排列整齐。模型组心肌细胞体积明显增大,心肌纤维排列紊乱,间质增宽,符合心肌细胞肥厚的组织病理学改变(图2)。应用Image J分析软件测量模型组与正常组细胞表面积,结果表明模型组细胞表面积明显增大,差异具有统计学意义(P<0.01)。

Fig.2HE staining of rat myocardial tissues(HE ×400)
A: Control group; B: Model group
2.4 RT-qPCR检测大鼠心肌miRNAs的表达情况
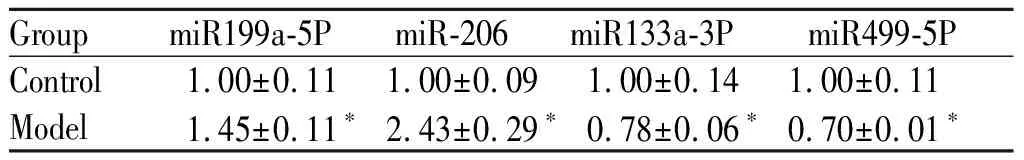
通过文献检索,选取心肌组织表达量高的miRNAs(MiR-199a-5P、-206、133a-3P、及499-5P)进行检测。与对照组比较,模型组中miR199a-5P、miR206表达明显上调,差异具有统计学意义(P< 0.05)。miR133a-3P、miR499-5P表达下调,差异具有统计学意义(P<0.05,表3)。

GroupmiR199a-5PmiR-206miR133a-3PmiR499-5PControl1.00±0.111.00±0.091.00±0.141.00±0.11Model1.45±0.11∗2.43±0.29∗0.78±0.06∗0.70±0.01∗
*P<0.05vscontrol group
2.5 4种miRNAs的靶基因预测及分析
通过Targetscan、miRDB、miRwalk 数据库检索上述4种miRNAs的全部靶基因,并运用FunRich软件分析预测全部靶基因相关的信号通路,并按照P值大小排序选取8个可能与心肌肥厚相关的信号通路,结果显示心肌肥厚的发生可能与血管生成、自噬等相关(P<0.05,表4)。
Tab.4The main signal pathways of four miRNAs target genes involved in cardiac hypertrophy

Signal PathwayEnrichment factorPVEGF/VEGFR signaling pathway1.3703290167.41541E-15ErbB receptor signaling pathway1.3595007363.3338E-14Endothelins1.353154489.93463E-14mTOR signaling pathway1.3553754431.19308E-13Class I PI3K signaling pathway1.3553754431.19308E-13P38 MAPK signaling pathway1.6448175784.8457E-06Wnt signaling pathway1.4452891160.002828733FoxO signaling pathway1.6798045610.012412297
3 讨论
ISO作为一种β受体激动剂,可激活交感神经系统,交感神经系统过度兴奋主要通过增加压力负荷诱导心肌肥厚的发生与发展过程,且ISO半衰期长,可较好的模拟心肌肥厚发生的自然病程,已有较多研究成功的利用ISO诱导动物心肌肥厚模型[7-8]。本实验运用高频超声探头对实验大鼠进行心脏检测,可获得清晰的二维超声图像,用于观察大鼠的心脏形态结构及运动功能,运用M型运动曲线可测得大鼠心室肌厚度和心腔大小[9]。此方法为小动物心脏肥厚实验模型提供了一种简单、经济无创的检测方法。
已有研究表明,心肌肥厚病变中miRNAs的表达具有重要作用[10-12]。Zhang等[13]用去氧肾上腺素体外诱导心室肌细胞肥厚,miR-199a-5P表达增加,芪苈强心抑制miR-199a-5P可改善心肌细胞的肥厚效应。Rane等[14]研究表明:miR199a-5P在心脏肥厚和通过ISO β-肾上腺素能受体刺激过程中上调,但在心肌细胞中通过AKT活化下调。这些结果提示miR199a-5P可用于抗心脏肥厚的分子靶点。Yang等[15]运用体内外实验研究同时证明,miR-206的过表达主要通过抑制肿瘤抑制蛋白FoxP1促进心肌肥厚。这些与本实验研究的模型组中miR199a-5P和miR206表达上调的结果一致,提示这些miRNAs对于心肌肥厚的分子诊断具有重要意义。Shieh等[16]人通过转基因小鼠模型研究发现,miR-499水平升高引起细胞肥大和心脏功能障碍。吴等[17]在细胞水平研究发现,在心肌肥厚中,miR-133a表达下调,miR-133a抑制剂antagomir-133a能进一步加强ISO诱导的心肌肥大效应,这些研究与本研究发现相符。
本文运用生物信息学方法预测了4种miRNAs参与心肌肥厚相关的靶基因及其主要信号通路,发现与文献报道的主要信号分子基本一致。与心脏重塑及心脏肥大密切相关的miRNA异常表达主要通过参与血管生成[18-20],自噬[21-25],胰岛素信号传导[26],葡萄糖代谢[27]和炎症反应[28]等发挥调节作用。而血管生成在心脏肥大的过程中起着重要作用,在体内和体外,心肌细胞肥大生长需要血管内皮生长因子(VEGF)参与,VEGF可以通过促进微血管生成从而为心肌细胞的生长提供营养物质[18],且对于心肌细胞肥大的逆转也具有重要作用[19]。通过自身磷酸化,VEGF促进VEGF受体(VEGFRs)活化和二聚化,导致信号转导级联反应。VEGF发挥作用主要通过VEGFR1和VEGFR2介导。在心肌细胞中,VEGFR2参与肥大信号传导途径,而VEGFR1可逆转心肌细胞肥大[20]。近年来,自噬对心肌肥厚的影响得到广泛关注。本文预测的ErbB受体信号通路、mTOR信号通路、PI3K 信号通路、FoxO家族信号通路均参与心肌肥厚自噬相关途径[21-24]。在对心肌肥厚作用的研究进展中,Zou等[21]通过升主动脉缩窄方法构建小鼠心肌肥厚模型,检测结果显示自噬增强,通过芪苈强心治疗后,心脏重塑和功能的改善,且可能的作用机制是对血管紧张素Ⅱ1型受体和ErbB受体激活的抑制作用。然而Li等[22]利用心脏特异性miR-199a转基因小鼠,结果显示miR-199a的过表达抑制心肌细胞自噬并在体内诱导心脏肥大,Yan等[23]的研究得出相似结果,当心肌肥厚时,自噬功能受损。自噬作为一把双刃剑[24-25],在心肌肥厚的发生发展过程中到底是通过促进还是抑制自噬发挥作用有待进一步深入研究。对心肌肥厚研究中涉及众多的相关机制,都将有可能成为用于治疗心肌肥厚的新靶点。
总之,本研究通过ISO成功构建了心肌肥厚动物模型,初步验证了心肌肥厚4种miRNAs的差异性表达,进一步通过生物信息学预测了4种miRNAs相关靶基因及参与心肌肥厚的信号传导通路,这些研究为心脏肥厚的调控机制及其防治措施提供了新思路。

