二氢杨梅素对人胃癌MKN45细胞迁移和侵袭的影响及其机制*
王凤杰, 宗星煜, 杜俊龙, 王文晟, 袁德培, 陈显兵1,△
(1. 湖北民族大学附属民大医院, 恩施 445000; 2. 湖北民族大学医学部, 恩施 445000; 3. 湖北民族大学科技学院,恩施 445000)
胃癌是消化系统常见恶性肿瘤之一,据统计胃癌已成为严重威胁人类健康的第二大常见癌症,发病率和死亡率仅次于肺癌[1]。恶性肿瘤细胞的侵袭和转移是癌症患者死亡的主要原因之一。临床常用化疗药物如铂类、氟尿嘧啶等往往有较大毒副作用,而来自传统中药的活性成分因具有副作用小、多靶点抗肿瘤作用等特点而得到广泛研究,可用于辅助肿瘤治疗。二氢杨梅素 (dihydromyricetin, DHM, 又名蛇葡萄素)是一种天然的黄酮类化合物,是传统中草药显齿蛇葡萄(又名藤茶)的主要活性成分;藤茶中总黄酮含量为43.4%~44%,二氢杨梅素含量高达37.4%~38%[2];已有大量研究表明DHM具有抗氧化、抗癌、保肝、降糖、增强人体免疫力等多种药理活性作用[3,4]。
目前DHM的抗肿瘤作用在胃癌中研究较少,前期研究发现其有抑制胃癌腹腔移植瘤恶性增殖作用[5],本研究选用人低分化胃癌MKN45细胞为研究对象,初步探讨其抑制胃癌细胞迁移和侵袭的作用及分子机制,为天然抗肿瘤药物的临床应用提供理论依据。
1 材料与方法
1.1 药物、试剂及主要仪器
DHM (Bellancom-A1046, 纯度99.51%) 购自北京寰宇科技公司,用DMSO溶解配置成50 mmol/L储存液备用,根据前期预实验结果将储存液加入到细胞培养基中稀释为相应浓度后作用于MKN45细胞; CCK-8(Cell Counting Kit-8)试剂盒、BCA蛋白定量试剂盒、β-actin抗体购自中国碧云天生物技术公司;JNK, pJNK, MMP-2, MMP-9抗体购自英国Abcam公司;Vimentin, E-cadherin抗体均购自美国Cell Signaling Technology公司;Transwell小室购自美国Corning公司。
1.2 细胞培养
人低分化胃癌MKN45细胞购自上海生命科学研究院细胞资源中心。MKN45细胞置于含10%胎牛血清 (Gibco)、1×105U/L青霉素、100 mg/L链霉素的RPMI 1640(Hyclone)培养液中,37℃、5%CO2培养箱中培养,每2~3 d传代一次。
1.3 CCK-8实验
细胞消化离心后弃上清液,加入2 ml培养基重悬,取10 μl重悬液与10 μl台酚蓝混匀,加入计数板中计数;取96孔板,每孔加入2 000个细胞,培养基补齐到100 μl;待细胞贴壁后,加入含相应浓度的DHM培养液分别继续培养24 h、48 h后,每孔加入10 μl CCK-8液继续培养4 h。用酶标仪测波长为490 nm的吸光率(A490),计算细胞存活率。公式为细胞存活率%=[(A实验孔-A对照孔)/ (A空白孔-A对照孔)]×100%。
1.4 划痕实验
取培养在24孔板的处于对数生长期的MKN45细胞,用200 μl移液枪头垂直于孔板底面进行划痕3~5条,无菌PBS漂洗3次去掉脱落细胞;再换成预先配置好的含相应浓度DHM的培养液培养48 h,倒置显微镜下拍照评价对细胞迁移能力的影响。200倍显微镜下随机选取5个视野计数划痕区域内迁移细胞数量,取平均值用于表示肿瘤细胞的迁移能力[6]。
1.5 Transwell实验
取Transwell小室,每室加入6×104个细胞,无血清培养基补齐到200 μl;置于24孔板中,小室外加入含相应浓度的DHM的有血清培养基800 μl置于37℃孵箱培养48 h;取出小室,去除培养基,PBS清洗2遍;4%多聚甲醛固定20 min,PBS清洗2遍;结晶紫染色10 min,PBS清洗2遍,用棉球擦去小室内壁细胞,通风处自然吹干,拍小室外壁细胞图片,显微镜200倍镜下随机选取5个视野,计数细胞数目,取平均值用于表示肿瘤细胞的侵袭能力[7]。
1.6 Western blot检测
取DHM处理后的各组细胞加入蛋白裂解液,按试剂盒说明提取各组细胞总蛋白。BCA法测定蛋白浓度,5×SDS凝胶上样缓冲液溶解蛋白后煮沸。SDS-聚丙烯酰胺凝胶电泳分离蛋白,将蛋白转移至孔径为0.45 μm的PVDF膜。PVDF膜用10%脱脂牛奶封闭非特异性抗原,在室温下孵育2 h。加入相应浓度的一抗,4℃下孵育过夜。TBST清洗后,加入辣根过氧化物酶标记的二抗,室温下继续孵育3 h。TBST清洗后用ECL法显色并曝光成像,凝胶图像分析软件对胶片扫描,以β-actin作为内参照,分析目的蛋白的相对表达水平。
1.7 统计学处理
2 结果
2.1 DHM对MKN45细胞活力的影响
用0,10,20, 30,40,50 μmol/L的DHM分别处理MKN45细胞24 h和48 h后,检测各组细胞A490值表示细胞活力水平,以0 μmol/L处A490值为1。结果表明随着DHM作用浓度增加及作用时间延长,MKN45细胞活力逐渐降低(P<0.05及0.01)。DHM作用MKN45细胞24及48 h的半数抑制浓度(IC50)分别为67.3和45.2 μmol/L(表1)。
2.2 DHM对MKN45细胞迁移和侵袭能力的影响
检测不同浓度DHM对细胞迁移和侵袭能力的影响,划痕实验结果表明,与对照组相比,20, 30,40 μmol/L的DHM处理48 h均可明显抑制细胞迁移能力(P<0.01,图1A,表2)。
Transwell实验结果显示与正常对照组相比,不同浓度DHM处理48 h可抑制细胞侵袭能力(P< 0.05,0.01,图1B,表2)。
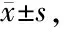
DHM (μmol/L)24 h48 hControl99.00±0.9896.84±1.441095.76±1.3091.04±1.55∗2088.13±2.52∗∗80.69±1.61∗∗3079.42±1.51∗∗73.74±3.51∗∗4068.70±1.17∗∗52.62±2.45∗∗5051.08±3.56∗∗43.13±3.20∗∗
*P<0.05,**P<0.01vscontrol group

Fig.1Effects of DHM on cell migration and invasion in MKN45 cells. MKN45 cells were treated with DHM (0,10,20,30,40 μmol/L) for 48 h

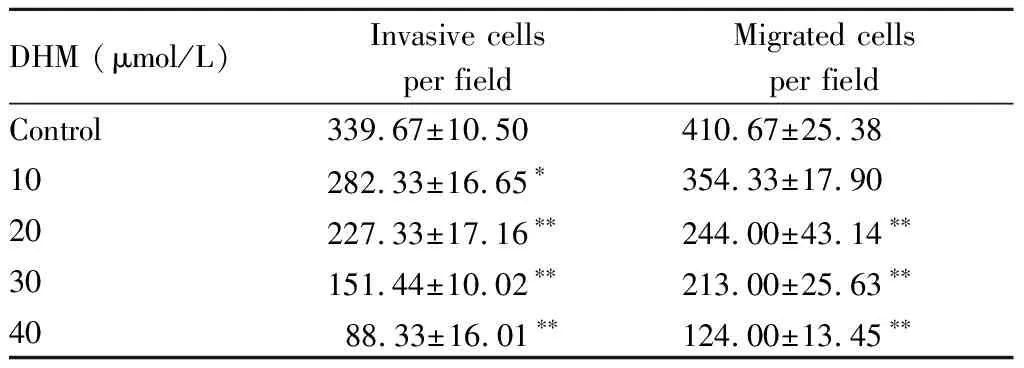
DHM (μmol/L)Invasive cells per fieldMigrated cells per fieldControl339.67±10.50410.67±25.3810282.33±16.65∗354.33±17.9020227.33±17.16∗∗244.00±43.14∗∗30151.44±10.02∗∗213.00±25.63∗∗4088.33±16.01∗∗124.00±13.45∗∗
*P<0.05,**P<0.01vscontrol group
2.3 DHM对MKN45细胞中上皮间质转化(EMT)相关蛋白表达的影响
采用Western blot检测DHM对各组细胞内EMT相关蛋白表达的影响,结果表明,与正常组相比,10 μmol/L的DHM处理对E-cadherin和Vimentin蛋白的表达无明显影响(P>0.05);而20及30 μmol/L的DHM处理48 h可明显增加E-cadherin蛋白表达(P<0.01)、降低Vimentin表达水平(P< 0.01, 图2,表3),从而逆转EMT过程。

Fig.2Effects of DHM on E-cadherin and vimentin levels in MKN45 cells by Western blot. MKN45 cells were treated with DHM (0,10,20,30 μmol/L) for 48 h
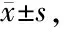

DHM (μmol/L)E-cadherinVimentin Control98.31±1.0597.68±1.531096.19±6.5791.01±2.9820118.76±8.12∗∗78.09±3.07∗∗30138.70±6.47∗∗67.43±4.22∗∗
*P<0.05,**P<0.01vscontrol group
2.4 DHM对MKN45细胞中pJNK和MMP-2/9蛋白表达的影响
采用Western blot检测10,20及30 μmol/L的DHM处理对各组细胞内pJNK及MMP-2/9表达的影响,结果发现pJNK活性表达水平随着DHM作用浓度增加而逐渐降低(P<0.05,0.01),而且MMP-2表达水平亦明显降低(P<0.01),但MMP-9表达水平无明显差异(P>0.05, 图3,表4)。

Fig.3Effects of DHM on pJNK, MMP-2 and MMP-9 levels in MKN45 cells by Western blot.
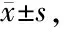
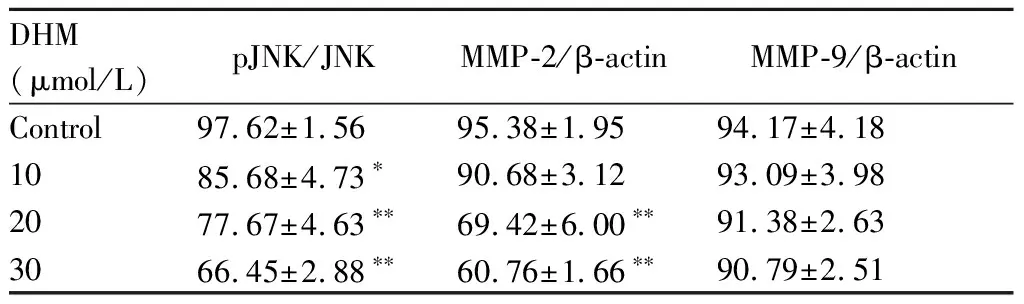
DHM (μmol/L)pJNK/JNKMMP-2/β-actinMMP-9/β-actinControl97.62±1.5695.38±1.9594.17±4.181085.68±4.73∗90.68±3.1293.09±3.982077.67±4.63∗∗69.42±6.00∗∗91.38±2.633066.45±2.88∗∗60.76±1.66∗∗90.79±2.51
*P<0.05,**P<0.01vscontrol group
2.5 DHM通过下调pJNK来抑制MMP-2表达,进而抑制MKN45细胞侵袭能力
细胞侵袭实验结果提示,与单独DHM处理相比,20 μmol/L JNK抑制剂SP600125预处理20 min,再用30 μmol/L的DHM干预处理MKN45细胞48 h可明显减少侵袭细胞的数量(P<0.01, 图4A,表5);
Western blot结果显示,相对于30 μmol/L的DHM单独作用来说,SP600125预处理与DHM干预共同作用可进一步抑制pJNK水平及降低MMP-2蛋白的表达(P<0.01, 图4B,表5)。
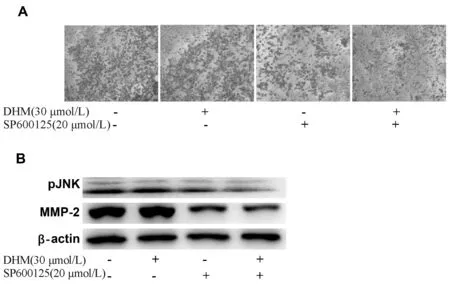
Fig.4Effects of DHM and JNK inhibitor SP600125 on cell invasion by Transwell assay and pJNK and MMP-2 levels by Western blot in MKN45 cells. MKN45 cells were treated with DHM (30 μmol/L) for 48 h and pretreated with JNK inhibitor SP600125 (20 μmol/L) for 20 min

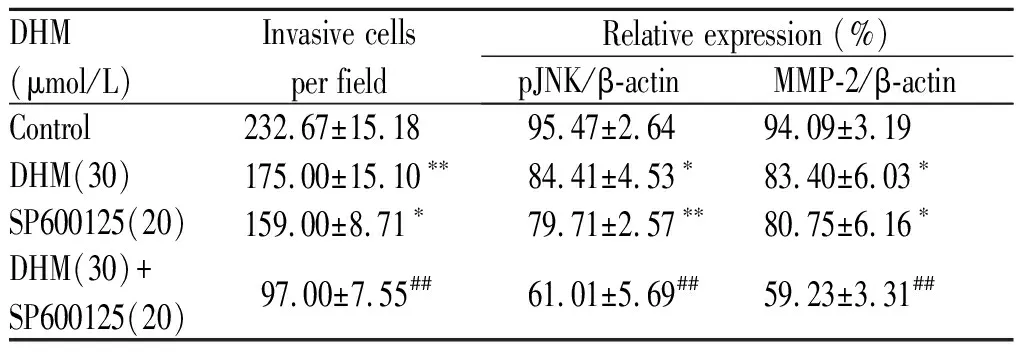
DHM (μmol/L)Invasive cells per fieldRelative expression (%)pJNK/β-actinMMP-2/β-actinControl232.67±15.1895.47±2.6494.09±3.19DHM(30)175.00±15.10∗∗84.41±4.53∗83.40±6.03∗SP600125(20)159.00±8.71∗79.71±2.57∗∗80.75±6.16∗DHM(30)+ SP600125(20)97.00±7.55##61.01±5.69##59.23±3.31##
*P<0.05,**P<0.01vscontrol group;#P<0.05,##P< 0.01vsDHM treatment group
3 讨论
众多研究表明,中药中多种活性单体及提取物可用于辅助肿瘤治疗,安全有效,且有多途径、多靶点抗肿瘤作用特点,因此研发抑制胃癌细胞侵袭和转移的药物是临床治疗的研究热点,有广泛前景。二氢杨梅素(DHM)作为一种黄酮类化合物,抗肿瘤作用明显,主要机制有抑制肿瘤细胞增殖、促进凋亡、阻滞细胞周期、诱导自噬、逆转肿瘤多药耐药以及抑制侵袭和转移等多种途径,其抗胃癌作用研究较少,因此深入探讨其作用机制可为临床肿瘤的辅助治疗及药物作用靶点的研究提供实验基础。
丝裂原活化蛋白激酶(mitogen-activated protein kinase, MAPK) 是一类在细胞增殖、分化及凋亡等细胞内信号转导中起重要作用的丝氨酸-苏氨酸蛋白激酶,包括c-Jun氨基端激酶 (c-Jun N-terminal kinase, JNK)、p38及细胞外调节蛋白激酶(extracellular regulated kinase, ERK)信号通路,其中JNK家族是参与细胞内信号转导的关键分子。基质金属蛋白酶(matrix metalloproteinases, MMPs)家族成员能降解细胞外基质成分,破坏癌细胞侵袭屏障,而且MMP-2在增强癌细胞侵袭和转移机制中发挥了关键作用[8],增加MMP-2/9活性表达可提高细胞侵袭能力[9]。亦有研究报道,在人肺癌细胞中敲除MMP-2表达后可抑制细胞增殖、侵袭及迁移,从而导致癌细胞凋亡性死亡[10],而且JNK是调节MMP-2活性及表达的重要激酶之一。JNK激酶通过上调MMP-2/9基因表达从而调节细胞迁移和侵袭[11,12],进而促进肿瘤发生和进展;MMP-2与肿瘤细胞迁移及侵袭密切相关,研究发现特异性siRNA干扰长链非编码SPRY4-IT1的表达可能通过MMP-2影响癌细胞侵袭和迁移能力[13]。以上研究表明,JNK/MMP通路可能在癌细胞侵袭和迁移中起重要作用,亦可能是抗癌药物的作用靶点之一。
以往研究表明,多种中药活性成分可通过影响MMPs活性表达来抑制恶性肿瘤细胞转移,如白藜芦醇可通过抑制JNK1/2和ERK1/2活性,调控MMPs的蛋白表达及转录来抑制肿瘤细胞迁移[14];姜黄素[15]、黄芩素[16]等化合物也可通过下调MMP-2或MMP-9表达来降低癌细胞转移能力。这些均与本研究结果相似,DHM干预人胃癌MKN45细胞可明显抑制细胞迁移及侵袭能力,并可明显降低pJNK水平及MMP-2表达,而对MMP-9表达的影响不明显;且用JNK通路抑制剂SP600125预处理可进一步促进DHM对癌细胞侵袭的抑制作用,伴有MMP-2蛋白表达的明显下调,因此DHM抑制胃癌MKN45细胞侵袭和转移作用可能与下调JNK/MMP-2信号通路有关。
上皮间质转化(epithelial-mesenchymal transition, EMT)是肿瘤性上皮细胞向间质细胞转化的生物学过程,是恶性肿瘤侵袭和转移的重要步骤。EMT过程中细胞从上皮表型转变为能动性和侵袭性更强的间充质细胞表型,并侵入组织形成转移,因此EMT的主要特点是上皮细胞标记E-钙黏蛋白(E-cadherin) 的缺失[17]和间叶细胞标记N-cadherin和Vimentin的获得[18]。有报道MMP-2和MMP-9是与EMT进程密切相关的蛋白[19],参与了癌细胞的入侵、转移和EMT过程,且发现胃癌细胞中Shh分子可通过PI3K/Akt通路促进肿瘤转移,这与促进EMT进程及增强MMP-9活性有关[19]。本研究发现,DHM干预处理亦可增加胃癌细胞中E-cadherin表达、降低Vimentin表达,从而减缓甚至逆转EMT进程,也可能是其抑制胃癌MKN45细胞侵袭的机制之一,而DHM减缓EMT过程及降低MMP-2表达之间是否存在某种联系还需研究证实。
综上所述,本研究证实,DHM可抑制EMT进程、下调JNK/MMP-2信号通路分子表达,进而抑制胃癌MKN45细胞侵袭和迁移能力;用DHM和JNK通路抑制剂共处理可进一步抑制MMP-2活性表达,表明DHM可能通过JNK/MMP-2通路发挥抑制胃癌MKN45细胞的迁移和侵袭作用。本研究结果为DHM可作为临床胃癌辅助治疗的候选剂提供了实验依据,但其作用机制复杂,还有待深入探讨。

