甘草次酸对甲状腺癌细胞SW579 凋亡的影响及其机制*
李凤岩, 陈亚光, 林大勇, 白 剑
(1. 朝阳市第二医院, 辽宁 朝阳, 122000; 2. 辽宁中医药大学, 沈阳 110847)
甲状腺癌是内分泌系统中发病率和致死率最高的恶性肿瘤,在临床的B超检测过程中,约有5%左右的甲状腺结节患者最终确诊为甲状腺癌[1]。据上海市的一项甲状腺癌的发病率调查过程中显示,甲状腺癌粗发病率区间约为 7.49/10~34.86/10万,以女性居多,是增长最快的恶性肿瘤之一[2]。在甲状腺癌的发病过程中,由于某些基因发生突变、移位或甲基化等异常变化,引发相关信号通路激活,进而导致细胞凋亡或增殖的异常,最终导致癌变的发生[3],磷脂酰肌醇3激酶-蛋白激酶B(phosphatidylinositol 3-hydroxykinase-serine/threo-ninekinase, PI3K-AKT) 信号通路是甲状腺癌发生过程中的重要信号通路之一,其主要通过调节细胞生长及制细胞凋亡,从而诱导甲状腺细胞发生癌变[4],而且AKT的高表达可以增加肿瘤细胞对化疗药物的耐药性,降低术后生存率[5]。
由于晚期或复发的甲状腺癌多数不能够再次进行手术治疗,而且对放疗化疗的敏感性下降,因此,寻找安全有效的抗甲状腺癌药物是治疗的关键。近年来的研究表明,中药无论是在肿瘤的早期还是不适用手术治疗的肿瘤晚期或对化疗的耐受力下降时,作为一种必要的治疗手段在临床上均取得了满意的效果[6],因此,从中药中寻找高效低毒的抗肿瘤活性成分已成为肿瘤药物研究与开发的热点之一。中药甘草具有补脾益气、祛痰止咳、缓急止痛、清热解毒、调和诸药等功效。甘草酸是发挥其药理活性的重要有效成分之一,甘草酸进入体内后可以水解为甘草次酸和甘草黄酮等活性成分,其中甘草次酸具有的抑制肿瘤细胞生长的药理学作用[7]。本研究在此基础上,在体外通过观察甘草次酸对甲状腺癌细胞SW579凋亡的影响,并分析其可能的作用机制。
1 材料与方法
1.1 材料和仪器
甘草次酸购买于梯希爱(上海)化成工业发展有限公司(产品标号:S0988,HPLC ≥98%);SW579购买于中国协和医科大学基础研究所;DMEM细胞培养液购买于美国Gene公司;胰酶和Hyclone小牛血清购买美国Thermo scientific公司;Annexin V/PI凋亡检测试剂盒购买于美国BD公司; PI3K、AKT、p-AKT、β-actin一抗买于美国Santa Cruze生物技术公司;其余分析纯试剂购买于国药集团北京分公司。低速离心机购买于湖南湘仪仪器装备有限公司;FACSCalibur流式细胞仪购买于美国BD公司;CO2培养箱购买于美国Thermo公司;550酶标仪和垂直系列电泳槽购买于美国Bio-Rad公司。
1.2 甲状腺癌细胞SW579的体外培养
将融合度为90%的甲状腺癌细胞SW579用PBS冲洗2次后,加入1.25%的胰酶消化3 min后,加入含有10%血清的DMEM培养基,将细胞按照2×107密度接种于6孔板中,待细胞贴壁后继续培养24 h,直至细胞的融合度接近90%,弃去上清。将在6孔板内培养各组甲状腺癌细胞SW579消化后1 500 r/min离心5 min,弃去上清液,PBS清洗2次,加入500 μl的Binding buffer重悬细胞制备单细胞悬液并调整浓度为1×106cells/ml,取200 μl细胞悬液,加入Annexin V-FITC流式抗体5 μl混匀,再加入5 μl Propidium Iodide,混匀,避光室温孵育20 min后流式细胞仪检测细胞凋亡的比例。
1.3 实验分组与处理
将接种在6孔板的甲状腺癌细胞SW579分成4组,每组设置5个复孔,对照组为含10%胎牛血清的DMEM培养基;低浓度甘草次酸组为含浓度50 μmol/L+ 10%胎牛血清的DMEM培养基;中浓度甘草次酸组为含浓度100 μmol/L+ 10%胎牛血清的DMEM培养基;高浓度甘草次酸组为含浓度200 μmol/L+ 10%胎牛血清的DMEM培养基;各组细胞分别在5%的二氧化碳培养箱中孵育24 h和48 h后进行指标检测。
1.4 甲状腺癌细胞SW579凋亡的监测
将在6孔板内培养24 h和48 h的各组甲状腺癌细胞SW579消化离心后,按照1.2中的方法检测甲状腺癌细胞SW579凋亡比例。
1.5 蛋白质印迹法检测检PI3K、AKT1、p-AKT蛋白的表达
使用蛋白裂解液将在6孔板内培养48 h的各组甲状腺癌细胞SW579裂解,将裂解产物收集到1.5 ml EP管中,煮沸5 min后通过高速离心机在12 000 r/min离心1 min。BCA法进行蛋白定量,向SDS-PAGE凝胶中加入样本,电泳分离后电转移至PVDF膜。加入PI3K(1∶1 000)、AKT1(1∶500)、p-AKT(1∶500)和β-actin(1∶1 000)抗体4℃孵育过夜后,加入二抗在37℃孵育30 min。通过凝胶成像分析系统,并通过各条带的吸光度值计算蛋白的相对表达量。
1.6 统计学处理
2 结果
2.1 不同浓度甘草次酸对甲状腺癌细胞SW579凋亡比例的影响
流式细胞仪对凋亡细胞的比例进行检测,结果显示在经过甘草次酸孵育24 h后,与对照组相比较,在50 μmol/L甘草次酸组中凋亡细胞比例升高,差异无显著性(P>0.05);在100 μmol/L和200 μmol/L甘草次酸组中凋亡细胞比例明显升高,差异具有显著性(P<0.05)。经过甘草次酸孵育48 h后,在50 μmol/L甘草次酸组中凋亡细胞比例升高,差异无显著性(P>0.05);在100 μmol/L和200 μmol/L甘草次酸组中凋亡细胞比例明显升高,差异具有显著性(P<0.05,表1)。
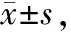

Conditions24 h48 hControl61.55±5.4567.16±5.2650 μmol/L GA73.28±6.1980.67±5.17100 μmol/L GA85.47±3.12∗89.27±5.61∗200μmol/L GA89.98±3.92∗94.13±5.47∗
*P<0.05vscontrol group
2.2 不同浓度甘草次酸对甲状腺癌细胞SW579PI3K、AKT1、p-AKT蛋白表达的影响
将经过不同浓度甘草次酸孵育48 h的各组甲状腺癌细胞SW579裂解,检测各组中PI3K、AKT1、p-AKT蛋白的表达情况。结果显示,50 μmol/L甘草次酸组中的AKT1、p-AKT、PI3K蛋白的相对表达量减少,与对照组相比无显著性差异(P>0.05);100 μmol/L和200 μmol/L甘草次酸组中的AKT1、p-AKT蛋白的表达逐渐减弱,与对照组相比有显著性差异(P<0.05),PI3K蛋白的相对表达量与对照组相比无显著性差异(P>0.05,图1,表2)。
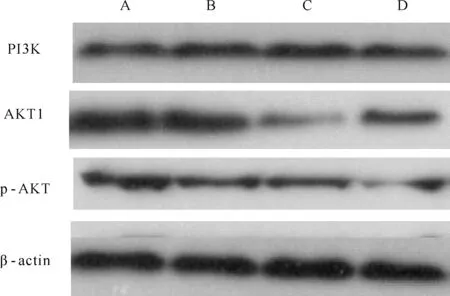
Fig.1Expression of PI3K, AKT1 and p-AKT proteins after thyroid cancer cell line SW57 incubated with different concentrations of glycyrrhetinic acid(GA) 48 h
A: Control group; B: 50 μmol/L GA group; C: 100 μmol/L GA group; D: 200 μmol/L GA group


Conditions PI3K AKT1p-AKTControl3.18±0.222.91±0.172.14±0.1350 μmol/L GA3.07±0.122.87±0.112.04±0.08100 μmol/L GA3.08±0.191.69±0.17∗1.54±0.09∗200 μmol/L GA3.05±0.251.74±0.09∗1.31±0.07∗
*P<0.05vscontrol group
3 讨论
甲状腺癌作为内分泌系统中最常见的肿瘤,其发病率和病死率都呈迅猛上升态势。甲状腺癌的发生发展过程极其复杂,探究甲状腺癌细胞凋亡的分子机制,寻找治疗肝癌甲状腺癌的新药物具有重要的临床意义。甘草别名甜草,是一种具有补脾益气、解毒缓急功效的中草药。甘草在中医药实践中应用广泛,俗称十药九草。在神农《神农本草经》中有记载“甘草,主五脏六腑寒邪气,坚筋骨,长肌肉,倍气力,金疮肿,解毒。”甘草次酸是甘草的主要有效成分之一,是一种齐墩果烷型五环三萜化合物,具有抗炎、抗病毒、免疫调节、抗氧化等药理学活性[8]。而近年来的研究证明,甘草次酸可以在体外抑制血液肿瘤、胃癌、肝癌、结肠癌、胰腺癌、卵巢癌和食管癌等多种类型的肿瘤细胞的增殖,而对于正常体细胞的毒性较小[6,9]。细胞凋亡是由基因编码控制的一种主动的生理性死亡过程,是机体维持自身稳定的重要途径之一,而细胞凋亡异常则是肿瘤发生的重要原因,因此,诱导肿瘤细胞凋亡,是抑制肿瘤发展的重要方法之一,也是当前临床肿瘤治疗的热点[10]。既往研究表明,甘草次酸可以通过多种途径诱导肿瘤细胞凋亡[11-12]。而本研究显示,甘草次酸对甲状腺癌具有抑制作用,经过100 μmol/L和200 μmol/L甘草次酸孵育24 h、48 h后,甲状腺癌细胞SW579的凋亡比例均高于对照组,且随着时间和浓度的增加,甘草次酸的促进凋亡作用呈现出一定的时间和剂量依赖性。由于药物对甲状腺癌细胞蛋白质的表达需要一定周期,基因表达的改变一般发生在给药后的24 h内,但是出现蛋白质改变一般要晚于基因表达,因此本实验在48 h后对目的蛋白进行了检测。实验细胞均进入指数增长期融合度为90%左右,因此在对照组中出现了细胞的死亡比例增加的问题,可能与细胞的生长特点有关,即在短时间细胞因缺乏生长空间和营养物质造成死亡率过高,这一是本实验需要改进的问题。
PI3K/AKT信号通路广泛存在于真核细胞中,其作为主导细胞生理功能的信号通路之一,广泛参与细胞的凋亡、细胞氧化性损伤和肿瘤发生的病理生理过程[13-15],在甲状腺癌的发生、发展过程中发挥重要作用。PI3K属于原癌基因编码蛋白,AKT是PI3K下游的重要靶激酶之一,PI3K 激活能够在质膜上产生第二信使PIP3,AKT 可与质膜上的PIP3结合并被活化,形成p-AKT。活化后的AKT能够通过磷酸化多种酶、激酶和转录因子等下游因子,进而调节包括凋亡在内的细胞功能[16]。通过有效的抑制AKT信号就能够促进肿瘤细胞的凋亡,对于肿瘤的辅助治疗有着积极的作用。鉴于PI3K /AKT通路在肿瘤细胞凋亡中的重要调控作用,本研究观察了甘草次酸对该通路中各信号分子蛋白表达的影响,以探究甘草次酸促进甲状腺癌细胞SW579凋亡分子机制。
研究结果显示,通过蛋白质印迹法检测PI3K、AKT、p-AKT 在各组中的含量表明,在经过甘草次酸孵育48 h后,100 μmol/L和200 μmol/L甘草次酸组的AKT1和p-AKT蛋白的相对表达量较对照组降低;与对照组相比较,50 μmol/L、100 μmol/L和200 μmol/L甘草次酸组的PI3K蛋白的表达量均无差异,提示甘草次酸可能主要是通过抑制下游的Akt蛋白磷酸化来促进甲状腺癌细胞SW579凋亡。
综上所述,甘草次酸作为甘草中的有效成分能够通过抑制AKT蛋白表达,促进甲状腺癌细胞SW579的凋亡,进而发挥抗肿瘤效应。甘草次酸来源广泛,成本低廉,其在肿瘤临床治疗中研发应用前景广阔、意义重大。

