Atpif1基因对K562细胞血红蛋白合成的影响*
罗 强, 李 宁, 刘伟丽, 张 艺, 陈照立△
(1. 成都中医药大学民族医药学院, 四川 成都 611137; 2. 军事科学院军事医学研究院环境医学与作业医学研究所, 天津 300050)
缺氧是指机体的细胞和组织氧供应不足,甚至出现用氧障碍,从而导致细胞和组织的代谢、功能和形态结构发生异常变化的病理过程[1,2]。氧的摄入和转运是人体能量代谢中最为重要的环节之一,当机体氧供应不足时,就会出现一系列的应激反应,如呼吸加深加快、心跳加快、血压升高等,需要通过调节心脏的泵血量、肺的扩张等方式来使组织获得足够的氧气[3]。当机体处于高原低氧这种特殊地理环境下,习服不良的人群就会诱发多种急慢性高原病,其中高原红细胞增多症(high altitude polycythemia,HAPC)是最为常见,也是危害最大的一种慢性高原病,给高原常驻人民的工作生活带来极大的影响[4],主要表现为红细胞代偿性增加,以促进其携氧能力的增加,帮助机体适应低氧环境。但红细胞的增加会使血液粘稠度增加,血液流动阻力增加,当血液处于高凝状态时会加剧各脏器缺血缺氧,从而引起耗氧量较多脏器损伤,比如脑、心、肺等,严重者甚至可因血管栓塞而猝死[5]。目前对于HAPC已有广泛研究,但其发病机制极其复杂,尚不能明确,亟待深入研究。
K562细胞是从慢性粒细胞白血病患者胸水中提取并培养的白血病细胞,处于高度未分化状态,属于红白血病细胞系,其恶性程度高,增殖快,具有可被一系列体外诱导剂诱导分化的特点[6]。其具有向红系、粒系、单核系分化的潜力[7],能够在低氧环境下被诱导分化形成红细胞和巨核细胞,是目前用于研究红系诱导分化的理想细胞模型,已成为研究细胞分化的主要细胞模型[8,9]。
Atpif1是一种能与ATP合成酶结合并抑制其ATP水解活性的小蛋白,具有阻止线粒体合酶逆转,防止细胞线粒体的耗散和缺血损伤,抑制细胞程序性死亡,维持线粒体ATP稳定的功能[10]。相关研究表明:Atpif1对于血红蛋白的合成也是必需的,沉默其表达,会导致贫血的发生[11]。血红蛋白是红细胞中唯一的非膜蛋白,红细胞的代偿性增多是HAPC的主要特征,Atpif1调节血红蛋白的合成,必然对HAPC的防治发挥重要作用。
因此本文以K562细胞为模型,观察低氧作用下,K562细胞增殖、凋亡、血红蛋白合成及Atpif1、NF-κB、Alas2的mRNA表达的变化情况,以及沉默Atpif1基因后K562细胞在低氧暴露下的血红蛋白合成和NF-κB、Alas2的mRNA表达的变化,以此来了解Atpif1基因在血红蛋白合成中发挥的作用,以期为HAPC的防治开辟新的思路和方法。
1 材料与方法
1.1 试剂与设备
K562细胞株(人红白血病细胞株)购自中科院协和细胞库。RPMI-1640 培养基(Hyclone,美国)、青链霉素混合液100×(索莱宝,北京),胎牛血清(四季青,杭州),细胞增殖-毒性检测试剂盒(CCK-8,博士德,武汉),AnnexinV-FITC/PI细胞凋亡试剂盒(凯基生物,南京),RIPA细胞裂解液(索莱宝,北京),RNA提取试剂盒(Omega,美国),SYBR Green Master ROX(Roche,美国),Lipofectamine 3000(Invitrogen,美国)。氯化血红素(生工,上海)用DMSO溶解,配置成10 mmol/L的母液,过滤分装,置于负20℃冰箱避光保存。联苯胺(生工,上海)用0.5%的冰乙酸将其配置成2 mg/ml的工作液,过滤分装,置于负20℃冰箱避光保存。3111型CO2细胞恒温培养箱、3131型CO2细胞培养箱(低氧)(Thermo,美国),TGL-6台式高速冷冻离心机(湘仪离心机仪器有限公司,长沙),酶标仪(Tecan,瑞士),倒置显微镜(Leica,德国),FACSCalibar 流式细胞仪(Bio-Red,美国),ViiA7型PCR仪(Applied Biosystems,美国),PCR仪(Bio-Red,美国)等。
1.2 K562细胞培养
将K562细胞培养于含10%胎牛血清的RPMI-1640完全培养基的灭菌培养瓶中,将培养瓶置于37℃,5%CO2,21%O2,74%N2饱和湿度培养箱内,每2~3 d换液传代,取对数生长期细胞用于后续实验。
1.3 K562细胞相对存活率的检测
将K562细胞分为常氧对照组和低氧实验组。将细胞密度调整为1×105cells/ml,取100l细胞悬液接种与96孔板,每组设置3个复孔,常氧对照组培养方法同上,低氧实验组在37℃,5%CO2,2%O2,93%N2饱和湿度低氧培养箱中培养。分别培养24 h、48 h、72 h后加入CCK-8试剂(10/孔),待反应2 h后采用酶标仪测450 nm处的吸光度(absorbance, A)值并计算相对存活率。相对存活率(%)=[(实验孔A-空白孔A)/(对照孔A-空白孔A)]×100%。本实验对照组细胞的相对存活率为100%。
1.4 K562细胞凋亡的检测
将细胞密度调至5×105cells /ml接种与6孔板,分设3个复孔,培养方法同上。分别培养24 h、48 h、72 h后收集细胞,用PBS洗2次(2 000 r/min,5 min),加入500l的Banding Buffer重悬,加入5l Annexin V-FITC和5l PI混匀,室温避光反应15 min后,设置激发波长Ex=488 nm,发射波长Em=530 nm,用流式细胞分析仪检测细胞,计算细胞凋亡率。细胞凋亡率%=早期凋亡%+晚期凋亡%。
1.5 K562细胞内血红蛋白(homoglobin , HGB)含量的检测
将细胞密度调整至5×105cells /ml接种与6孔板,每组设置3个复孔,每孔加入终浓度为50mol/L的氯化血红素溶液,培养方法同上。收集细胞,用PBS洗2次(2 000 r/min,5 min),加入40l联苯胺工作液和40l 1%H2O2,混匀,避光反应30 min后加入10%冰乙酸0.4 ml,混匀,用酶标仪检测490 nm处的吸光度(A)值。
1.6 K562细胞中平均血红蛋白(mean corpuscular hemoglobin, MCH)的检测
培养方法同上。收集细胞,用PBS洗2次,加入细胞裂解液100l,在冰上充分裂解30 min后12 000 r/min离心10 min,取上清,测定其在414 nm处的吸光度值。根据A414等于1.0时其血红蛋白浓度为0.13 mg/ml,计算K562细胞内平均血红蛋白含量。
1.7 qRT-PCR对Atpif1、NF-κB和Alas2 mRNA表达的检测
培养方法同上,收集细胞,应用OMEGA RNA提取试剂盒说明书提取RNA,按照Takara逆转录试剂盒说明书合成cDNA,引物由本实验室设计,上海生工合成,PCR引物序列见表1。应用SYBR Green 法,荧光定量PCR仪检测Atpif1,NF-κB,Alas2 mRNA的表达,PCR扩增反应体系:2×SYBR Green Master(ROX) 10l ,PCR Forward Primer 0.5l,PCR Reverse Primer 0.5l,模板2l,灭菌水7l。反应条件:Hold Stage:1:50℃ 2 min,2:95℃,10 min,PCR Stage:PCR 反应Reps:40,95℃ 15 s,60℃ 30 s,Melt Curve Stage:95℃ 15 min,60℃ 30 s,95℃ 15 s。用2-ΔΔCT公式计算目的基因的相对表达量。细胞转染siRNA后相关基因的检测与此方法相同。
Tab.1RT-PCR primer sequences and product sizes

GeneSequence of primers(5’-3’)Product size(bp)β-actinF 5’-ATCGTCCACCGCAAATGCT-3’194R 5’-CTGCTGTCACCTTCACCGTTC-3’Atpif1F 5’-GAACGATATTTCCGAGCACAG-3’209R 5’-TCTACACAGAAGTGGGCAAT-3’NF-κBF 5’-GATCCTTCTTTGACTCATAC-3’257R 5’-TTTGTGACCAACTGAACAAT-3’Alas2F 5’-TTCCATGATCCAAGGTATCCGTA-3’282R 5’-TGCATAATTCCATCACGCTC-3’
1.8 转染siRNA后对K562细胞内HGB、MCH含量检测
将K562细胞置于低氧培养箱培养,并将其分为空白组(Blank),阴性对照组(Negtive Control, NC)和si-Atpif1三组。收集对数生长期的K562细胞(2 000 r/min,5 min),用RPMI1640培养基重悬,按2×105cells/ml接种与24孔板,每孔加500l细胞悬液。其中Blank组加入50l的新鲜培养基,NC组和si-Atpif1组根据Lipofectamine 3000转染试剂说明书分别加入50l的Lipofectamine 3000+si-NC的混合液和Lipofectamine 3000+si-Atpif1的混合液,并将K562细胞置于低氧培养箱中培养48 h。其余方法同1.5、1.6。siRNA购于吉玛基因,序列见表2。

Tab. 2 The sense and antisense sequences of siRNAs
1.9 统计学处理
2 结果
2.1 低氧对K562细胞增殖的影响
与常氧对照组相比,低氧暴露后,K562细胞的活性受到明显抑制,随着时间的延长,细胞活性逐渐降低。经低氧暴露24 h、48 h、72 h后,其相对存活率(%)分别为84.6±3.6、59.0±3.48、47.5±5.34,差异具有统计学意义(P<0.05,图1)。

Fig.1The relative viability of K562 cells
*P<0.05,**P<0.01vscontrol
2.2 低氧对K562细胞凋亡的影响
与常氧对照组相比,低氧实验组细胞的凋亡率均有显著上升(P<0.01)。其中培养72 h后的细胞凋亡最为显著(图2,表3)。

Fig.2Effect of hypoxia on apoptosis of K562 cells
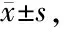

Group24 h48 h72 hControl3.97±0.255.22±0.416.88±0.37Hypoxia5.57±0.43∗∗7.33±0.26∗∗11.96±0.35∗∗
**P<0.01vscontrol
2.3 低氧对K562细胞内HGB、MCH含量变化的影响
培养72 h后,分别与常氧对照组相比,低氧实验组HGB、MCH含量显著增加(P<0.05,表4)。

Tab. 4 The contents of HGB and MCH in K562 cells
HGB: Homoglobin; MCH: Mean corpuscular hemoglobin
*P<0.05,**P<0.01vscontrol-HGB;△△P<0.01vscontrol-MCH
2.4 低氧对K562细胞mRNA表达的影响
与常氧对照组相比,低氧实验组Atpif1的mRNA水平显著增加(P<0.01),培养48 h后的mRNA水平上调最为显著;低氧实验组NF-κB的mRNA水平均高于对照组,整体呈现上调趋势(P<0.05),且培养72 h后NF-κB的mRNA水平显著高于常氧对照组(P<0.01);低氧实验组培养24 h后Alas2的mRNA水平与常氧对照组相比差异没有统计学意义(P>0.05),低氧实验组培养48 h后Alas2的mRNA水平明显高于常氧对照组(P<0.05),低氧实验组培养72 h后Alas2的mRNA水平显著上调(P<0.01,表5)。
Tab.5The expressions of Atpif1, NF-κB and Alas2 mRNA in hypoxia-treated K562 cells

GroupAtpif1NF-κBAlas2Control1.07±0.141.03±0.161.05±0.24Hypoxia-24 h3.64±0.21∗∗1.18±0.02∗0.98±0.10Hypoxia-48 h4.42±0.23∗∗1.47±0.22∗1.41±0.17∗Hypoxia-72 h1.70±0.09∗∗3.19±0.35∗∗1.87±0.16∗∗
Control: Normal oxygen control group
*P<0.05,**P<0.01vscontrol
2.5 线粒体基因Atpif1沉默对K562细胞血红蛋白合成的影响
分别与阴性对照组和空白对照组相比,si-Atpif1组的HGB、MCH含量均有降低,差异均具有统计学意义(P<0.05),其中阴性对照组和空白对照组相比没有统计学差异(P>0.05,表6)。
Tab.6The contents of HGB and MCH in K562 cells after sliencing atpif1

GroupHGBMCHBlank0.13±0.019.84±0.46Si-NC0.13±0.019.84±0.24Si-Atpif10.11±0.01∗∗##7.70±1.12∗#
Blank: Non-transfected group; Si-NC: Negative control group; Si-Atpif1: Atpif1-transfected group
*P<0.05,**P<0.01vsNC;#P<0.05,##P<0.01vsblank
2.6 线粒体基因Atpif1沉默对K562细胞mRNA表达的影响
分别与空白对照组、阴性对照组相比,si-Atpif1组的NF-κB基因的mRNA的表达水平显著下调(P<0.01),si-Atpif1组的Alas2基因的mRNA水平明显下调(P<0.05)。其中空白对照组和阴性对照组相比,Atpif1、NF-κB和Alas2基因的mRNA表达水平均没有差异(P>0.05,表7)。
Tab.7The expressions of Atpif1, NF-κB and Alas2 mRNA after sliencing Atpif1
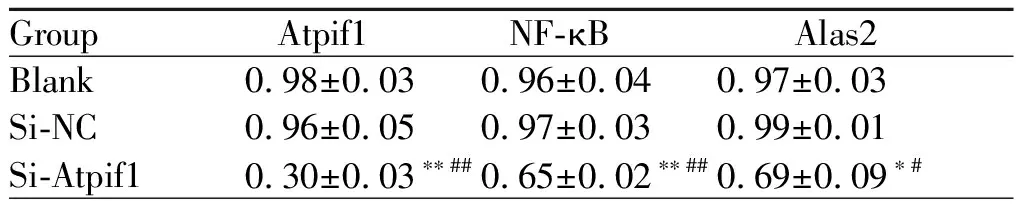
Group Atpif1 NF-κBAlas2Blank0.98±0.030.96±0.040.97±0.03Si-NC0.96±0.050.97±0.030.99±0.01Si-Atpif10.30±0.03∗∗##0.65±0.02∗∗##0.69±0.09∗#
NF-κB: Nuclear factor-κB
*P<0.05,**P<0.01vsNC;#P<0.05,##P<0.01vsblank
3 讨论
低氧环境会使细胞从有氧代谢转换为无氧酵解,同时细胞内众多参与低氧应答的因子开始表达并调控部分细胞程序性死亡[12,13],抑制K562细胞活性,促进凋亡发生。同时,细胞需要改变相关基因的表达,以适应机体发生的一系列代偿反应,其中包括血液系统的反应。低氧会使红细胞增多以增加血液对氧气的运输能力,是对低氧的重要适应代偿机制[14],血红蛋白是红细胞内运输氧的特殊蛋白质,由珠蛋白和血红素组成,血红蛋白合成的增加可提高低氧适应性。K562细胞可被诱导分化为红细胞,其血红蛋白含量的变化可以直接反应低氧对细胞诱导分化影响的变化。本实验发现,与常氧对照组相比,低氧环境可抑制细胞活性,促进细胞凋亡,同时促进K562细胞内血红蛋白合成。
Atpif1是与ATP合酶相互作用的由细胞核编码产生的线粒体蛋白[15],是调节ATP合酶的内源性小分子多肽,是调节亚铁鳌合酶活性的重要调节因子,可有效调节血红素和血红蛋白的合成[11]。在低氧环境下,Atpif1上调可以抑制ATP合酶的水解活性,维持细胞内ATP水平恒定,保持细胞正常功能[16],减少细胞损伤[17]。qRT-PCR结果表明:低氧环境可以上调Atpif1 mRNA的表达,Atpif1被激活促进血红蛋白合成,减少K562细胞损伤,增加其抗缺氧能力。NF-κB是一组调节广泛基因表达的核蛋白因子,在细胞增殖、分化与凋亡[18],免疫反应和肿瘤形成等相关的基因转录调控中发挥重要作用,同时也是调节炎症反应的一个关键转录因子,活化后能诱导促炎因子和抑炎因子表达。研究表明NF-κB能够被低氧处理所激活[19],并且参与了一系列缺氧诱导的基因表达调控[20,21]。qRT-PCR结果表明:低氧环境可以上调NF-κB mRNA的表达,NF-κB可以被低氧环境激活,调节K562细胞的增殖和凋亡。有研究表明,NF-κB也能调控Atpif1的表达[14]。Alas2基因编码的蛋白是血红素合成过程中的第一个酶也是唯一的限速酶,特异存在于红细胞系中,与血红蛋白、肌红蛋白等合成密切相关,是调控红细胞分化的重要因素[22-24]。它表达的变化可以反应血红素的合成和红系分化进程的变化[25,26],Alas2基因具有低氧反应性,在低氧环境中Alas2 mRNA上调且细胞内血红素含量也增加[27]。通过qRT-PCR结果表明,低氧环境可以上调Alas2 mRNA水平,促进K562红系分化进程,增加K562细胞内血红蛋白含量,增加K562细胞的低氧适应性。
有研究发现沉默Atpif1的表达,会导致斑马鱼贫血的发生[11]。本实验发现,沉默Atpif1基因可以抑制K562细胞血红蛋白的合成,可以下调NF-κB、Alas2 mRNA的水平。NF-κB、Alas2基因与低氧暴露和血红蛋白合成有密切联系,血红蛋白合成的减少和相关基因的下调说明,Atpif1参与调控血红蛋白的合成,并且直接影响到相关基因的表达。血红蛋白的代偿性增多是HAPC的典型特征,而Atpif1可以调节血红蛋白的合成,提示Atpif1基因可能参与了HAPC的发生。
综上所述,低氧环境可以抑制K562细胞的增殖,促进凋亡,促进血红蛋白合成和Atpif1、NF-κB和Alas2基因表达的上调。沉默Atpif1基因后,抑制血红蛋白合成且下调了NF-κB和Alas2基因的表达水平。目前普遍认为HAPC是机体习服不良所致的红细胞代偿性增多,现代医学尚未提出有效的治疗方案,普遍采取间断吸氧,或返回平原地区等方式来改善机体氧供状态,但是不能从根本上治愈。因此,深入探究Atpif1基因在血红蛋白合成中发挥的作用,探究其在HAPC发生中的作用,可以为防治HAPC提供新的思路和治疗靶点。

