乙酰左旋肉碱对大鼠脊髓损伤的神经保护作用及其机制*
沈 娟, 张雪峰, 郝 琴, 赵 琳, 杨彦玲
(延安大学医学院, 延安 716000)
脊髓损伤(spinal cord injury,SCI)是中枢神经系统的严重创伤,因高病死率和高致残率一直成为医学研究的热门课题[1-4]。乙酰左旋肉碱(acetyl-L- carnitine,ALC)是左旋肉碱的乙酰化物,是一种强有效的抗氧化剂,且极易通过血脑屏障[5],代谢清除率高,副作用少,是一种治疗SCI理想的临床药物。大量资料显示ALC具有促进脂肪代谢、转运能量、抗氧化、抗炎症、抑制凋亡等多种生物学作用[6],目前临床主要用于脑缺血、阿尔茨海默病、糖尿病神经病变、神经退行性疾病的治疗[7]。但目前脊髓损伤仍然是临床治疗和研究领域亟待攻克的世界难题,寻求和开发临床更为安全有效的治疗药物仍然意义重大。因此,本实验采用ALC干预脊髓损伤大鼠,观察不同浓度ALC对脊髓损伤大鼠后肢运动功能恢复,以及损伤节段脊髓组织形态结构的影响,探讨其对脊髓损伤的神经保护作用。
1 材料与方法
1.1 主要仪器与试剂
ALC(Sigma-Aldrich),SOD和MDA试剂盒(南京建成生物)、TUNEL试剂盒(上海碧云天)、DAPI染色液(上海碧云天)。
HI-0400脊髓打击器(美国PSI公司),LC-2010高效液相色谱仪(岛津),石蜡切片机2245(湖北徕克医疗),荧光显微镜、数码摄像显微图像系统DP70 CK40-F200(日本O-lympus)。
1.2 实验动物
64只8-10周雌性SD大鼠,体重(220±20)g,清洁级(西安交通大学医学院中心实验室提供),许可证号:陕(SCXK2017-003)。
1.3 大鼠脊髓损伤模型制备
腹腔注射2%戊巴比妥钠以40 mg/kg剂量麻醉大鼠,制备急性脊髓损伤模型,采用HI-0400脊髓打击器,以T10为中心造成大鼠脊髓不完全损伤,打击力度为200 kdyn。脊髓损伤模型制备成功标准:打击后,脊髓打击处充血水肿,大鼠随即出现摆尾反射和躯体、双下肢回缩样扑动,双下肢呈弛缓性瘫痪,视为大鼠脊髓损伤模型成功。术后腹腔注射青霉素钠2×105U/kg,每日膀胱按摩3次至大鼠可自主排尿。
1.4 动物分组及给药方法
SD大鼠随机分为假手术组(Sham)、急性脊髓损伤组(SCI)和高、中、低ALC治疗组(SCI+ALChigh、SCI+ALCmedium、SCI+ALClow)共5组,行为学实验每组8只,氧化应激实验每组3只。依据行为学实验和氧化应激实验,筛选出ALC的最佳剂量,随后将9只大鼠随机分为Sham,SCI,SCI+ALC3组,每组3只,用于TUNEL实验。Sham组只打开椎板暴露脊髓,不进行打击;SCI+ALChigh、SCI+ALCmedium、SCI+ALClow组术后30 min内分别腹腔注射300、200、100 mg/kg的ALC,每天一次连续给药1周,7 d后每周1次;给药至术后第5周;SCI组同时间点注射等量生理盐水。
1.5 灌流及取材
在大鼠术后第3日各组分别处死大鼠3只,用于SOD、MDA检测和HPLC检测。术后第7日,各组分别处死大鼠3只,用于TUNEL染色。第42日各组处死大鼠3只用于HE染色。大鼠深度麻醉后,固定大鼠并暴露心脏,右心耳取静脉血,后经升主动脉快速灌注生理盐水100 ml,部分大鼠新鲜脊髓组织-80℃保存,静脉血-20℃备用。部分大鼠用4%多聚甲醛400 ml灌注固定,以损伤中心上下各1.5 cm取脊髓组织3 cm,4%多聚甲醛后固定,梯度脱水、石蜡包埋、5 μm厚切片,用于组织切片染色。
1.6 检测方法
采用BBB评分法[8-9 ]和Rivlin 斜板实验[8]对大鼠运动功能进行评分;严格按试剂盒内步骤检测脊髓组织中SOD活性和MDA含量测定;高效液相(HPLC)测定血清中ALC含量;缺口原位末端标记测定法(TUNEL)检测脊髓细胞凋亡指数;HE染色观察损伤节段脊髓组织形态改变。
1.7 统计学处理
2 结果
2.1 行为学评价ALC对脊髓损伤大鼠运动功能的影响
2.1.1 BBB评分比较 各组大鼠在3 d、7 d、14 d、21 d、28 d、35 d、42 d不同时间点对后肢运动功能进行BBB评分。ALChigh、ALCmedium组在各时间点BBB评分与SCI组相比,均具有显著性统计学差异(P<0.01);而ALClow组在四周以后与SCI组相比,具有统计学差异(P<0.05);而在四周前与SCI组比较,无统计学差异(P>0.05,表1)。数据分析结果得出:中、高剂量组均可明显改善大鼠后肢运动功能,其中ALChigh组效果最佳。

Tab. 1 BBB scores after SCI in n=8 )
*P<0.05,**P<0.01vsSCI group
2.1.2 大鼠Rivlin 斜板实验临界度数均值比较 各组大鼠在3 d、7 d、14 d、21 d、28 d、35 d、42 d不同时间点对运动功能进行Rivlin评分。ALChigh组、ALCmedium在各时间点最大倾斜角与SCI组相比,均具有显著性统计学差异(P<0.01);而ALClow组仅在7 d、14 d与SCI组相比,具有显著性统计学差异(P<0.01),其余时间点ALClow组与SCI组相比,具有统计学差异(P<0.05,表2)。数据分析结果得出:中、高剂量组倾斜角度临界值明显增大,大鼠四肢抓力明显增强,其中ALChigh组效果最佳。
Tab. 2 Maximum oblique angle of Rivlin experiment in rats (°, n=8)
*P<0.05,**P<0.01vsSCI group
2.2 大鼠损伤节段脊髓组织中SOD、MDA的含量
取脊髓损伤第3日脊髓组织,匀浆后取组织上清液进行检测。ALCmedium组和ALChigh组MDA含量和SOD活力与SCI组相比,均具有显著性统计学差异(P<0.01);ALClow组MDA含量和SOD活力与SCI组相比,具有统计学差异(P<0.05,表3)。

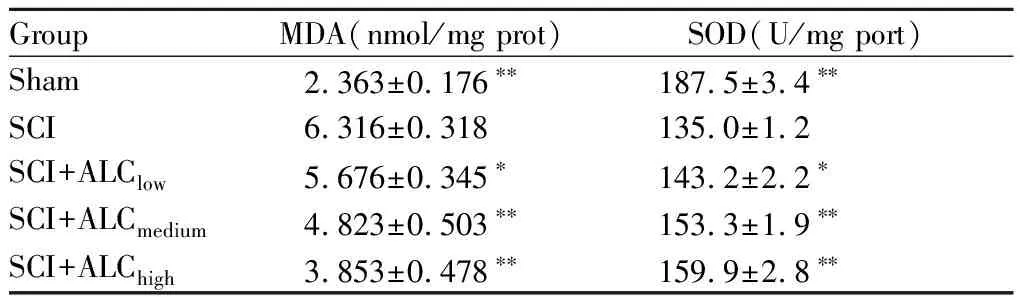
GroupMDA(nmol/mg prot)SOD(U/mg port)Sham 2.363±0.176∗∗187.5±3.4∗∗SCI6.316±0.318135.0±1.2SCI+ALClow5.676±0.345∗143.2±2.2∗SCI+ALCmedium4.823±0.503∗∗153.3±1.9∗∗SCI+ALChigh3.853±0.478∗∗159.9±2.8∗∗
*P<0.05,**P<0.01vsSCI group
2.3 HPLC测定血清中ALC含量
取脊髓损伤后第3日血清样品,在[色谱柱:250 mm×4.6 mm,5 μm;流动相:20 mmol乙酸胺+乙腈(0.1%甲酸)(25+75,v/v);流量:1.0 ml/min;柱温30℃,检测波长260 nm,进样量为10 ml/min上述色谱条件下,ALC标准品溶液、各组新鲜血清样品均峰形良好,保留时间为26 min(图1)。ALC标准品的溶液和SCI+ALC组新鲜血清中样品与在260 nm处具有相同的紫外吸收光谱,而Sham组(A)和SCI组(B)新鲜血清中样品在260 nm处未出现光谱值。说明脊髓损伤后体内无内源性ALC产生,而给药组血清中均可检测到与标准品相同的ALC物质。
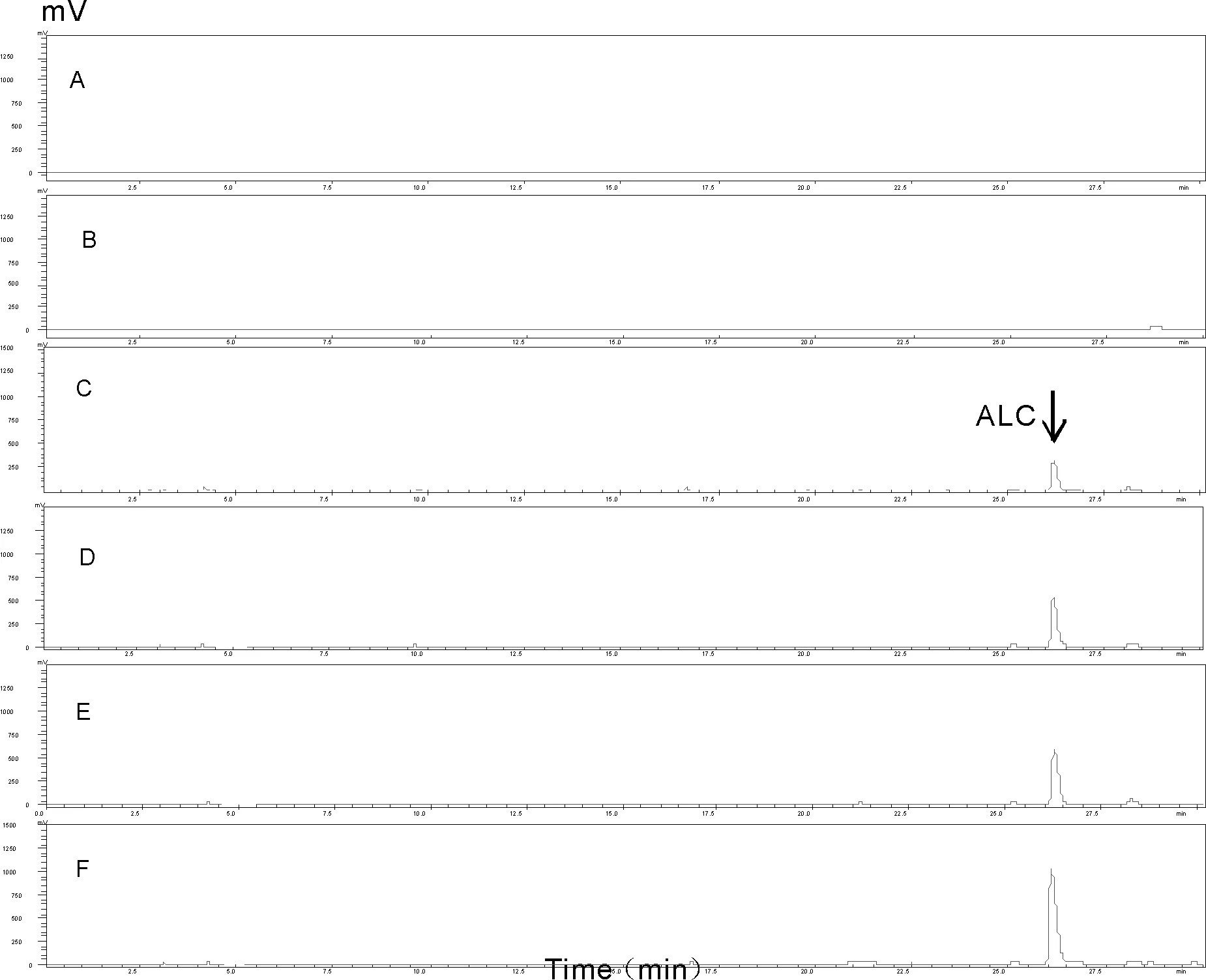
Fig.1HPLC chromatogram(n=3)
A: HPLC chomatogram of Sham group; B: HPLC chomatogram of SCI group; C: HPLC chomatogram of SCI+ALClowgroup; D: HPLC chomatogram of SCI+ALCmediumgroup; E: HPLC chomatogram of SCI+ALChighgroup; F: HPLC chomatogram of Standard ALC
2.4 脊髓组织TUNEL染色
根据行为学实验和氧化应激实验结果,选取最佳剂量ALC(300 mg/kg)为给药剂量,进行凋亡实验。TUNEL染色结果显示:术后第7日,各组脊髓损伤组织均内可见凋亡细胞,表现为细胞浆内出现棕色的TUNEL阳性颗粒,假手术组偶见阳性颗粒。与Sham组比较,SCI组神经细胞凋亡指数显著升高(由 7.13%±1.39% 增加到 39.10%±8.77%,P< 0.01);而ALC干预后,细胞凋亡指数明显降低 (18.75%±9.45%,P<0.05,图2)。结果提示,ALC可抑制损伤节段脊髓组织中神经细胞的凋亡。

Fig.2Apoptosis index in rats(n=3)
*P<0.05,**P<0.01vsSCI group
2.5 脊髓组织HE染色结果
第42日处死大鼠,各组随机取大鼠3只,灌注取材后行HE染色。Sham组镜下可见脊髓组织结构正常,灰色和白色的交界清楚,神经元轮廓清楚,细胞体大,核仁清晰可见,胞质均匀深染。脊髓中央管及血管的形态显示正常,无神经元凋亡或者胶质细胞增生的现象。SCI组镜下部分神经元细胞核固缩或者细胞质染红现象,观察到大量的红细胞和炎细胞,出现局灶性坏死的现象,尼氏体溶解消失、核固缩变小,局部细胞有空泡形成,神经原纤维扭曲变形。ALC大剂量治疗组镜下观察仍可见红细胞和炎细胞浸润,细胞轻度肿胀,部分核仁显示不清,胞质均匀,较SCI组神经元损伤及组织病理变化得到明显改善(图3,见彩图页Ⅰ)。
3 讨论
脊髓损伤是一种严重的中枢神经系统创伤性疾病,以高致残率和病死率为其主要特点[2,10],且有逐年上升的趋势。脊髓损伤后可引发中枢神经细胞发生一系列细胞和分子事件,包括炎症反应、氧化应激反应、凋亡和细胞坏死。除了损伤部位不可逆的原发性损伤外,继发性损伤在其损伤后扮演着重要角色[11],主要包括组织充血水肿、脂质过氧化、微循环障碍、兴奋性氨基酸毒性、炎症反应和细胞凋亡等[12]。如何有效的预防和逆转脊髓损伤后的继发性损伤至关重要。
多项研究已表明,氧化应激在急性脊髓损伤后急性期及后续的继发性改变中发挥着重要作用。急性脊髓损伤后氧化应激反应十分明显,急性脊髓损伤后,细胞能量代谢紊乱,致使线粒体产生过量活性氧(ROS),ROS类物质并作用于细胞膜,使核酸、蛋白和脂质过氧化,进而增加细胞膜的通透性以及损坏膜的结构,造成胞内大量Ca2+积聚,最终导致细胞水肿以及毒性反应,造成大量神经细胞凋亡,进而加重二次继发性损害。除此,炎症在脊髓损伤的发病过程中也发挥着重要作用,局部损伤组织的炎性反应可加重继发性脊髓损伤的程度[13]。而且在氧化应激状态下,细胞内大量ROS激活并启动细胞内源性凋亡途径,导致神经细胞凋亡和坏死。因此,研究如何抑制炎症反应、氧化应激和内源性细胞凋亡途径对脊髓损伤后神经功能恢复意义重大。
目前,对脊髓损伤已进行了大量的实验研究,也采用了手术、药物、免疫疗法等多种治疗方法的尝试,但临床治疗效果依然不佳,这使得对脊髓损伤的研究任重而道远。ALC是一种强抗氧化剂,具有促进脂肪代谢和转运能量、抗氧化、抑制炎症和凋亡等多种重要生物学功能,而且较易通过血-脑屏障到达神经中枢。临床已应用于肝脏疾病、心血管疾病以及男性不育症等方面的治疗,也有实验资料提示ALC具有神经保护作用[14-16]。但对ALC神经保护作用的机制研究报道较少。
因此,本实验通过不同剂量ALC干预脊髓损伤大鼠,观察其对脊髓损伤后神经功能恢复的影响,为临床应用ALC治疗脊髓损伤进一步提供实验依据。从实验结果我们得出,ALC能明显促进脊髓损伤大鼠运动功能的恢复,其中以中高剂量组(300 mg/kg)效果最佳。本研究结果提示,ALC可明显减少炎性细胞浸润,抑制氧化应激反应和神经细胞凋亡,进而促进脊髓损伤后神经功能的恢复。

