低氧对人肺动脉平滑肌和人肺动脉内皮细胞中HMGB1及相关炎症因子表达的影响*
卜宝英, 徐喜媛Δ, 韩俊萍, 杨敬平
(1. 内蒙古医科大学第三附属医院呼吸与危重症医学科, 包头 014010; 2. 邯郸第一医院, 河北 邯郸 056000)
肺动脉高压(pulmonary hypertension,PH)指肺动脉压力异常增高的病理生理改变,可致右心衰竭,严重影响患者生活及生存状态[1]。低氧性肺动脉高压(hypoxic pulmonary hypertension,HPH)指低氧导致了肺血管收缩及肺小动脉中层平滑肌细胞的异常增生发病,多发生于慢性阻塞性肺疾病(chronic obstructive pulmonary disease, COPD)和慢性高原病中,目前尚无特异性治疗HPH的有效方法[1]。高迁移率族蛋白1(high mobility group box-1,HMGB1)是高度保守的损伤相关分子模式小分子,能被免疫活性细胞主动分泌,也可被损伤和坏死的细胞被动释放,参与炎症、细胞分化、细胞迁移、细胞增殖、组织再生、干细胞招募/激活、组织重构和肿瘤发展,在COPD及PH等发病中起重要作用[2]。Yukari等[3]发现在PH小鼠模型中HMGB1表达增加,同时炎症反应增强、肺血管壁增厚,抗HMGB1抗体可减弱上述反应。本研究通过观察低氧对人肺动脉平滑肌细胞(human pulmonary artery smooth muscle cell, HPASMC)和人肺动脉内皮细胞(human pulmonary artery endothelial cells ,HPAEC)中HMGB1及相关炎症因子表达的影响,阐明其在HPH发病中对血管炎症、内皮细胞增殖、迁移等可能的作用。
1 材料与方法
1.1 主要试剂
HPASMC和HPAEC购于ATCC细胞库(美国模式培养物集存库)。DMEM培养基、RPMI-1640、标准胎牛血清购于美国BI公司。胰蛋白酶、双抗购于美国Sigma公司。RNA提取试剂盒购于上海生工生物有限公司。TransScript First-Strand cDNA Synthesis SuperMix购于北京全式金生物技术有限公司。Platinum®定量 PCR SuperMix-UDG试剂盒购于赛默飞世尔科技(中国)有限公司。RNase I购于宝生物工程(大连)有限公司(大连TakaRa公司)。MTS试剂盒购自普洛麦格(北京)生物技术有限公司。人重组HMGB1蛋白购自武汉伊莱瑞特生物科技股份有限公司。
1.2 细胞培养
根据购得的HPAEC,HPASMC细胞培养说明书,HPASMC细胞所用培养基是DMEM高糖培养基+10%FBS,HPAEC细胞所用培养基是RPMI-1640培养基+327 pmo/L IGF +414 pmol/L EGF+15%的标准胎牛血清,在37℃、5% CO2、饱和湿度条件下培养。
1.3 PCR检测HMGB1及相关受体和炎症因子在 HPASMC和HPAEC的表达
将第5代的HPAEC和HPASMC细胞按106cells/ml密度分别接种于2个中皿中培养,分对照组(Control组)和低氧组(Hypoxia组),Control组氧浓度不变,Hypoxia组放入低氧(氧浓度1%)培养箱,待细胞长到80%时,取出细胞,提取总RNA。去除基因组DNA反应,反转录PCR,Real Time PCR检测HMGB1和TLR4、9、2及SIGLE10、RAGE、CD24与IL-6 、TNF-α和CXCL8 mRNA的表达。
1.4 MTS法测定细胞增殖
细胞以约2×104cells/well细胞浓度分别接种在96孔板上,培养24 h。然后饥饿培养基(去血清 0.1%BSA)处理培养过夜。弃去饥饿培养基,再在各组中加入不同浓度的HMGB1刺激(3.45 pmol/L、34.5 pmol/L及 345 pmo/L),继续培养24、48 h。避光条件下每孔加入20 μl MTS,继续培养2~4 h。分光光度计在490 nm,630 nm波长处检测每孔的光吸收值(OD值) ,代表细胞存活率。
1.5 细胞迁移
在体外培养皿的单层贴壁细胞上,用200 μl黄枪头在细胞的中央区域划线,用1 μmol/L的HMGB1的饥饿培养基继续培养细胞(不含HMGB1的饥饿培养基作对照),在0、 8、12、24 h取出细胞培养板,拍照记录细胞生长(修复)至中央划痕区的细胞数, 迁移细胞数值以每次单独迁移实验中2~3个复孔中迁移数目的均数+标准差代表。
1.6 统计学处理
2 结果
2.1 HPASMC、HPAEC内HMGB1及受体的表达
Realtime-PCR检测HPASMC和HPAEC中HMGB1及其受体(TLR4、9、2及SIGLE10、RAGE、和CD24)mRNA的表达见表1和表2。结果显示:HPAEC和HPASMC中Hypoxia组与Control组比较HMGB1表达明显提高(t=2.69和4.31,P<0.05和0.01),RAGE亦明显增高(t=2.51和4.51,P<0.05和0.01),TLR2明显下降(t=3.99和2.54,P均< 0.05)。Hypoxia组HPAEC中CD24较Control组明显增高(t=2.86,P<0.05)。HPAEC和HPASMC中Hypoxia组与Control组比较余其它指标均无明显差异(P均>0.05)。
2.2 HPASMC、HPAEC内IL-6、TNF-α、CXCL8 mRNA的表达
RT-PCR检测IL-6、TNF-α、CXCL8 mRNA的表达见表3。结果显示:HPASMC中Hypoxia组IL-6的表达较Control组明显增高(t=2.39,P<0.05),TNF-a 及CXCL8的表达无明显差异(P均<0.05);两组HPAEC中IL-6、TNF-α及CXCL8的表达无明显差异(t=1.23、1.62及1.34,P均>0.05)。
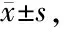
Tab. 1 The expression levels of HMGB1 and its receptor mRNA in HPAEC of hypoxia and control group (relative to GAPDH gene ×106, n=6)
HMGB1: High mobility group box-1; RAGE: Receptor of advanced glycation end products; TLR: Toll-like receptor
*P<0.05vscontrol group
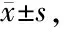
Tab. 2 The expression levels of HMGB1 and its receptor mRNA in HPASMC of hypoxia and control group (relative to GAPDH gene ×106, n=6)
*P<0.05,**P<0.01vscontrol group
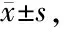
Tab. 3 The expressions of cytokines mRNA in HPAEC and HPASMC of hypoxia and control group (relative to GAPDH gene ×106, n=6)
HPAEC: Human pulmonary artery endothelial cells; HPASMC: Human pulmonary artery smooth muscle cell
*P<0.05vscontrol group
2.3 MTS法测定细胞增殖
不同HMGB1剂量对HPAEC及HPASMC 培养的增殖结果见表4。其中,与饥饿培养基(Starvation medium)相比加入345 pmol/L HMGB1的HPAEC培养抑制作用有显著性(t=7.391,P<0.01)。各浓度HMGB1对HPASMC的增殖无影响。
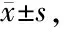
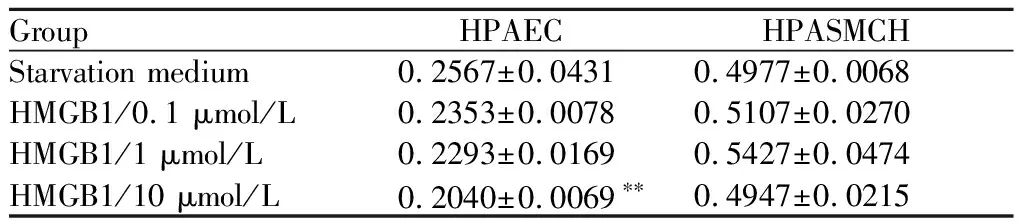
Group HPAECHPASMCHStarvation medium0.2567±0.04310.4977±0.0068HMGB1/0.1 μmol/L0.2353±0.00780.5107±0.0270HMGB1/1 μmol/L0.2293±0.01690.5427±0.0474HMGB1/10 μmol/L0.2040±0.0069∗∗0.4947±0.0215
**P<0.01vsstarvation medium
2.4 HPAEC、HPASMC迁移实验
HPAEC、HPASMC在0 h、8 h、12 h和24 h划痕实验结果见图1和图2,可直接分辨出各组细胞迁移至划痕区域数目的差异。24 h含HMGB1及不含HMGB1的饥饿培养基(control)的HPAEC、HPASMC 迁移数目分别为43.33+2.88 cells 及 45.00+3.60 cells(t=1.47,P>0.05)、40.67+1.20 cells及42.33+1.45 cells(t=1.36,P>0.05)。

Fig.1Effect of HMGB1 on HPAEC migration

Fig.2Effect of HMGB1 on HPASMC migration
3 讨论
HPH是一种致死性疾病,是慢性肺源性心脏病和慢性高原病的重要发病机制[4],肺动脉高压原因之一是HPAECs和HPASMCs由于炎症导致舒缩功能及增殖异常,肺动脉重塑,最终导致右心衰[5]。目前以促进血管舒张为目的治疗只能在有限的时间内改善HPH的临床症状和血流动力学,不能治愈该病[1],故急需发现新的治疗方法来治疗肺动脉高压,减轻肺动脉高压患者的痛苦。HMGB1是一种主要与细胞核DNA结合的非组蛋白。细胞外HMGB1是一种重要的晚期炎症递质,参与炎症免疫反应、肿瘤生长、浸润和转移[6]。低氧状态下,HMGB1由活化的炎症细胞主动释放,或由坏死细胞被动释放,释放的细胞外HMGB1进一步诱导单核/巨噬细胞、中性粒细胞和树突状细胞分泌炎症细胞因子[6]。可见,HMGB1不仅可作为促炎因子直接参与组织损伤,还在低氧时作为炎症介质加重炎症级联反应。
HMGB1作为细胞外信号分子和DAMP分子激活模式识别受体,即免疫细胞表达的表面受体,比如 Toll 样受体(Toll-like receptors,TLRs)和晚期糖基化终产物受体(receptor of advanced glycation end products, RAGE),激活胞内p38丝裂原活化蛋白激酶(mitogen activated protein kinase,MAPK)、细胞外信号调节激酶 1/2(extracellular signal-regulated kinase,ERK1/2)、核因子(nuclear factor kappa beta, NF-κB)等下游信号通路,导致促炎因子的释放、树突细胞的成熟及平滑肌细胞的趋化和增殖[7-8]。Yukari[3]等研究发现在动物实验野百合碱诱导的肺动脉高压小鼠模型中HMGB1被释放到细胞外间隙,并且抗HMGB1抗体能够减轻肺血管的炎症和肌化,从而减轻肺动脉高压的进展。本实验通过观察低氧诱导的HMGB1对HPAEC和HPASMC两种细胞的作用,结果表明,在低氧(1%氧浓度)状态下HPASMC、HPAEC中HMGB1表达量与正常对照组比较都明显升高(P<0.05及0.01),在HPASMC中升高尤其明显,说明内皮细胞和平滑肌可能是肺动脉高压中外周HMGB1增加的来源,与上述报道一致。本课题检测了HMGB1及其受体RAGE、TLR2、TLR4、TLR9、CD24、SIGLEC10 mRNA低氧刺激后的表达,结果显示:HPASM及CHPAEC中RAGE高表达(P<0.05及0.01),表明两种细胞低氧引起的HMGB1主要受体为RAGE; HPAEC中CD24受体表达明显增高(P<0.05),而TLR2表达降低(P< 0.05),表明HPAEC中低氧引起的HMGB1可能参与的受体还包括CD24。RAGE在肺组织中非常丰富,并且是HMGB1的重要的受体,研究发现RAGE在肺血管阻力增加引起右心肥厚中起作用,与在用西餐饲养的小鼠心脏肥大中的作用一致[9]。Moser等[10]研究表明血清中RAGE和HMGB1在慢性栓塞性肺动脉高压(chronic thromboembolic pulmonary hypertension, CTEPH)病人的成纤维细胞中表达增加,RAGE在特发性肺动脉高压(idiopathic pulmonary artery hypertension, IPAH)病人典型病变肺组织中表达增加,并且行肺动脉内膜剥脱术只能局部控制疾病并不能通过RAGE通路改变CTEPH的全身炎症机制。所以,HMGB1可以通过RAGE-HMGB1轴表达增加,从而在HPH的发生及发展中起作用。本研究结果中TLR的作用与以往研究[8]不同,可能与样本量有关,需要进一步探讨。
HMGB1可刺激多种与PH发病机制相关的促炎因子的产生,这些促炎介质直接作用于血管结构细胞,直接改变血管微环境,炎症细胞中HMGB1具有很强的免疫反应性,内皮细胞和平滑肌细胞释放HMGB1激活炎症反应[11]。本实验研究了HPAEC和HPASMC在低氧刺激后IL-6、CXCL8、TNF-α的表达,结果显示: HPASMC的IL-6的表达明显增高(P<0.05),而不影响HPAEC的IL-6及两种细胞TNF-α、CXCL8 的表达。IL-6是一种可以由单核细胞、上皮细胞、血管内皮细胞和血管平滑肌等多种细胞产生的细胞因子,HMGB1和内毒素可促进平滑肌和单核细胞共培养中IL-6的产生,研究发现IL-6的过度表达促进PH,基因沉默后抑制PH的发展[8,12]。但HMGB1是否直接参与调控IL-6的产生有待进一步研究。
HMGB1不仅可作为免疫细胞的趋化因子,还可作为平滑肌细胞和干细胞的趋化因子,在许多疾病中引起损伤或修复,HMGB1通过其趋化作用和抗凋亡功能参与肺血管平滑肌细胞的肺血管重构[8,10-13]。HMGB1可作为一种趋化因子,可以促进包括内皮细胞及平滑肌细胞在内的多种细胞增殖并对HPASMC细胞迁移有影响[13-15]。我们MTS实验结果表明HMGB1剂量依赖地抑制HPAEC的增殖,对HPASMC增殖无影响,这与Bauer[15]等人的研究结果一致。划痕实验结果显示HMGB1对HPASMC和HPAEC迁移无明显影响。HPASMC中低氧诱导的HMGB1对HPASMC增殖、迁移没有影响,表明低氧诱导的HMGB1不直接参与血管重塑;HPAEC中低氧诱导的HMGB1剂量依赖地抑制HPAEC增殖,但对迁移没有影响,对炎症因子表达没有影响,表明HMGB1可引起内皮功能障碍。有关HMGB1对HPASMC、HPAEC细胞增殖、迁移的文献结果存在差异,我们认为可能是由于HMGB1的浓度不同造成的,有相关文献报道了HMGB1对这两种细胞不同的增殖效果[16-17],所以HMGB1对肺动脉高压的形成能否通过平滑肌细胞和内皮细胞起作用,还需要进一步的研究。

